链脲佐菌素建立I型糖尿病大鼠模型的剂量研究①
2012-06-11蔡春荣李利生杨丹莉
杨 竞,徐 洋,蔡春荣,李利生,高 杨,杨丹莉
(遵义医学院药理教研室暨贵州省基础药理重点实验室,贵州 遵义 563000)
1型糖尿病(TIDM)是一种自身免疫性疾病,它导致胰岛 β细胞损害,继而胰岛素缺乏[1]。TIDM能引起代谢紊乱、血管和神经损害、全身多器官功能障碍,使患者寿命缩短,生活质量严重降低。至今,TIDM的具体发病机制仍不清楚,目前尚无药物可彻底治愈TIDM。TIDM防治及研究仍然是焦点。因此建立一种较理想TIDM动物模型具有重要的意义。链脲佐菌素(Streptozotocin,STZ),在上世纪50年代被证实具有抗菌、抗肿瘤作用[2]。Rackienten和 Junod发现 STZ具有致TIDM作用。STZ对胰岛β细胞具有特异毒性,使胰岛破坏,胰岛素缺乏,能很好地模拟TIDM的病程,是建立糖尿病动物模型的常用方法之一。但是目前关于STZ诱导TIDM 的剂量众说纷纭[3~5],使研究者深感困惑,希望找到理想的STZ造模剂量。因此,本研究组在过去研究的基础上,选择50,65mg/kgSTZ,研究其对SD大鼠的血糖、血胰岛素、胰腺病理形态学的影响,旨在探索STZ制造TIDM动物模型的理想剂量。
1 材料与方法
1.1 材料
1.1.1 动物 成年 SD大鼠,雄性,体重(320±10)g,购自重庆第三军医大学动物实验中心,许可证号为SCXK~(军)2007~017。
1.1.2 试剂 STZ购自 sigma公司;碘[125I]胰岛素放射免疫分析试剂购自北京科美生物技术有限公司;柠檬酸缓冲液,配制成0.1 mol/L,pH值4.2。
1.1.3 仪器 血糖仪及血糖试纸(稳步型),购自强生公司。
1.2 方法
1.2.1 分组 实验前用血糖仪测定大鼠空腹血糖,根据美国糖尿病协会(ADA)推荐的诊断标准血糖在3.15~6.19 mmol/L方能入选。入选的38只成年健康雄性SD大鼠随机分为三组,其中STZ 55组、STZ65组各16只,对照组6只,分别腹腔注射STZ55 mg/kg(STZ55组)、65 mg/kg(STZ65组)和等体积柠檬酸缓冲液(对照组)。
1.2.2 TIDM模型的制备 所有大鼠在造模前禁食12 h,临用前以柠檬酸缓冲液将STZ配制成1%溶液。给予STZ后大鼠即出现多饮多食多尿的症状,48 h后测其空腹血糖,血糖≥7.0 mmol/L并持续升高,第7天空腹血糖≥11.1 mmol/L可视为造模成功。成模后每周检测体重及空腹血糖,观察大鼠的一般状况。
1.2.3 观察各组大鼠成模率(成模率=成模大鼠数量/造模大鼠数量)及死亡率(死亡率=死亡大鼠数量/造模大鼠数量)。
1.2.4 第28天,所有大鼠以10%水合氯醛麻醉,取血清,同位素放射免疫试剂法测血清胰岛素(INS)。
1.2.5 取各组大鼠胰腺组织以4%多聚甲醛固定48 h,脱水,包埋,HE染色,观察其形态学改变。
2 数据统计处理
数值数据以均数(x)±标准差(S)表示,应用SPSS 12.0进行统计学分析处理,单因素方差分析进行差异比较。
3 结果
3.1 STZ对大鼠一般情况的影响 STZ55,STZ65组大鼠造模成功后均出现精神萎靡,活动度差,毛晦暗脱落,进食量及饮水量增至造模前两倍,尿量明显增多,垫料潮湿且有酸臭味,需每日更换垫料2次。对照组无明显变化。
3.2 STZ对动物死亡率及模型成功率的影响 对照组(n=6)大鼠未见死亡及空腹血糖升高。STZ55组分别于第27、28天各有1只大鼠死亡,同时,1只造模后第2天空腹血糖<7.0 mmol/L且不升高,3只第7天 <11.1 mmol/L,视为未成模。STZ65组于第14、17、20、22天分别有 1只大鼠死亡;2只第7天<11.1 mmol/L视为未成模。结果(见表1)。
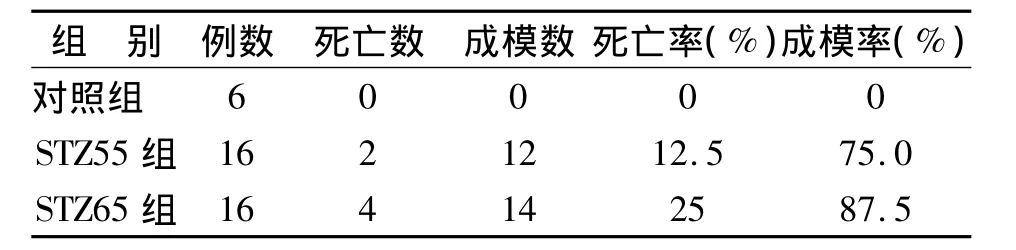
表1 不同剂量的STZ所致1型糖尿病(TIDM)模型的成模率及死亡率
3.3 STZ对大鼠体重变化的影响 与对照组比较,STZ55,STZ65组成模大鼠体重均明显减轻(均P<0.05),但第3周开始,STZ55组与STZ65组体重变化出现明显差异。STZ55组体重开始增加,而STZ65组体重继续减轻。结果(见图1)。
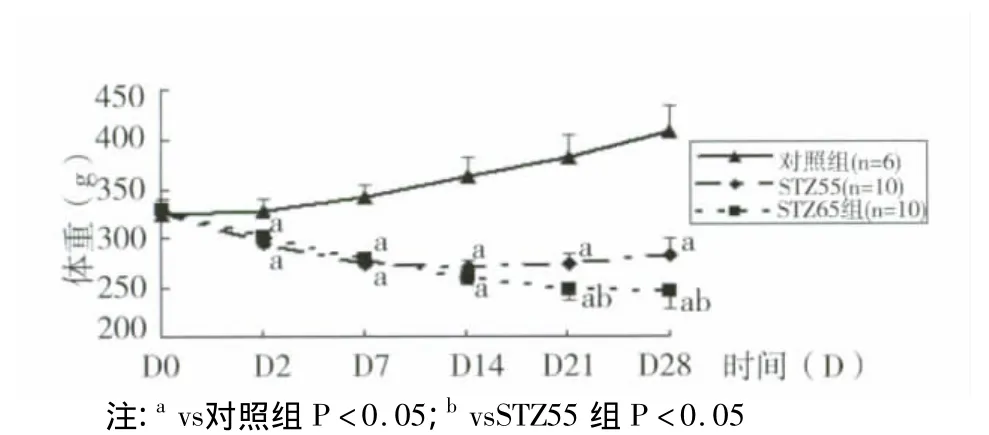
图1 STZ对大鼠体重影响( s,g)
3.4 STZ对大鼠空腹血糖的影响 造模后STZ55、STZ65组空腹血糖较对照组均显著升高(均P<0.05)。但第14天后STZ55组空腹血糖未见继续升高,且略有下降。STZ65组空腹血糖第2、7、21、28天都高于STZ55组(均P<0.05),一直稳定在高水平(≥16.7 mmol/L),且保持升高趋势。结果(见图2)。
3.5 STZ对大鼠血清胰岛素(INS)的影响 与对照组相比,STZ 55和STZ65组血清INS显著降低(P<0.05),且STZ65组血清INS水平较STZ55组更低(P<0.05),结果(见表2)。
3.6 STZ对大鼠胰腺组织形态的影响 与对照组相比,STZ55和STZ65组大鼠胰腺组织出现异常变化,胰岛正常结构被破坏,数目减少、面积变小。而STZ 65较STZ 55组胰岛减小、结构破坏更明显,结果(见图3)。
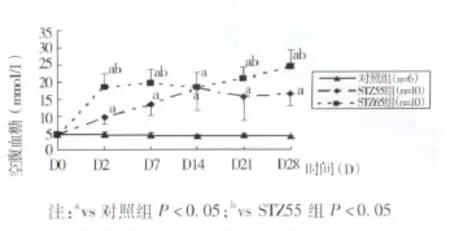
图2 STZ对大鼠空腹血糖影响(s,mmol/L)

表2 STZ对大鼠血清胰岛素(INS)水平影响 (x ± s,μIU/ml)
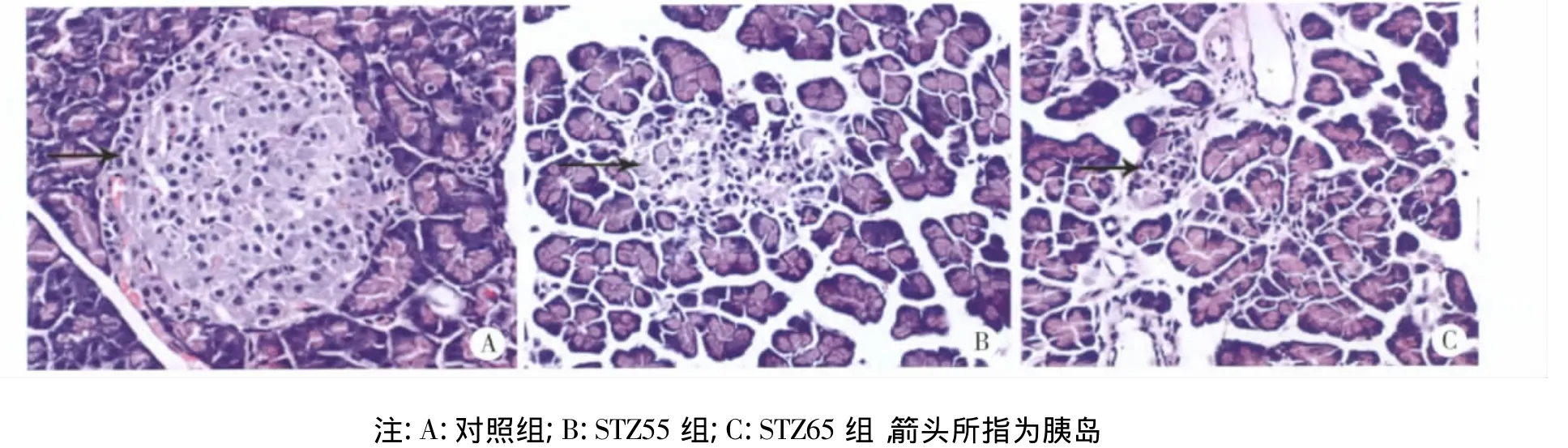
图3 STZ对大鼠胰腺组织形态的影响(HE染色,×400)
4 讨论
TIDM的制备方法多样,主要有化学试剂法、手术切除法、激素注射法、病毒诱导法、转基因及自发糖尿病动物等。虽然手术切除部分胰腺的方法制造的糖尿病模型较稳定,但对术后并发症较多;激素注射法所需造模周期长,且停药后可出现血糖自发恢复,目前已较少应用;病毒诱导的糖尿病模型虽有一定的发展前景,但其成模率相较其他几种方法较低,也伴有较严重的不良反应作用,其应用同样受到限制;转基因动物模型能自发产生糖尿病,但饲养条件要求较高且动物价格昂贵,有一定的局限性。化学试剂法常用的试剂有STZ和四氧嘧啶,其中四氧嘧啶虽可制造糖尿病模型,但有较大的肝、肾毒性,且动物存活率低[6]。STZ对胰岛β细胞具有特异的毒性,其致糖尿病作用可能通过其本身含有的葡萄糖部分结构被胰岛B细胞上低亲和力的葡萄糖转运蛋白(GLUT2)转运,特异性地作用于胰岛B细胞并引起其结构破坏和胰岛素分泌功能障碍[7]、过度激活多聚 ADP 核糖聚合酶[8]、抑制O2连接氮乙酰葡糖胺糖苷酶[9]、使胰腺组织DNA的甲基化水平增高[10]等有关。而STZ诱导的糖尿病模型动物死亡率较低,成模率较高,模型稳定,操作方便,价格相对低廉,是目前国内外最常用的造模方法。但其诱导的TIDM的成模率与死亡率均与剂量有密切关系,大剂量可能导致动物存活率过低,而剂量过小可能导致成模率低。因此,选择合适的剂量是造模的关键因素。
文献报道 STZ制造 TIDM 的剂量包括50[11]、55[10]、60[5]、65[12]、70[4]及 75[3]mg/kg 等。本课题组经过预实验研究最终选择55 mg/kg、65 mg/kg STZ进行正式研究。结果发现一次性腹腔注射55、65 mg/kg STZ后,动物均出现多饮多食多尿、体重减轻、困倦;血糖升高、血胰岛素水平降低等表现。STZ55组造模后3~4周空腹血糖比同时期对照组高,但较两周前的血糖值有所降低。其体重变化也呈类似趋势。这些变化提示55 mg/kg STZ所致的TIDM的模型不够稳定,分析原因可能与该剂量较小有关。与此现象不同的是:STZ65组血糖持续升高,体重持续下降,血胰岛素水平下降程度更低,胰岛破坏、缩小、结构紊乱较STZ55组更为严重,甚至胰岛消失。虽然STZ65组死亡率是STZ55组的1倍,但其成模率为 87.5%,比 STZ55组增加12.5%。本研究揭示一次性腹腔注射STZ65mg/kg是建立SD大鼠TIDM模型理想剂量。
[1]侯萍,刘骁,殷晓丽.1型糖尿病发病机制的研究进展[J].中国实用医药,2010,5(15):262 -263.
[2]White FR.Steptozotocin,Cancer Chemother Rep,1963,30:49-53.
[3]Yakubu M A,Sofola OA,Igbo I,Oyekan AO.Impaired endothelium-dependent and-independent relaxation of aorta from diabetic rats.Bratisl Lek Listy.2012;113(2):59-63.
[4]Wang G,Li W,Lu X,et al.Riboflavin alleviates cardiac failure in Type I diabetic cardiomyopathy.Braz J Med Biol Res.2012 Mar;45(3):205-211.
[5]Tang W B,Zhou YQ,Zhao T,et al.Effect of interleukin-6(IL-6)on the vascular smooth muscle contraction in abdominal aorta of rats with streptozotocin-induced diabetes[J].Chin J Physiol.2011 Oct 31;54(5):318-323.
[6]高红莉,刘方永,夏作理,等.实验性糖尿病动物模型的理论研究与应用[J],中国临床康复,2004,9(3):210-2.
[7]Szkudelski T.The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas[J].Physiol Res,2001,50(6):537-546.
[8]Zhang J,Dawson VL,Dawson TM,et al,Nitric oxide activation of poly(ADP-ribose)synthetase in neurotoxicity Science,1994,263(5147):687-689.
[9]HeY,Martinez Fleites C,Bubb A,et al,Structural insight into the mechanism of streptozotocin inhibition of O-Glc-NAcase Carbohydr Res,2009,344(5):627-631.
[10]王萍,闰芳,何忠效,等.糖尿病大鼠肾、胰基因组DNA甲基化状态的变化[J].北京师范大学学报(自然科学版),2001,37(2):246-249.
[11]Sebbagh,N.Cruciani-Guglielmacci,C.Ouali,F.et al,Comparative effects of Citrullus colocynthis,sunflower and olive oil-enriched diet in streptozotocin-induced diabetes in rats.Diabetes & Metabolism 2009,35:178-184.
[12]Rania N,Richard L.Reduced IP receptors in STZ-induced diabetic rat kidneys and high-glucose-treated mesangial cells.Am J Physiol,2004,287(10):189-196.
