象草4CL基因片段的克隆及RNAi表达载体构建
2012-06-08霍松陈慧朱琼华解新明
霍松,陈慧,朱琼华,解新明
(华南农业大学农学院,广东 广州510642)
象草(Pennisetumpurpureum)系禾本科(Gramineae)狼尾草属多年生C4草本植物。由于它具有产量高、再生能力强、营养丰富、适口性良好、抗逆性强等优点,使之成为了热带、亚热带地区重要的资源植物。象草无论是作为能源植物,还是饲用植物及造纸原料,其品质与低木质素含量密切相关[1-4]。
RNAi(RNA interference)是指一些与靶基因序列同源的小片段干扰RNA,可高效和特异性地使mRNA降解,从而导致内源靶基因的沉默,最终产生相应功能的表型缺失现象[5,6]。4-香豆酸:CoA连接酶(4-coumarate:CoA ligase,4CL)是木质素合成中的一个关键酶,其位于苯丙烷类衍生物生物合成的关键点上,以肉桂酸及其羟基或甲氧基衍生物,如4-香豆酸、咖啡酸、阿魏酸、5-羟基阿魏酸、芥子酸等为底物,生成相应的辅酶A酯。这些中间产物随后进入苯丙烷类衍生物支路合成途径。其中生成的香豆酰CoA、阿魏酰CoA及芥子酰CoA转化为肉桂醇衍生物,后通过还原反应生成3种木质素单体[7,8]。目前已从多种植物中分离了编码4CL的cDNA序列[9]。然而,针对禾本科植物的研究,仅有水稻(Oryzasativa)、玉米(Zeamays)和黑麦草(Loliumperenne)这3种植物[10-12],同时在对4CL进行功能分析中,也未曾有人利用到RNAi技术。因此,利用RNAi技术开展对象草这种热带亚热带地区重要资源植物的4CL基因的研究,既具有重要的理论意义,又具有深远的实践意义。
目前有关植物RNAi载体的构建有多种方法[13]。常规方法构建RNAi载体需要使用限制性内切酶和连接酶,操作起来程序繁琐,且连接效率较低。本实验采用Gateway技术构建入门克隆,利用TOPO异构酶(topoisomerase)特性,能在5min内快速高效地将PCR(polymerase chain reaction)产物整合到Gateway入门载体上,彻底简化了PCR产物进入Gateway入门载体的步骤。表达克隆的构建是利用LR反应将目的基因从入门载体重组转入目的载体[14]。本试验设计1对特异性引物,PCR扩增目的片段,利用Gateway技术,将目的片段导入目的载体,形成具有ihpRNA结构的高效表达载体,并将其转入农杆菌EHA105中。为下一阶段通过转基因技术开展象草遗传改良,培育新型象草种质资源奠定重要的基础。
1 材料与方法
1.1 材料
本研究在2010年进行。实验所用材料为华南象草(P.purpureumcv.Huanan),种植于华南农业大学宁西实验基地和校内跃进南牧草引种园。入门载体pCR?/GW/TOPO?vector购自Invitrogen公司;目的载体pCB2004B由中国科技大学向成斌教授实验室惠赠。大肠杆菌(Escherichiacoli)DH5α和根癌农杆菌(Agrobac-teriumtumefaciens)EHA105为华南农业大学农学院草生物技术实验室保存菌种。TRIzol Kit、pCR?/GW/TOPO?TA Cloning?Kit、Gateway LR reaction Kit,PurelinkTMQuick Plasmid Miniprei Kit均购自于Invitrogen公司;TaKaRa Ex Taq聚合酶、DNA回收试剂盒,购自于TaKaRa公司。其他试剂均为国产或进口分析纯试剂。
1.2 方法
1.2.1 目的片段的选择及引物设计 根据本课题组从摩特矮象草中分离的4CL基因序列(登录号:GU997597.1),与其他4种4CL基因[玉米、柳枝稷(Panicumvirgatum)、多年生黑麦草、水稻]做同源性比较,选择同源性较高的部分,利用Primer 3(version 0.4.0)设计 PCR引物4CL-L(5′-AGCCGTTCCAGGTGAAGTC-3′)和4CL-R(5′-GGCGAGATCATCCTTCTCTG-3′);同时在pCB2004B插入目的片段的两端设计2对引物,04B-L1(5′-AT CACAAAGTGCCCATCACA-3′)和 04B-R1(5′-CTGGCGTAATAGCGAAGAGG-3′)、04B-L2(5′-GCGCGC TATATTTTGTTT-3′)和04B-R2(5′-CAGGGTTTTC CCAGTCAC-3′),用于检测目的片段是否正确插入。所有引物均由Invitrogen有限公司合成。
1.2.2 目的片段的扩增 采用Trizol提取法从象草的幼嫩茎中提取总RNA,各步骤均按试剂说明书进行。用琼脂糖电泳和紫外分光光度计检测其质量,用高质量的RNA做下一步实验。按照反转录试剂盒提供的程序合成cDNA第一链。以该cDNA 20倍稀释液为模板,采用50μL扩增体系:1μL反转录cDNA、5μL 10×PCR Buffer、4μL 2.5μmol/L dNTP、0.5μL 5U/μL TaKaRa Ex Taq?、10μmol/L 4CL-L和4CL-R各2μL,加入经焦炭酸二乙酯处理过的超纯水至总体积50μL。PCR反应条件:95℃预变性5min、95℃变性30s、55℃退火30 s、72℃延伸90s,35个循环后,于72℃延伸7min。PCR产物用1.0%琼脂糖凝胶进行电泳检测,并用试剂盒回收目标条带。
1.2.3 Gateway入门克隆的构建 在0.5mL eppendorf管中,加入回收的目的片段2μL(约60ng),Salt Solution 1μL,TOPO vector 1μL,用灭菌超纯水补至6μL体系,23℃连接5min,将目的片段定向克隆到pCR?/GW/TOPO?载体中,形成入门克隆载体pENTR-4CL。具体操作方法依据pCR?/GW/TOPO?试剂盒说明书进行。入门载体pENTR-4CL用热激法转化至大肠杆菌Mach1TM-T1?感受态细胞中。将转化细胞均匀涂在含壮观霉素(100mg/L)LB(Luria-Bertani)固体培养基上,37℃培养5h,挑取单克隆到含有相同壮观霉素的LB液体培养基,再振荡培养5h。之后以4CL-L和4CL-R为引物,菌液为模板,PCR验证阳性克隆。最后选取阳性克隆的菌液,送华大基因公司测序。测序引物为 M13通用引物(M13-L:5′-GTAAAACGACGGCCAG-3′,M13-R:5′-CAGGAAACAGCTATGAC-3′)。用试剂盒提取入门载体质粒,方法参照试剂盒说明书进行,为表达克隆的构建做准备。
1.2.4 Gateway表达克隆的构建 LR反应采用10μL体系:在0.5mL的eppendorf中加入pENTR-4CL3μL(约150ng),pCB2004B5μL(约250ng),LR ClonaseⅡ2μL,25℃反应15h。加1μL蛋白酶 K,37℃反应10 min,以终止反应。片段克隆到pCB2004B载体中,形成表达克隆载体pCB2004B-4CL。取5μL反应液热激法转入大肠杆菌DH5α感受态细胞,将转化细胞均匀涂在含卡那霉素(50mg/L)LB琼脂培养基上,37℃培养14h,挑取单克隆到含有相同卡那霉素的LB液体培养基再振荡培养14h。以4CL-L和4CL-R,04B-L1和04B-R1,04BL2和04B-R2等3对引物作菌液PCR,鉴定阳性克隆。最后把阳性克隆菌液,送华大基因公司测序。测序引物为04B-L1和04B-R1,04B-L2和04B-R2。
1.2.5 农杆菌表达克隆的构建 将测序验证正确的阳性克隆载体pCB2004B-4CL,用冻融法转至农杆菌EHA105,以特异性引物4CL-L和4CL-R,04B-L1和04B-R1,04B-L2和04B-R2进行PCR扩增验证阳性菌落,同时以未转化的农杆菌EHA105做阴性对照。用1.0%琼脂糖凝胶电泳检测扩增产物。
2 结果与分析
2.1 目的片段的获得与验证
用引物4CL-L和4CL-R,以经反转录所得cDNA为模板进行PCR扩增,扩增产物用1.0%的琼脂糖电泳检测,和预期结果一致,长度大约为374bp(图1)。经进一步测序,得到如下序列:5′-AGCCGTTCCAGGTGAAG TCCGGGTCGTGCGGCACGGTGGTGCGGAACGCGGAGCTCAAGATCGTCGACCCCGACACCGGCGCCGC CCTCGGCCGGAACCAGCCCGGCGAGATCTGCATCCGCGGGGAGCAGATCGTGAAAGGGTACCTGAAC GACCCCGAGTCGACCAAGAACACCATCGACAAGGACGGGTGGCTGCACACCGGGGACATTGGTTACG TCGACGACGACGACGAGATCTTCATCGTCGACAGGCTCAAGGAGATCATCAAGTACAAGGGCTTCCA GGTGCCGCCGGCCGAGCTCGAGGCGCTCCTCATCACGCACCCGGAGATCAAGGACGCCGCCGTCGTCT CAGAGAAGGATGATCTCGCC-3′。该片段和摩特矮象草4CL基因的同源性为98%,证明为华南象草的4CL基因片段。
2.2 入门载体的阳性克隆检测
将目的片段经TOPO克隆后,可形成pENTR-4CL入门载体。pENTR-4CL载体转入大肠杆菌后,经摇菌培养获得菌液,以4CL-L和4CL-R为引物,对其进行PCR扩增,所得片段大小接近374bp(图2),证明目的片段已成功连入载体。为了更进一步验证克隆的准确性,笔者还以M13通用引物进行测序,测序结果和目的片段比对,同源性为100%,证明入门克隆构建成功。
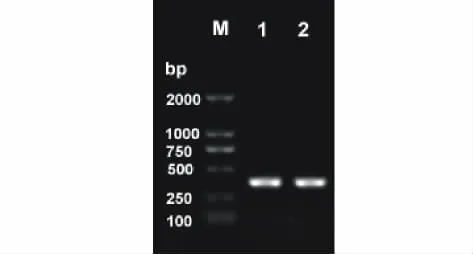
图1 电泳检测PCR扩增片段Fig.1 Detection of PCR amplification fragments
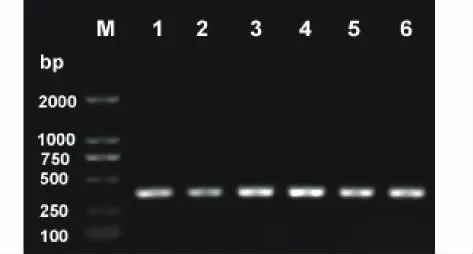
图2 电泳检测TOPO反应阳性克隆Fig.2 Detection of positive clones from TOPO reaction by agarose gel electrophoresis
2.3 表达载体的阳性克隆检测
经LR反应,将pENTR-4CL入门载体上的4CL目的片段转移到目的载体pCB2004B上,进而形成pCB2004B-4CL表达载体。
为了验证目的片段(RNA干涉片段)是否同时正确插入到表达载体的2个位点上,分别以04B-L1和04BR1,04B-L2和04B-R2这2对引物对表达载体pCB2004B-4CL的克隆产物进行了PCR验证。由表达载体pCB2004B-4CL上引物的位置可知,这2对引物扩增的目的片段长度应分别为548和772bp。使用这2对引物及目的片段上的4CL-L和4CL-R引物对3个克隆进行了PCR验证。电泳结果表明,挑取的3个克隆均为阳性(图3)。进一步测序,与目的片段比对,同源性为100%,证明表达克隆构建成功。
2.4 转化农杆菌及其验证
农杆菌是一种天然的植物遗传转化体系,被誉为“自然界最小的遗传工程师”,农杆菌介导法具有简便、高效、低拷贝数等特点[15]。借助农杆菌的感染可实现外源基因向植物细胞的转移和整合,然后通过细胞和组织培养技术,得到转基因植物。本研究也试图通过农杆菌将RNA干涉片段导入象草中。因此,将pCB2004B-4CL表达载体转入农杆菌是构建RNAi表达载体的关键一步。本实验通过冻融法将pCB2004B-4CL转入农杆菌,并以4CLL和4CL-R,04B-L1和04B-R1,04B-L2和04B-R2等3对引物对已转化的EHA105菌液进行PCR扩增,检测其是否含有表达载体。电泳结果表明,所挑取的2个克隆,均为阳性克隆(图4,泳道1~6),同时以未转化EHA105菌液做阴性对照,无条带出现(图4,泳道7~9)。
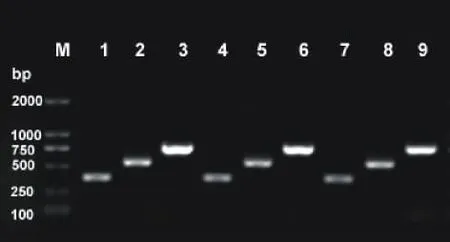
图3 电泳检测LR反应阳性克隆Fig.3 Detection of positive clones from LR reaction by agarose gel electrophoresis
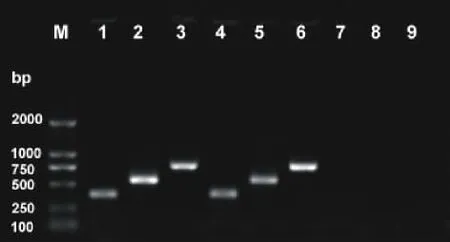
图4 电泳检测EHA105阳性菌液Fig.4 Detection of positive bacteria liquid of EHA105 by agarose gel electrophoresis
3 讨论
3.1 RNA干涉片段的大小选择
根据siRNA作用机制[16,17],siRNA途径是由双链RNA(dsRNA)引起的序列特异性基因沉默,dsRNA被内切核酸酶(Dicer)切割成21~23nt长的siRNA,此siRNA指导形成RISC蛋白复合物降解与之序列互补的mRNA,从而引发RNA沉默。目前,在植物中根据不同的实验情况及不同的dsRNA来源,主要有2种介导方法引发RNAi机制:其一是发夹式RNA(hairpin RNA,hpRNA)介导的基因沉默,其二是病毒介导的基因沉默(virus induced gene silencing,VIGS)。由于VIGS不能稳定遗传,在植物基因功能鉴定中的应用有所局限。因此构建hpRNA高效克隆和表达载体,并用于植物特定基因功能鉴定及表达调控是RNAi技术的研究热点。RNA干涉载体以含有2个反向重复序列,中间夹1个内含子所形成ihpRNA(intron-hairpin RNA)结构的沉默效果最好,平均比例高达90%以上[16]。关于发夹结构RNAi高效表达载体发夹结构臂序列的选择,以往研究认为序列长度具有一定的可塑性,在100~1 200bp均能取得良好的效果[18,19]。根据以往的经验,片段太短不利于实现高效率的RNA干涉;而太长的片段在构建中容易引起与宿主菌重组,且太长的dsRNA结构上不太稳定,一般认为所选片段的大小在300~600bp最佳[16,18]。因此,本研究中选用了374bp的长度。选择片段时,尽量选择在本基因中保守,且与其他基因无同源性的区域作为RNAi片段,和其他基因序列连续相同的碱基数不超过20,以避免把其他非目标基因沉默[20]。笔者认为,如果所研究物种的公开基因序列很少,可以将所用目的片段的序列与其他亲缘关系较近物种的全基因组进行比较,例如本研究就是通过与水稻的基因组进行比较,从而做出预判的。
华南象草的目的片段和摩特矮象草的同源性为98%,说明二者在4CL基因序列上是存在差异的。从木质素含量上来看[21],拔节后,华南象草无论是茎秆还是叶片的木质素含量均高于摩特矮象草;从4CL酶活性来看,在不同发育阶段,在这2个品种间也存在某种差异[3]。因此,在4CL基因片段上存在一定差异也就可以理解了,或许这正是上述差异的分子基础。
3.2 Gateway系统的优势
本研究利用Gateway系统将目标基因的PCR产物直接插入到载体中,形成高效沉默系统。传统的以酶切连接为基础的植物RNAi表达载体构建方法耗时费力、实验周期长;以重组PCR技术为基础结合酶切连接的植物RNAi表达载体构建方法,也由于目的片段的选择和内引物的设计受到的限制因素较多,使其应用受到了一定影响[13]。笔者采用的方法省去了酶切和连接的繁琐步骤,并将目的片段的PCR产物直接进行TOPO克隆,在完成目的片段克隆的同时也完成了入门克隆的构建,省去BP反应过程,而且可以快速的应用到其他带有attR接头位点的表达载体。
3.3 测序的重要性
在入门克隆的构建过程中,有可能连接上和目的片段大小大约一致的PCR产物,仅以目的片段的引物做菌液PCR,或者以载体引物做菌液PCR验证,均不能保证其PCR产物一定为目的片段,可能出现假阳性克隆,在实验中会偶然出现类似情况,因此有必要进行测序验证。构建表达克隆所用的入门克隆载体,一定要用测序正确的菌液进行提取,不能随便更换为其他PCR验证正确的菌液。在载体上目的片段的两端设计引物,既方便菌液PCR验证,也可以用于测序。植物基因工程中,外源基因表达量不足是得不到理想的转基因植物的主要原因之一[22],RNAi具有高度的特异性,如果有1个碱基与靶序列错配,其干扰效应可能将大大减弱[18],因此任何一步的转接都有必要做测序验证。
[1]Xie X M,Zhou F,Zhang X Q,etal.Genetic variability and relationships between MT-1elephant grass and its closely related cultivars assessed by SRAP markers[J].Journal of Genetics,2009,88(3):281-290.
[2]Farrell G,Simons S A,Hillocks R J.Aspects of the biology ofUstilagokamerunensis,a smut pathogen of Napier grass(Pennisetumpurpureum)[J].Phytopathology,2001,149:739-744.
[3]解新明,赵燕慧,霍松,等.象草不同品种木质素合成关键酶活性的动态变化[J].草地学报,2010,18(4):523-527.
[4]张向前,周峰,解新明.MT-1象草及其近缘品种的外稃微型态特征[J].草业学报,2010,19(4):159-165.
[5]Zamore P D,Tuschl T,Sharp P A,etal.RNAi:double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23nucleotide intervals[J].Cell,2000,101:25-33.
[6]Fire A,Xu S,Montgomery M K,etal.Potent and specific genetic interference by double-stranded RNA inCaenorhabditis elegans[J].Nature,1998,391:806-811.
[7]Boudet A M.A new view of lignification[J].Trends in Plant Science,1998,3:67-71.
[8]Whetten R,Sederoff R.Lignin biosynthesis[J].The Plant Cell,1995,7:1001-1003.
[9]范丙友,陆海,蒋湘宁.维管植物4-香豆酸:辅酶 A连接酶(4CL)研究进展[J].林业科学,2007,43(2):96-103.
[10]Zhao Y,Kung S D,Dube S K.Nucleotide sequence of rice 4-coumarate:CoA ligase gene 4-CL.1[J].Nucleic Acids Research,1990,18(20):6144.
[11]Heath R,McInnes R,Lidgett A,etal.Isolation and characterisation of three 4-coumarate:CoA-ligase homologue cDNAs from perennial ryegrass(Loliumperenne)[J].Journal of Plant Physiology,2002,159(7):773-779.
[12]黄胜雄,胡尚连,孙霞,等.木质素生物合成酶4CL基因的遗传进化分析[J].西北农林科技大学学报(自然科学版),2008,36(10):199-206.
[13]马建,魏益凡,厉志,等.植物RNA干扰表达载体构建方法的研究[J].安徽农业科学,2009,37(18):8364-8366.
[14]徐化学,熊建华,傅彬英.应用Gateway技术构建水稻OsDAD1基因的RNA干涉载体[J].分子植物育种,2007,5(1):133-136.
[15]张茹,李金花,柴兆祥,等.Chi基因的克隆及转基因马铃薯植株的获得[J].草业学报,2009,18(6):51-58.
[16]Helliwell C,Waterhouse P.Constructs and methods for high-throughput gene silencing in plants[J].Methods,2003,30(4):289-295.
[17]许德晖,黄辰,刘利英,等.高效siRNA设计的研究进展[J].遗传,2006,28(11):1457-1461.
[18]Wesley S V,Helliwell C A,Smith N A,etal.Construct design for efficient,effective and high-throughput gene silencing in plants[J].The Plant Journal,2001,27(6):581-590.
[19]李丽文,朱延明,李杰,等.RNAi技术在植物功能基因组学中的研究进展[J].东北农业大学学报,2007,38(1):119-124.
[20]Lei Z Y,Zhao P,Cao M J,etal.High-throughput binary vectors for plant gene function analysis[J].Journal of Integrative Plant Biology,2007,49(4):556-567.
[21]赵燕慧,解新明.象草不同品种木质素含量的动态变化研究[A].见:黄必志,毕玉芬.中国草学会牧草育种委员会第七届代表大会论文集[C].昆明:云南科技出版社,2009:149-158.
[22]贾小霞,张金文,王汉宁,等.抗真菌和抗除草剂基因多价植物表达载体构建及对烟草遗传转化的研究[J].草业学报,2009,18(1):86-93.
