植物小热激蛋白及其生物学功能研究进展
2012-06-07胡海涛张维林
胡海涛,匡 洁,张维林,杨 玲
(浙江师范大学化学与生命科学学院,浙江 金华 321004)
植物响应逆境及发育信号合成一类低分子量(15~30 kD)的热激蛋白,简称小热激蛋白(small heat shock proteins,sHSPs)[1]。植 物 含 有 丰 富 的sHSPs,普遍存在于各种组织中[2-3],其中一些具有明显的组织和发育特异性[3-5]。除高温外,sHSPs还能被低温、高盐、干旱、重金属离子、机械损伤、厌氧、病原物等多种胁迫诱导,亦能受胚胎发育、种子萌发、花粉发育、果实成熟等植物正常发育过程调控[6-7]。复杂的表达模式与其所承担的多样生物学功能密切相关[8]。
1 植物sHSPs的种类和结构特征
高分子量HSPs氨基酸序列在生物界高度保守,而植物sHSPs的氨基酸序列则高变[3]。根据氨基酸序列、免疫交联反应和在细胞中的定位,至少可将植物sHSPs分为6个亚类:细胞质或细胞核中的胞浆Ⅰ类(-CⅠ)、胞浆Ⅱ类(-CⅡ)等,定位于细胞器的叶绿体类(-CP)、线粒体类(-MT)、内质网类(-ER)和过氧化物酶体类(-Px)[2,4,9]。除了果蝇的sHSP22-ER外,4个细胞器特异性的亚类为植物所特有[10]。不同物种相同细胞器sHSPs之间的同源性比同一物种不同细胞器之间的同源性高[2]。
sHSPs具有如下保守特征:首先,所有的sHSPs初级结构包含一个由约90个氨基酸组成的称之为α-晶状体蛋白域(α-crystallin domain,ACD)的核心域,即图1中的β2~β9链,两侧各有一段N-末端和C-末端的可变延伸序列[5];不同亚类sHSPs的N-端差异很大,但都含有靶向肽[5,9]。其次,ACD由保守区CRⅠ和CRⅡ组成(图1b),CRⅠ和CRⅡ的β折叠在空间形成紧密的三文治结构(图1a)[10]。第三,大多在自然状态下以8~32个单体组成200~800 kD的寡聚复合体起作用,高等植物寡聚复合体通常有12个单体[3,11-13]。尽管这些sHSPs的氨基酸序列相似性不高,但二级结构却保守[3]。一单体凸起的β6-loop与另一单体的β2链形成β折叠,组成具有活性的二聚体(图1a),二聚体又是组装寡聚复合体的结构单元[10]。sHSPs的N-端对寡聚体的解体和单体的交换至关重要。
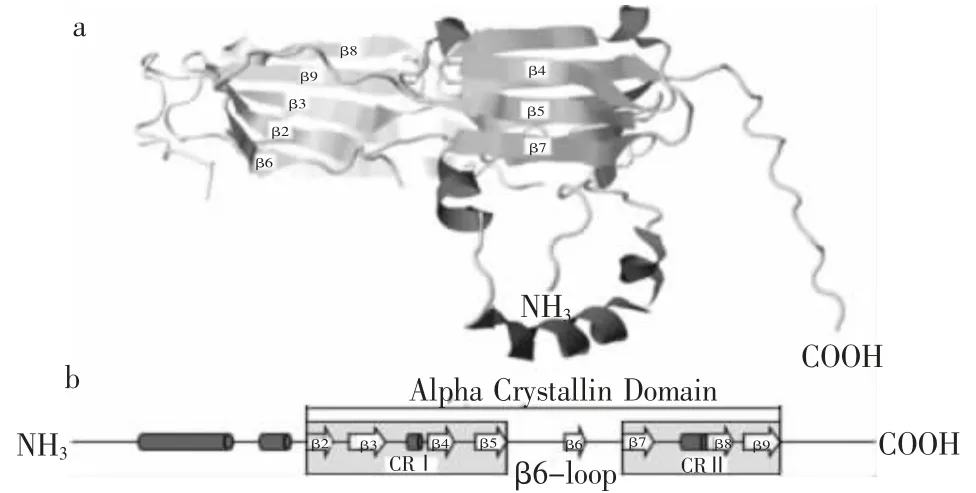
图1 典型sHSPs的结构组成[10]
2 植物sHSPs的分子伴侣功能
sHSPs同其他高分子量的HSPs一样,具有分子伴侣功能,但其本身并不能直接重新折叠热诱导的非折叠变性蛋白,而是具有很强的结合能力,可与同等重量的变性底物结合,形成稳定的复合体,从而防止不可逆的非特异性聚集[14]。如图2所示,自然状态的目标蛋白(N)在热激下变为不稳定构型蛋白(U),sHSPs通过与U的结合,避免蛋白质的凝聚。sHSPs的寡聚复合体在热激温度下解离成小的、有活性的二聚体,与U结合形成大的分子伴侣-底物复合物,在HSP100/HSP70的协作下,sHSPs结合的蛋白重新折叠恢复原来的状态。在长时间热激条件下,植物sHSPs组成直径约为40 nm中空的球型热激粒,将细胞生存关键的某些蛋白或者RNA限制于球型粒的表面或者内部加以保护;热激粒还是sHSPs与HSP70共存之地,令两类分子伴侣的合作更为有效[14]。一旦条件适宜,sHSPs便释放所结合的蛋白,随后借助依赖ATP的DnaK、ClpB/DnaK等伴侣蛋白系统进行重新折叠(图2)。也就是说,sHSPs分子伴侣活性是不利用ATP能量而被动地介导底物结合/释放循环[14],而大分子HSP70、HSP40等的功能则需要依赖于ATP[3]。

图2 sHSPs的分子伴侣作用示意图[14]
正常温度下,sHSPs中那些可与底物蛋白结合的疏水基团埋于寡聚复合体结构内部;高温下,由于寡聚复合体解体为稳定的二聚体和/或构象发生变化,使得ACD的疏水表面及N-端臂上的疏水基团外露,N-端连同ACD疏水表面的柔性能够适应结合多种具有不同疏水表面构型的变性蛋白底物。变性底物与sHSPs结合面的亲和性及兼容性,部分决定了保护底物的效率。sHSPs与底物的互作、保护底物的效率还取决于热诱导sHSPs构象变化与底物变性的相对动力学、底物聚集以及与sHSPs结合间的竞争动力学[15]。sHSPs与底物的互作非常复杂,不同种sHSPs的作用机制不同[12],同一种sHSPs因底物蛋白的不同差异也很大[15]。CⅡ类sHSPs的十二聚合体比CⅠ类的热稳定性要高,在高温下不会解体为稳定的二聚体,而是通过构象的变化有效地与变性蛋白结合[12]。从上面的模型可以看出,N-端至少部分决定sHSPs与不同底物的特异性结合[13]。胞浆类sHSPs的底物特异性很低,其多样的N-端结构使其可以与各种客户蛋白结合。C-端借助保守基序[KR]X[IV]X[IV]参与同型寡聚反应以及热激粒的形成[14]。体外、体内实验证实了植物sHSPs具有热保护可溶性蛋白的能力[15-16]。
3 sHSPs与植物的生长发育
在正常生长条件下,有些sHSPs在所有的组织中组成型表达,不受热激甚至任何胁迫诱导[2-6,8-9],说明它们并不是作为分子伴侣,而是作为特定的管家蛋白在植物的正常生长发育中行使重要的功能[2,4]。拟南芥sHSP17.8-CⅠ在正常生长温度下表达,被认为作为锚定重复蛋白2A(ankyrin repeat protein 2A,AKR2A)的辅助因子,使膜蛋白定位于叶绿体外膜。其具体的机制可能是:sHSP17.8-CⅠ在正常生理条件下以二聚体存在,即可以与叶绿体结合,又能够通过识别锚定蛋白重复域(最常见的蛋白与蛋白互作域)与AKR2A结合,而AKR2A具有与叶绿体、过氧化物体结合的能力。sHSP17.8-CⅠ不能直接与叶绿体外膜蛋白结合,而是作为AKR2A的辅助因子同时结合叶绿体和AKR2A,从而指导AKR2A特异性地靶向叶绿体而非过氧化物体,完成输送蛋白至叶绿体的任务[17]。番茄sHSP21-CP通过促进类胡萝卜素的积累,参与果实的发育[7]。
在正常生长条件下,某些sHSPs在特定发育阶段或者特定组织表达,表明其参与了特定的植物生长发育过程[18],但其中的具体作用机理尚不清楚。
4 sHSPs与植物的抗逆性
叶绿体是非胁迫和胁迫条件下活性氧分子的发生地。sHSPs-CP特有的富蛋氨酸的双亲α-螺旋三级结构可庇护氧化敏感蛋白,以及其响应氧化胁迫所进行的构象变化能力使之具有消除氧化胁迫的优势[7]。番茄sHSP21-CP具有温度依赖性的抗氧化作用,保护PSII免受活性氧的伤害,防止PSII组分的聚集,并保证组分的重新折叠[7]。耐热巨序剪股颖在Ni和Pb胁迫下的净光合作用与sHSPs-CP积累相关[19]。玉米sHSPs-CP在4种重金属(Cu、Ni、Pb、Zn)胁迫下的积累水平与严重热激诱导的量相当,其纯化物可以保护体外光合电子传递免受Pb的直接毒害[19]。将水稻sHSP26-CP转至高牛毛草中,超表达转基因株系在甲基紫精处理或热胁迫后,电导渗漏率、脂过氧化均显著低于野生型,而叶绿素荧光参数Fv/Fm却较稳定,说明sHSP26-CP在氧化胁迫或热胁迫下能够保护膜,从而保护了PSII的功能[20]。
玉米sHSPs-MT在盐胁迫下主要通过保护NADH:泛醌氧化还原酶复合体的活性,改善线粒体的电子传递[21]。将番茄sHSP23.8-MT基因导入烟草,高温下超表达转基因烟草线粒体的氧化磷酸化效率高于对照[22]。内质网是核糖体上合成的分泌蛋白的运输通道。增加sHSP-ER的量,可以有效降低内质网上蛋白的错误折叠和异常装配。番茄sHSP21.5-ER起分子伴侣的作用,使基因超表达的大肠杆菌更耐热[16]。
根结线虫侵染烟草后,诱导某些根细胞再分化转化成特异的巨细胞,巨细胞内的代谢速率非常快,为线虫及植株提供养分,所以推测巨细胞中积累的内源sHSPs行使分子伴侣的功能,以阻止大量合成蛋白的聚集[18]。烟草sHSP17的表达在接种无毒性青枯病菌株时要比接种毒性菌株高得多。sHSP17沉默株系的烟草叶片,接种无毒性青枯病菌株后,此细菌的增殖比对照组提高了10倍,而接种毒性青枯病菌株的增殖并不像前者那么快。sHSP17可能作为分子伴侣而非特异性的稳定包括信号传导等相关蛋白,从而维持细胞内适宜的环境以诱导植物的防御反应[23]。柑橘sHSP15.5和菜椒sHSP16在与亲和、非亲和菌株互作早期均积累,说明两者参与植物的基础性免疫反应,sHSP15.5和sHSP16的作用就是维持新合成蛋白质的未折叠构象,直至被HSP60和HSP70复合物等伴侣分子正确折叠[24]。
大量的研究证实sHSPs具有交叉保护功能。sHSPs在细胞中除了不依赖ATP的稳定构象受到破坏的蛋白之外,还可与脂分子协同调节膜的流动性[25]。热胁迫下蓝细菌PCC6803中的sHSP16.6-CP与类囊体膜脂相互作用后,膜脂的流动性降低;而缺失sHSP16.6-CP基因的蓝藻突变体较野生型的类囊体膜具有更高的流动性,对热更加敏感[26],从而证实了sHSPs调节膜流动性的功能。在极端温度下,膜流动性作为识别胁迫,并活化信号转导的途径已被建立。由于其他胁迫也能改变膜的流动性或者造成各种膜的伤害,sHSPs与膜的相互作用可以解释sHSPs对胁迫的交叉反应。
5 展望
sHSPs具有独特的生物学特性及功能,在植物体内广泛参与了各种复杂的功能活动。在基因水平上,sHSPs可以与mRNA结合形成热激粒,保护这些mRNA在热激胁迫下不受伤害。在蛋白水平上,sHSPs于热激及其恢复时期在细胞质和细胞器之间穿梭,参与细胞内新合成蛋白质的折叠、加工、转运以及蛋白质变性后的复性、降解,维持胞内环境的稳定,起到保护细胞不受高温伤害的分子伴侣作用[16,19,23]。近几年来,随着基因工程技术的发展,人工采用超表达的方式提高植物中sHSPs的表达以增强植物的抗逆性能力已经成为一种较为成熟的技术手段[25]。
[1] Sato Y,Yokoya S.Enhanced tolerance to drought stress in transgenic rice plants overexpressing a small heat-shock protein,sHSP17.7[J].Plant Cell Reports,2008,27:329-334.
[2] Ouyang Y,Chen J,Xie W,et al.Comprehensive sequence and expression profile analysis of Hsp20 gene family in rice[J].Plant Molecular Biology,2009,70:341-357.
[3] Waters E R,Aevermann B D,Sanders-Reed Z.Comparative analysis of the small heat shock proteins in three angiosperm genomes identifies new subfamilies and reveals diverse evolutionary patterns[J].Cell Stress Chaperones,2008,13:127-142.
[4] Sarkar N K,Kim Y K,Grover A.Rice sHsp genes:genomic organization and expression profiling under stress and development[J].BMCGenomics,2009,10:393.
[5] Siddique M,Gernhard S,Von K D P,et al.The plant sHSP superfamily:five new members in Arabidopsis thaliana with unexpected properties[J].Cell Stress Chaperones,2008,13:183-197.
[6] Dafny Y M,Tzfira T,Vainstein A,et al.Non-redundant functions of sHSP-CIs in acquired thermotolerance and their role in early seed development in Arabidopsis[J].Plant Molecular Biology,2008,67:363-373.
[7] Neta SI,Isaacson T,Lurie S,et al.Dual role for tomato HSP21:protecting photosystem IIfrom oxidative stress and promoting color changes during fruit maturation[J].The Plant Cell,2005,17:1829-1838.
[8] Li L,Xia K,Fu Y F,et al.Plant F-Box protein and its biological function[J].Agricultural Science&Technology,2010,11(7):9-12.
[9] Ma C,Haslbeck M,Babujee L,et al.Identification and characterization of a stress-inducible and a constitutive small heat shock protein targeted to the matrix of plant peroxisomes[J].Plant Physiology,2006,141:47-60.
[10]Bondino H G,Valle E M,Ten H A.Evolution and functional diversification of the small heat shock protein/α-crystallin family in higher plants[J].Planta,2012,235(6):1299-313.
[11]Basha E,Jones C,Wysocki V,et al.Mechanistic differences between two conserved classes of small heat shock proteins found in the plant cytosol[J].The Journal Biological Chemistry,2010,285:11489-11497.
[12]Lambert W,Koeck P J,Ahrman E,et al.Subunit arrangement in the dodecameric chloroplast small heat shock protein Hsp21[J].Protein Science,2011,20(2):291-301.
[13]Jaya N,Garcia V,Vierling E.Substrate binding site flexibility of the small heat shock protein molecular chaperones[M].USA:National Academy of Sciences,2009,106:15604-15609.
[14]Eyles SJ,Gierasch L M.Nature's molecular sponges:small heat shock proteins grow into their chaperone roles[M].USA:National Academy of Sciences,2010,107:2727-2728.
[15]Basha E,Friedrich K L,Vierling E.The N-terminal arm of small heat shock proteins is important for both chaperone activity and substrate specificity[J].The Journal Biological Chemistry,2006,281:39943-39952.
[16]Mamedov T G,Shono M.Molecular chaperone activity of tomato(Lycopersicon esculentum)endoplasmic reticulum-located small heat shock protein[J].Journal of Plant Research,2008,121:235-243.
[17]Kim D H,Xu Z Y,Na Y J,et al.Small heat shock protein Hsp17.8 functions as an AKR2A cofactor in the targeting of chloroplast outer membrane proteins in Arabidopsis[J].Plant Physiology,2011,157:132-146.
[18]Barcala M,García A,Cubas P,et al.Distinct heat-shock element arrangements that mediate the heat shock,but not the late-embryogenesis induction of small heat-shock proteins,correlate with promoter activation in root-knot nematode feeding cells[J].Plant Molecular Biology,2008,66:151-164.
[19]Heckathorn S A,Mueller J K,Laguidice S,et al.Chloroplast small heat-shock proteins protect photosynthesis during heavy metal stress[J].American Journal of Botany,2004,91:1312-1318.
[20]Kim K H,Alam I,Kim Y G,et al.Overexpression of a chloroplast-localized small heat shock protein OsHSP26 confers enhanced tolerance against oxidative and heat stresses in tall fescue[J].Biotechnology Letters,2012,34:371-377.
[21]Hamilton E W III,Heckathorn SA.Mitochondrial adaptations to NaCl.Complex I is protected by anti-oxidants and small heat shock proteins,whereas complex II is protected by proline and betaine[J].Plant Physiology,2001,126:1266-1274.
[22]刘 箭,庄野真理子.高温下线粒体小分子热激蛋白对柠檬酸合成酶,线粒体和花粉粒的保护作用[J].植物生理学报,2001,27:375-380.
[23]Maimbo M,Ohnishi K,Hikichi Y,et al.Induction of a small heat shock protein and its functional roles in Nicotiana plants in the defense response against Ralstonia solanacearum[J].Plant Physiology,2007,145:1588-1599.
[24]Garofalo C G,Garavaglia B S,Dunger G,et al.Expression analysis of small heat shock proteins during compatible and incompatible plant-pathogen interactions[J].Advanced Studies in Biology,2009,1:197-205.
[25]Gao C,Jiang B,Wang Y,et al.Overexpression of a heat shock protein(ThHSP18.3)from Tamarix hispida confers stress tolerance to yeast[J].Molecular Biology Reports,2012,39:4889-4897.
[26]Lee S,Owen H A,Prochaska D J,et al.HSP16.6 is involved in the development of thermotolerance and thylakoid stability in the unicellular cyanobacteruym,Synechocystis sp.PCC6803[J].Current Microbiology,2010,40:283-287.
