饲料中β-胡萝卜素和虾青素添加量对仿刺参幼参生长及抗氧化能力的影响
2012-06-06王吉桥樊莹莹徐振祥张凯丛文虎刘春宝吴岩强张剑诚
王吉桥,樊莹莹,徐振祥,张凯,丛文虎,刘春宝,吴岩强,张剑诚
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.大连金砣水产食品有限公司,辽宁大连116400;3.大连棒棰岛海产股份有限公司,辽宁大连116000)
改善水产动物抗氧化系统,提高机体抵御氧化损伤能力一直是研究的热点之一。虽然已有研究成功运用转基因技术提高了银大马哈鱼Oncorhynchus kisutch[1]等水产动物的抗氧化酶活性,但是,更多的研究是采用饲料中添加抗氧化剂的营养调控方式。在饲料中添加抗氧化剂不仅能显著提高动物机体的抗氧化能力,而且在一定程度上还能促进动物的生长;此外,还可保护饲料中的还原成分,减少营养损失,使饲料品质更加稳定。目前,应用较为广泛的抗氧化剂主要有谷胱甘肽 (glutathione,GSH)、硒、维生素A、维生素C、维生素E及类胡萝卜素等[2-3]。
类胡萝卜素是一类重要的天然色素,目前研究较多且具有较高经济价值和重要生物学功能的类胡萝卜素约有50多种,其中β-胡萝卜素、虾青素因效果好、易获得等原因,已作为天然抗氧化剂被广泛用于经济动物的饲养中。但有关饲料中添加β-胡萝卜素、虾青素对仿刺参Apostichopus japonicus生长和抗氧化能力影响方面的研究目前尚未见报道。为此,作者在饲料中分别添加不同剂量的β-胡萝卜素和虾青素,探讨促进仿刺参生长及抗氧化能力的适宜剂量,以丰富仿刺参研究的营养学内容,为科学配制仿刺参饲料,提高其养殖的经济和生态效益提供参考。
1 材料与方法
1.1 材料
1.2 方法
1.2.1 试验设计 仿刺参在实验室暂养两周后,挑选大小均匀、体质健壮的幼参315头,随机分成7组,分别放入容器为60 L(50 cm×40 cm×30 cm)的硬质塑料水槽中,每槽放15头。其中3组投喂添加30、60、90 mg/kg β-胡萝卜素的饲料,记为 A、B、C组;3组投喂添加 30、60、90 mg/kg虾青素的饲料,记为D、E、F组,对照组(G组)投喂不添加任何类胡萝卜素的基础饲料。每组设3个重复。试验共进行80 d,分4个阶段,每个阶段20 d。试验期间,自然光照,水箱内24 h充气,水温为11.0~20.0℃,盐度为35,pH为7.5左右。隔天换水1/3~1/2。换水当天17:00投喂,开始时投喂量为幼参体质量的3.0%,随着仿刺参的生长投喂量逐渐增大,略过量投喂。投喂时将糊状饲料均匀涂抹在波纹板上,放在水槽底部,涂抹饲料面朝上,将充气石压在板下。仿刺参摄食后排出的粪便呈规则的长条状,不分散,利于残饵和粪便的辨别和收集。
1.2.2 试验饲料配方 (均为质量分数)及配制基础饲料配方为:鱼粉11.0%、虾糠5.0%、海泥40.0%、贝壳粉5.0%、豆粕7.0%、酵母1.0%、电解维他0.8%、南瓜粉3.75%、木瓜粉3.75%、红薯粉3.75%、马铃薯粉3.75%、芋头粉10.0%、红枣粉2.0%、山药粉3.0%,并添加0.2%黄原胶作为增稠剂。基础饲料含粗蛋白18.7%,粗脂肪1.61%,粗灰分54.29%。
将混合陆生植物粉 (南瓜粉、木瓜粉、红薯粉、马铃薯粉、山药粉、红枣粉、芋头粉)在120℃的高压锅内糊化15 min,烘干,研磨、粉碎。饲料中所有原料均经粉碎机粉碎并用100目筛绢过滤,混合均匀,制成粉状混合物。
1.2.3 测定项目与方法 试验结束时,每组随机取20头仿刺参,用1 mL注射器从仿刺参体后部抽取体腔液后,迅速注入已放置在冰盒中的1.5 mL离心管中,以3000 r/min冷冻离心15 min,取上清液在-20℃下保存,用于体腔液中总抗氧化能力和抗氧化酶活力的测定;将各组所有仿刺参解剖,分离体壁、内脏并用过滤海水冲洗,每组留约30 g体壁,并与全部肠道组织在-20℃下保存,用于体壁成分、肠道消化酶活力的测定。
分别采用凯氏定氮法、105℃恒温干燥法、索氏抽提法 (以无水乙醚为抽提液)和高温灼烧法对饲料和仿刺参体壁中粗蛋白、水分、粗脂肪和粗灰分的含量进行测定。
按照南京建成生物工程研究所生产的试剂盒中的方法处理样品,并对仿刺参体腔液中超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)活力和总抗氧化能力 (T-AOC)及肠道中蛋白酶、淀粉酶活力进行测定与计算。
蛋白酶活力定义:在37℃下每毫克组织蛋白每分钟水解生成1 μg氨基酸相当于1个酶活力单位,以U/mg表示。
淀粉酶活力定义:在37℃下每毫克组织蛋白与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活力单位,以U/mg表示。
从图2可知,伍姓湖最高水位345.96m时,湖水容积为3.05×107m3,表面积为21.7km2,最低水位343.85 m时,湖水容积为 0.38×107m3,表面积为 9.6 km2。
在试验的第20、40、60、80天,用经海水浸泡、拧至半干的医用纱布吸干仿刺参体表的海水,用电子天平称量 (精确至0.01 g)各水槽中仿刺参的总质量,计算特定生长率:

1.3 数据处理
所有试验数据均以平均值±S.E.表示,用SPSS 16.0软件进行相关性检验、方差分析和LSD多重比较,以P<0.01为差异极显著,P<0.05为差异显著。
2 结果
2.1 仿刺参摄食添加β-胡萝卜素和虾青素饲料时的特定生长率
从表1可见:在整个试验期间,摄食添加β-胡萝卜素的仿刺参的特定生长率随添加量的增加而升高,A、B、C组分别比对照组提高 6.67%、73.33%和100.0%,但仅C组与对照组差异显著(P<0.05);摄食添加虾青素的仿刺参的特定生长率不随添加量的增加而升高,添加60 mg/kg(E组)和90 mg/kg虾青素 (F组)的仿刺参特定生长率比对照组提高113.33%和66.67%,但仅E组与对照组差异显著 (P<0.05)。这表明饲料中添加β-胡萝卜素和虾青素都能促进仿刺参的生长,但所需含量不同:β-胡萝卜素为90 mg/kg,虾青素为60 mg/kg,即虾青素的促生长效果要优于β-胡萝卜素。
在试验的不同时期,摄食不同试验饲料的仿刺参生长速度也不同,呈“低—高—低”的变化趋势。从图1可见:试验初期 (第20天),仿刺参对试验饲料和饲养环境不完全适应,生长速度呈负值;第二饲养阶段 (第40天),水温逐渐升高,仿刺参生长速度加快,摄食添加β-胡萝卜素和虾青素饲料的仿刺参的特定生长率均高于对照组 (P>0.05),且随饲料中β-胡萝卜素和虾青素含量的增加而升高;第三饲养阶段 (第60 d),水温在适宜的上限,仿刺参生长速度加快,摄食添加β-胡萝卜素和虾青素饲料的仿刺参的特定生长率均高于对照组 (P>0.05),且随饲料中β-胡萝卜素含量的增加而升高,但不随虾青素含量的增加而升高,其中E组仿刺参的特定生长率最大;第四饲养阶段 (第80天),水温升高至19.0~20.0℃,仿刺参的生长速度慢于第二、三阶段,但仍高于对照组,其中仅D组、E组仿刺参的生长速度显著快于对照组 (P<0.05)。
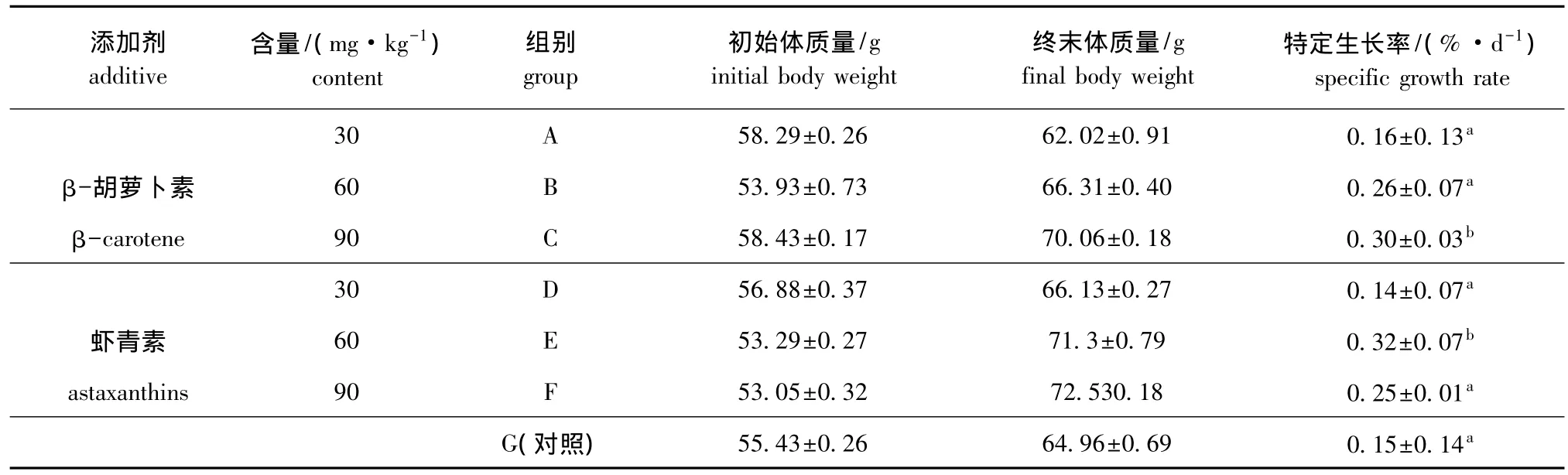
表1 摄食不同饲料的仿刺参的生长Tab.1 Specific growth rate in the sea cucumber juveniles fed the diets containing different levels of β-carotene and astaxanthins

图1 摄食不同饲料的仿刺参在不同试验阶段的生长Fig.1 Specific growth rate in the sea cucumber juveniles fed the diets containing different levels of βcarotene and astaxanthins at various experimental periods
从总体来看 (表 1),E组 (虾青素 60 mg/kg)仿刺参的生长速度最快,特定生长率为0.32%/d,其次是C组 (β-胡萝卜素90 mg/kg),为0.30%/d。将饲料中β-胡萝卜素和虾青素添加量相同的各组分别进行比较,E组的特定生长率显著高于B组 (P<0.05),C组显著高于F组 (P<0.05),但A组与D组差异不显著 (P>0.05)。
2.2 摄食不同饲料的仿刺参肠道中蛋白酶和淀粉酶的活性
从表2可见:摄食含不同剂量β-胡萝卜素和虾青素饲料的仿刺参肠道中蛋白酶和淀粉酶活力分别为59.53~61.47 U/mg和6.31~8.67 U/mg,与添加剂量没有明显的相关关系,各组间差异均不显著 (P>0.05)。
2.3 摄食不同饲料的仿刺参体腔液中的总抗氧化能力
2.3.1 总抗氧化能力 (T-AOC) 从表2可见:试验组仿刺参体腔液中的总抗氧化能力 (T-AOC)随饲料中β-胡萝卜素和虾青素含量的增加而升高,其中A、B、C组仿刺参体腔液中的T-AOC分别比对照组提高13.39%、19.40%和26.78%,仅C组显著高于对照组 (P<0.05);D、E、F组的TAOC分别比对照组提高38.25%、90.30% 和94.95%,均显著高于对照组 (P<0.05)。饲料中添加虾青素的各组仿刺参体腔液中的平均总抗氧化能力为12.77 U/mL,比添加β-胡萝卜素的各组(平均8.77 U/mL)高45.61%,表明虾青素的总抗氧化能力要优于β-胡萝卜素。

表2 摄食不同饲料的仿刺参肠道中的消化酶活性和体腔液中的总抗氧化能力Tab.2 Digestive enzyme activities in the intestine,and total antioxidation capacity in the coelomic fluid of the sea cucumber fed different diets
2.3.2 抗氧化酶活力 仿刺参体腔液中的SOD和CAT活力因饲料中添加的类胡萝卜素种类及其剂量不同而异。从图2可见:C、E、F组仿刺参体腔液中的SOD、CAT活力均显著低于对照组 (P<0.05),而A、B、D组与对照组差异均不显著 (P>0.05);饲料中添加β-胡萝卜素的各组中,C组的SOD和CAT活力最低,且显著低于A组、B组(P<0.05);饲料中添加虾青素的各组中,E组、F组的SOD和CAT活力较低,均显著低于D组 (P<0.05)。在相同添加量下,摄食含虾青素饲料的各组仿刺参体腔液中的SOD和CAT活力均低于摄食添加β-胡萝卜素的各组,但只有添加量为60 mg/kg的B组与E组间的SOD和CAT活力差异显著 (P<0.05),其余添加量相同的组间差异均不显著 (P>0.05)。
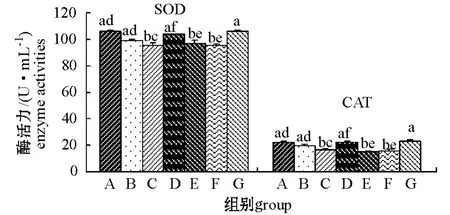
图2 摄食不同饲料的仿刺参体腔液中的抗氧化酶活力Fig.2 The antioxidative enzyme activities in the coelomic fluid of the sea cucumber juveniles fed the diets containing different levels of β-carotene and astaxanthins
2.4 摄食不同饲料的仿刺参体壁的成分
从表3可见,摄食添加β-胡萝卜素和虾青素饲料的仿刺参体壁中粗蛋白、粗脂肪和灰分的含量分别为50.87%~51.11%、5.46%~5.70%和29.57%~30.06%,各组间差异均不显著 (P>0.05)。
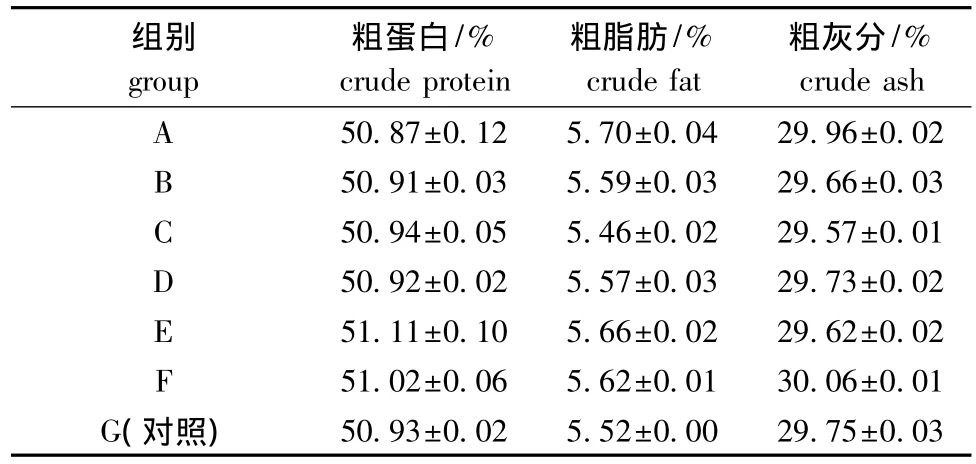
表3 摄食不同饲料的仿刺参体壁干物质的成分Tab.3 The approximate composition in the body wall of the sea cucumber juveniles fed the diets containing different levels of β-carotene and astaxanthins
3 讨论
3.1 β-胡萝卜素和虾青素对仿刺参生长的影响
目前,有关类胡萝卜素对水产动物的促生长作用的研究结果不尽相同。用分别添加虾青素和富含类胡萝卜素的雨生红球藻Haematococcus pluvialis饲喂日本囊对虾 Marsupenaeus japonicus[4],用添加虾青素的饲料饲喂红螯螯虾Cherax quadricarinatus[5],用添加虾青素的饲料饲喂虹鳟Oncorhynchus mykiss[6],用分别添加虾青素和角黄素的饲料饲喂虹鳟[7-8],其生长均与对照组无显著差异。但是,金征宇等[9]在饲料中分别添加60 mg/kg的加利红素和虾青素饲喂罗氏沼虾Macrobrachium rosenbergii,试验虾的增重率分别较对照组提高4.04%和14.48%;Rehulka 等[6]在体质量为 (178±23)g的虹鳟饲料中添加49.8 mg/kg的虾青素,84 d后试验鱼体质量较对照组提高了5.4%;在日粮中添加50 mg/kg的虾青素养殖独角虾、金鱼,可提高其增重率[10];用添加虾青素的饲料饲喂凡纳滨对虾Litopenaeus vannamei、日本沼虾 Macrobrachium nipponense,试验虾生长加快,促生长效果因剂量不 同 而 异[11];Christiansen[12]、 Torrissen 等[13]、Chien等[14]也得出了类似结论。
综合上述资料和本试验结果,笔者认为,类胡萝卜素促进水产动物生长很可能具有种类专一性。β-胡萝卜素、虾青素含量较高的虾类以及体色较为鲜艳的鱼类 (如金鱼和虹鳟等)对这两种色素的需要量较高,在饲料中适量添加后,促生长作用明显;反之,β-胡萝卜素、虾青素含量不高的虾类以及体色不鲜艳的鱼类,对其需要量就不高,添加后促生长作用不明显。
本试验中,仿刺参摄食添加90 mg/kg β-胡萝卜素和60 mg/kg虾青素的饲料时,生长速度较快,显著高于对照组,表明仿刺参更接近β-胡萝卜素、虾青素含量较高的虾类以及体色较为鲜艳的鱼类,饲料中需要添加这两种色素。
3.2 β-类胡萝卜素和虾青素对仿刺参抗氧化能力的影响
总抗氧化能力是指机体淬灭自由基和抗氧化能力的总和,是衡量机体抗氧化系统功能的综合性指标,包括酶促与非酶促两个体系,酶促体系包括SOD、CAT、谷胱甘肽过氧化物酶等,非酶促反应体系包括维生素、类胡萝卜素、氨基酸、金属蛋白等。因此,抗氧化系统中几种主要的抗氧化酶如SOD、CAT等常和总抗氧化能力一起作为评价机体抗氧化能力的指标。
饲料中添加抗氧化剂是预防机体抗氧化损伤的有效方法之一[15]。抗氧化剂一般通过调节机体的抗氧化系统增强其抗氧化能力。本试验中,摄食添加适量β-胡萝卜素 (90 mg/kg)和虾青素 (60 mg/kg)饲料的仿刺参体腔液中的总抗氧化能力均显著高于对照组,而SOD、CAT活力却显著低于对照组。脂鲤Hyphessobrycon caltistus摄食添加虾青素的饲料后血清中的总抗氧化能力升高[16],但SOD和GPx活力降低;Pan等[17]发现,斑节对虾Penaeus monodon摄食添加虾青素的饲料后血淋巴中T-AOC升高,SOD活力降低;中华绒螯蟹Eriocheir sinensis摄食添加适量β-胡萝卜素饲料后体内SOD活性降低[18]。这些都与本试验结果一致。其原因可能有两点:一是SOD能迅速、有效猝灭机体中的氧自由基,SOD被消耗;SOD与不同的金属离子如Cu、Zn和Mn等结合,形成不同类型的复合物,催化超氧自由基歧化反应,阻断脂质过氧化一级引发作用,分解机体产生的过氧化物,维持生物体内活性氧的动态平衡,SOD被大量消耗;CAT在将歧化作用产生的H2O2降解为H2O的过程中大量减少。所以,在添加了β-胡萝卜素和虾青素后抗氧化能力增强,SOD和CAT活力因消耗于增强免疫力而降低。二是添加β-胡萝卜素和虾青素后仿刺参总抗氧化能力增强,氧自由基等底物减少,也使SOD和CAT活力随之降低。但是,仿刺参体腔液中总抗氧化能力增高而SOD和CAT活力下降究竟为何种原因尚需深入研究。
3.3 β-胡萝卜素和虾青素对仿刺参生长及抗氧化能力影响的比较
类胡萝卜素作为着色剂、促长剂、抗氧化剂已被广泛应用于多种水产动物的养殖中。水产动物自身不能合成类胡萝卜素物质,只能从食物中摄取。影响类胡萝卜素在水产动物中作用的因素主要有3个方面:水产动物 (种类、规格和生理状况等)、饲料 (营养、投喂方式,尤其是维生素A和维生素E水平等)和环境 (水质等)。研究表明,类胡萝卜素在水产动物体内促生长和抗氧化能力由强至弱依次为:虾青素>α-胡萝卜素>β-胡萝卜素>红木素>玉米黄质>黄体素>胆红素>胆绿素。其中虾青素的抗氧化能力最佳,比β-胡萝卜素高10倍。
本试验中,相同添加量的各组平行比较表明,最低添加量 (30 mg/kg)的虾青素、β-胡萝卜素对仿刺参的促生长作用差异不显著,但虾青素在抗氧化方面的效果却显著高于β-胡萝卜素,最低添加量 (30 mg/kg)时,虾青素饲料组仿刺参体腔液的总抗氧化能力就显著高于所有β-胡萝卜素组。但当虾青素的添加量提高为60、90 mg/kg时,两个虾青素饲料组仿刺参体腔液的总抗氧化能力差异并不显著。这可能是因为虾青素的抗氧化性较强,仅需很少量便能显著提高养殖动物的总抗氧化能力,当添加量进一步提高后,虾青素的总抗氧化能力逐渐趋于稳定,而β-胡萝卜素的含量较高时才能满足水产动物抗氧化所需。
[1]Leggatt R A,Brauner C J,Iwama G K,et al.The glutathione antioxidant system is enhanced in growth hormone transgenic coho salmon(Oncorhynchus kisutch)[J].Comp Biochem and Physiol B,2007,177:413-422.
[2]姜志强,崔培,秦强,等.类胡萝卜素在锦鲤组织器官中的沉积与分布[J].大连海洋大学学报,2012,27(1):22-26.
[3]王吉桥,王志香,于红艳,等.饲料中不同类型的硒对仿刺参幼参生长和免疫指标的影响[J].大连海洋大学学报,2011,26(4):306-311.
[4]Chien Y H,Shiau W C.The effects of dietary supplementation of algae and synthetic astaxanthin on body astaxanthin,survival,growth and low dissolved oxygen stress resistance of kuruma prawn,Marsupenaeus japonicus Bate[J].J Exp Mar Biol Ecol,2005,318:201-211.
[5]Harpaz S,Rise M,Arad S,et al.The effect of three carotenoid sources on growth and pigmentation of juvenile freshwater crayfish Cherax quadricarinatus[J].Aquacult Nutri,1998(4):201-208.
[6]Rehulka J.Influence of astaxanthin on growth rate condition and some blood indices of rainbow trout Oncorhynchus mykiss[J].Aquaculture,2000,190(1):27-47.
[7]Bjerkenga B,Storebakken T,Liaaen-Jensen S.Pigmentation of rainbow trout from start feeding to sexual maturation[J].Aquaculture,1992,108(3-4):333-346.
[8]Page G l,Davies S J.Tissue astaxanthin and canthaxanthin distribution in rainbow trout(Oncorhynchus mykiss)and Atlantic salm-on(Salmo salar)[J].Comparative Biochemistry and Physiology Part A,2006,143(1):125-132.
[9]金征宇,过世东,吕玉华.饲料中添加富含虾青素的法夫酵母对罗氏沼虾的体色及生长状况的影响[J].饲料工业,1999,20:29-31.
[10]任维美.虾黄质的作用[J].饲料研究,1998(2):38-39.
[11]裴素蕊,管越强,马云婷.饲料中添加虾青素对凡纳滨对虾生长、存活和抗氧化能力的影响[J].水产科学,2009,28:126-129.
[12]Christiansen R,Lie O,Torrissen O J.Growth and survival of Atlantic salmon,Salmo salar L.,fed different dietary levels of astaxanthin[J].Aquaculture Nutrition,1995(1):189-198.
[13]Torrissen O J.Pigmentation of salmonids——Effects of carotenoids in eggs and start feeding diet on survival and growth rate[J].Aquaculture,1984,43:185-193.
[14]Chien Y H,Jeng S C.Pigmentation of kuruma prawn,Penaeus japonicus Bate,by various pigment sources and levels and feeding regimes[J].Aquaculture,1992,102:333-346.
[15]Chae C,Shin C,Kim H.The combination of a-lipoic acid supplementation and aerobic exercise inhibits lipid peroxidation in rat skeletal muscles[J].Nutrition Research,2008,28:399-405.
[16]Wang Y J,Chien Y H,Pan C H.Effects of dietary supplementation of carotenoids on survival,growth,pigmentation,and antioxidant capacity of characins,Hyphessobrycon callistus[J].Aquaculture,2006,261:641-648.
[17]Pan C H,Chien Y H,Hunter B.The resistance to ammonia stress of Penaeus monodon Fahricius juvenile fed diets supplemented with astaxanthin[J].J Exp Mar Biol Ecol,2003,297:107-118.
[18]元春营,崔青曼.β-胡萝卜素对中华绒螯蟹卵巢发育及免疫学指标的影响[J].海洋科学,2007,31(6):25-28.
