仿刺参肠多糖提取物对小鼠实体瘤的抑制作用
2012-06-06王斌袁甜张译文王志远秦英玲薛仙子常亚青
王斌,袁甜,张译文,王志远,秦英玲,薛仙子,常亚青
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.中南大学湘雅医学院,湖南长沙410013)
仿刺参Apostichopus japonicus是北方沿海主要养殖种类之一,具有很高的营养价值。目前发现的仿刺参多糖主要分为两类:一类是糖胺聚糖,即黏多糖[1];另一类是岩藻多糖,是由L-岩藻糖构成的直链多糖[2]。刺参多糖具有保护神经组织[3]、抑制细菌感染及降血脂等方面的作用[4]。有关刺参多糖抗肿瘤方面的研究也有一些报道,胡仁杰等[5]研究了刺参酸性黏多糖的抗肿瘤活性,结果表明,刺参酸性黏多糖能抑制小鼠S180肉瘤和乳腺癌细胞的DNA合成;Kafiya等[6]从刺参中分离得到的两种岩藻多聚糖硫酸酯能抑制破骨细胞的形成。本研究中,作者采用碱解、酶解和醇沉淀的方法提取仿刺参肠组织中的多糖类活性物质,研究其对小鼠实体肿瘤的抑制效果以及对机体相关免疫指标的影响,探讨了多糖类活性物质的作用机理,旨在深入了解仿刺参机体组织的生物活性成分以及该活性物质的保健和药用价值,为仿刺参药用产品的开发提供参考资料。
1 材料与方法
1.1 材料
1.1.1 试验动物及移植瘤株 试验用清洁级昆明种小鼠62只(雄性),体质量为(25±2)g,于2010年8月购自大连医科大学实验动物中心;小鼠H22肝癌瘤株由大连医科大学病理生理教研室惠赠;仿刺参肠组织购自大连棒棰岛海产有限公司。
1.1.2 主要试剂 小鼠白细胞介素2(IL-2)试剂盒包括96孔酶标板、酶标抗体工作液、10×标本稀释液、20×浓缩洗涤液和标准品 (底物工作液,第一抗体工作液,终止液);小鼠肿瘤坏死因子(TNF-α)试剂盒包括96孔酶标板、酶标抗体工作液、10×标本稀释液、20×浓缩洗涤液和标准品(底物工作液,终止液),两种试剂盒均购自上海西堂生物公司。
1.2 方法
1.2.1 仿刺参肠组织中粗多糖的提取 取一定量仿刺参的肠组织,挤出肠内容物,用生理盐水清洗3次,再用匀浆器匀浆;加入等倍0.46 mol/L的碳酸钾溶液碱解100 min;再加入等倍质量分数为0.37%的胰蛋白酶 (酶活性为4~6 U/mg)酶解220 min,以3500 r/min离心10 min;加入体积分数为55%的乙醇 (边加入边搅拌)醇沉淀,至沉淀完全析出,以3500 r/min离心10 min;收集沉淀,加入体积分数为55%的乙醇、丙酮分别混悬,静置后吸取上清液,置于烘箱 (37℃)中烘干,即得到仿刺参肠组织中的粗多糖 (简称为肠多糖)[1]。称取一定量的肠多糖干粉,用2倍体积的PBS缓冲液溶解成浓缩液,用滤器 (孔径为0.22 μm)除菌,置于4℃下保存备用。使用时将吸取的毫升数换算成含溶质的毫克数计算给药剂量。
1.2.2 肿瘤模型的建立及试验分组
1)腹水瘤模型的建立。取小鼠H22肝癌瘤株,调细胞浓度为107个/mL,用体积分数为75%的酒精消毒小鼠腹部皮肤,进行腹腔接种 (0.2 mL/只),共接种两只小鼠。待H22肝癌瘤株在小鼠体内复苏7~9 d并明显出现腹水后,在无菌条件下抽取小鼠腹水0.1 mL,然后用台盼蓝染色,计算1 mL瘤液中活体瘤细胞的数量,达到60%以上即可用于构建肿瘤模型。抽取达到要求的腹水,用生理盐水将瘤细胞稀释成2×107~6×107个/mL瘤细胞悬液,用体积分数为75%的酒精消毒小鼠体表,然后将瘤悬液接种于小鼠腹部皮下组织,接种量为0.2 mL/只[7],接种后的小鼠作为试验用瘤模小鼠。
2)试验分组。将小鼠随机分成6组,每组10只。第1~3组为瘤模小鼠,分别注射剂量为200、100、50 mg/(kg·d)的仿刺参肠多糖,记为肠多糖高、中和低剂量组。第4组为给药健康对照组,给健康小鼠腹腔注射肠多糖,剂量为200 mg/(kg·d)。第1~4组为肠多糖组,使用的肠多糖按照上述剂量配制成不同浓度的溶液,每只小鼠腹腔注射0.2 mL,在接种肿瘤细胞前5 d开始给药,连续给药15 d。第5组为肿瘤对照组,每天给瘤模小鼠腹腔注射灭菌生理盐水0.2 mL/只。第6组为健康对照组,每天给健康小鼠腹腔注射灭菌生理盐水0.2 mL/只。
从接种肿瘤细胞开始,试验共进行10 d,观察小鼠的生长状况。
1.2.3 各项指标的测定及数据处理 各组小鼠停药后,次日脱颈处死小鼠并称重,完整剥离瘤组织并拍照,用电子天平进行称重,并计算抑瘤率:

处死小鼠后完整剥离出胸腺和脾脏,用电子天平称量脾脏、胸腺的质量,计算胸腺指数、脾腺指数:
胸腺指数=胸腺质量/体质量,脾脏指数=脾脏质量/体质量。
在小鼠处死前摘除眼球,从眼底取血0.5 mL,在室温下静置20 min后,以3000 r/min离心30 min,收集上清液,置于冰箱 (-80℃)中冷冻保存,并空运至上海西堂生物公司测定血清中IL-2及TNF-α的含量。
1.3 数据处理
采用SPSS 17.0软件对试验数据进行处理和方差分析。
2 结果
2.1 外观状态及体征
小鼠接种瘤细胞2 d内,外观无明显变化,活动、饮食正常;接种3~4 d后,肿瘤对照组小鼠可触及到皮下绿豆大小的肿块,肠多糖剂量组部分小鼠可触及到皮下米粒大小肿块;接种6 d后,肿瘤对照组可触及到皮下黄豆大小肿块,肠多糖剂量组可触及到绿豆大小肿块,此时各组成瘤率约为80%。肠多糖高、中、低剂量组肿瘤生长较肿瘤对照组缓慢。肿瘤对照组小鼠从第4天开始饮食减少,皮毛无光泽,竖毛现象明显,活动明显减少,第6天和第8天各死亡1只,另外还有2只小鼠出现腹水,未形成实体瘤;肠多糖高、中、低剂量组小鼠饮食较正常,皮毛有光泽,竖毛现象不明显,肠多糖中、低剂量组均有一只小鼠出现腹水,未形成实体瘤。两个健康对照组小鼠生长均正常。
2.2 实体瘤的生长状况及小鼠的存活情况
至试验结束时,肿瘤对照组有2只小鼠在试验结束前4 d死亡,腹水明显,未发现皮下肿物;两个健康对照组小鼠均健康存活;肠多糖低、中剂量组各有一只小鼠腹水明显,未见皮下实体瘤,而肠多糖高剂量组小鼠全部存活,皮下肿瘤体积明显小于其它肿瘤组 (图1)。
从表1可见:肠多糖高剂量组小鼠的瘤质量与肿瘤对照组差异极显著(P<0.01),肠多糖中、低剂量组小鼠的瘤质量与肿瘤对照组差异显著(P<0.05);肠多糖高、中、低剂量组对患H22肝癌小鼠实体瘤的抑瘤率分别为90.1%、85.2%和71.7%。

图1 肠多糖对患H22肝癌小鼠肿瘤的抑制作用Fig.1 Antineoplastic effect of the intestinal polysaccharides on H22-bearing mice
表1 仿刺参肠多糖对患H22肝癌小鼠肿瘤生长的影响(±s)Tab.1 Inhibitory effects of the intestinal polysaccharides on growth of H22-bearing mice

表1 仿刺参肠多糖对患H22肝癌小鼠肿瘤生长的影响(±s)Tab.1 Inhibitory effects of the intestinal polysaccharides on growth of H22-bearing mice
注:*表示与肿瘤对照组差异显著 (P<0.05);**表示与肿瘤对照组差异极显著 (P<0.01),下同。Note:*means significant difference compared with the tumor control group(P<0.05);**means very significant difference compared with the tumor control group(P<0.01),et sequentia.
组别group 剂量dose/(mg·kg-1·d-1) 瘤质量tumor weight/g 抑瘤率inhibitory rate/%肿瘤对照组tumor contorl group 1.66±1.44肠多糖高剂量组 high-dose polysaccharide 200 0.165±0.07** 90.1肠多糖中剂量组middle-dose polysaccharide 100 0.245±0.05* 85.2肠多糖低剂量组low-dose polysaccharide 50 0.470±0.20* 71.7
2.3 肠多糖对H22肝癌实体瘤小鼠免疫指标的影响
2.3.1 脾脏指数和胸腺指数 从表2可见:各肠多糖组小鼠的脾脏指数与肿瘤对照组均无显著差异(P>0.05),但随着肠多糖剂量的上升脾脏指数也上升;各肠多糖组小鼠的胸腺指数均高于肿瘤对照组,除肠多糖低剂量组外其余各组均与肿瘤对照组差异显著 (P<0.05)。
表2 仿刺参肠多糖对患H22肝癌小鼠脾腺指数和胸腺指数的影响(±s)Tab.2 Effects of the intestinal polysaccharides on thymus index and spleen index of H22-bearing mice

表2 仿刺参肠多糖对患H22肝癌小鼠脾腺指数和胸腺指数的影响(±s)Tab.2 Effects of the intestinal polysaccharides on thymus index and spleen index of H22-bearing mice
组别group 剂量dose/(mg·kg-1·d-1) 脾脏指数spleen index 胸腺指数thymus index肿瘤对照组tumor contorl group 5.00±1.69 2.05±0.86给药健康对照组polysaccharide control group 200 6.20±1.03 3.00±0.59*肠多糖高剂量组 high-dose polysaccharide 200 5.88±1.76 2.70±0.39*肠多糖中剂量组 middle-dose polysaccharide 100 5.27±1.18 2.58±0.79*肠多糖低剂量组 low-dose polysaccharide 50 4.75±0.89 2.07±0.62
2.3.2 白细胞介素2(IL-2)和肿瘤坏死因子(TNF-α) 从表3可见:肠多糖高剂量组小鼠血清中的IL-2含量最高 (92.521 pg/mL),与3个对照组及其它两个肠多糖剂量组均有极显著差异(P<0.01),而肠多糖中、低剂量组与健康对照组差异极显著 (P<0.01),与肿瘤对照组、给药健康对照组均无显著差异 (P>0.05);肠多糖高剂量组小鼠血清中的TNF-α含量低于肠多糖中、低剂量组,健康对照组的TNF-α含量最低,其次为给药健康对照组,肠多糖高、中、低剂量组与3个对照组均无显著差异 (P>0.05)。
表3 仿刺参肠多糖对患H22肝癌小鼠血清中白细胞介素2和肿瘤坏死因子含量的影响(±s)Tab.3 Effects of the intestinal polysaccharide on IL-2 and TNF-α in H22-bearing mice
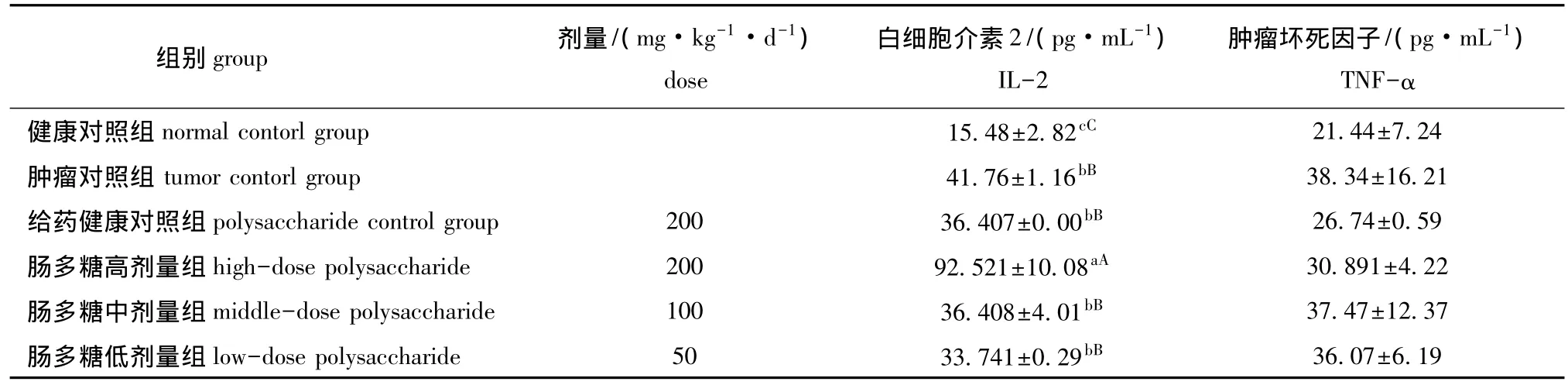
表3 仿刺参肠多糖对患H22肝癌小鼠血清中白细胞介素2和肿瘤坏死因子含量的影响(±s)Tab.3 Effects of the intestinal polysaccharide on IL-2 and TNF-α in H22-bearing mice
注:同列中标有不同大写字母者表示组间差异极显著 (P<0.01),标有不同小写字母者表示组间差异显著 (P<0.05),标有相同小写字母者表示组间差异不显著 (P>0.05)。Note:The means with different capital letters within the same column are very significantly different at the 0.01 probability level,with different letters being significantly different at the 0.05 probability level,and the means with the same letters within the same column are not significant differences.
组别 group 剂量/(mg·kg-1·d-1)dose白细胞介素2/(pg·mL-1)IL-2肿瘤坏死因子/(pg·mL-1)TNF-α健康对照组normal contorl group 15.48±2.82cC 21.44±7.24肿瘤对照组tumor contorl group 41.76±1.16bB 38.34±16.21给药健康对照组polysaccharide control group 200 36.407±0.00bB 26.74±0.59肠多糖高剂量组 high-dose polysaccharide 200 92.521±10.08aA 30.891±4.22肠多糖中剂量组 middle-dose polysaccharide 100 36.408±4.01bB 37.47±12.37肠多糖低剂量组 low-dose polysaccharide 50 33.741±0.29bB 36.07±6.19
3 讨论
本研究结果表明,仿刺参肠多糖对H22小鼠实体瘤具有明显的抑制效果,抑瘤率最高达到90.1%,抑瘤率与给药剂量呈正相关。周湘盈等[8]的研究结果表明,海参的整体冻干粉对荷瘤小鼠的抑瘤率为34.8%;苏秀榕等[2]报道,仿刺参多糖对肝癌腹水型肿瘤细胞Hca-f的纯系BALB-C小鼠的抑瘤率为73.56%;胡仁杰等[5]报道,从仿刺参体壁中提取的酸性黏多糖对S180荷瘤小鼠的抑瘤率为55%。而本研究中使用的仿刺参肠多糖对H22小鼠实体瘤的抑瘤率远高于上述研究结果。关于仿刺参组织活性物质对肿瘤抑制作用的研究均是以刺参体壁组织为试验材料[2-7],而且日常生活中人们所食用的也是仿刺参的体壁,因此对仿刺参肠组织中多糖的研究报道极少。本研究中,作者首次将从仿刺参肠组织中提取的粗多糖作用于H22肝癌实体瘤模型小鼠,测定其对肿瘤的抑制率,结果表明,仿刺参肠组织中的粗多糖对肿瘤的抑制效果明显高于体壁组织。该研究结果可为刺参组织的综合利用提供新的思路,有关仿刺参肠多糖的主要成分将是今后研究的重点。
目前普遍认为,多糖的抗瘤机制主要是通过增强机体的免疫功能,提高机体对肿瘤的防御机制,从而达到杀伤肿瘤细胞的目的[9-11]。多糖进入机体后可上调多种免疫指标,如免疫器官的脏器指数及各种细胞因子等。为了探索仿刺参肠多糖对肿瘤的抑制机理,本研究中测定了用肠多糖治疗H22肝癌实体瘤模型小鼠后的脾脏指数和胸腺指数,结果显示,注射肠多糖的3组小鼠,随着肠多糖剂量的增加其脾脏、胸腺指数均有所增加,但仅肠多糖高、中剂量组小鼠的胸腺指数与肿瘤对照组相比差异显著 (P<0.05)。该结果与王静凤等[12]报道的日本刺参对荷瘤小鼠胸腺指数的影响相同。给小鼠注射仿刺参肠多糖后,其胸腺指数的变化提示机体抗肿瘤细胞免疫上调,同时脾脏指数也有上升趋势。因此,可以认为,仿刺参肠多糖对提高机体抗肿瘤免疫起到了积极作用。
IL-2是一种主要由辅助性T淋巴细胞分泌的淋巴因子,它能激活小鼠的自然杀伤细胞使之成为淋巴因子激活的杀伤细胞 (LAK),LAK具有广谱的杀伤肿瘤活性。IL-2还可激活多种免疫细胞,促进多种细胞因子的产生,在免疫调节中具有极为重要的作用[13]。据报道,从日本瓜参 Cucumaria japonica中提取出来的海参皂甙 (cumaside)能激活淋巴细胞的吞噬活性以及产生IL-6和TNF-α,从而显著提高机体的免疫功能[14];海参多糖能明显促进脾淋巴细胞分泌IL-2,显著地增强小鼠的免疫功能[15];海胆黄多糖能提高小鼠自然杀伤细胞的活力,刺激其分泌IL-1和IL-2,并增强自然杀伤细胞自身的活性,辅助细胞毒性T淋巴细胞发挥细胞毒效应[16]。本研究结果与上述结果相似,即小鼠血清中的IL-2含量随肠多糖剂量的增加而升高,且肠多糖高剂量组小鼠血清中IL-2的含量高达92.521 pg/mL,与肿瘤对照组、给药健康对照组和健康对照组均有极显著差异 (P<0.01)。IL-2是小鼠体内主要抗肿瘤的相关细胞因子,IL-2含量的升高进一步证实了仿刺参肠组织中多糖活性物质的抗肿瘤活性与提高细胞免疫水平密切相关。肠多糖高、中、低剂量组小鼠血清中TNF-α的含量均低于肿瘤对照组,但随着肠多糖剂量的升高,小鼠血清中的TNF-α含量出现先升高后下降的趋势,具体原因暂不十分清楚。鉴于细胞因子的产生受多种因素干扰,因此不能简单的对其进行分析,尚需进一步试验并对其它相关因素检测后,再进行综合分析。由于测定的免疫指标不够全面,不能详尽的讨论仿刺参肠多糖对H22肝癌实体瘤模型小鼠的抑瘤机制。但可以确定,仿刺参肠多糖具有显著的抗肿瘤活性,是今后开发抗肿瘤保健品和药物的良好材料。
[1]段军,云霞,朱蓓薇,等.海刺参粘多糖提取分离的最佳工艺条件[J].大连轻工学院学报,2003,22(2):107-109.
[2]苏秀榕,娄永江,常亚青,等.海参的营养成分及海参多糖的抗肿瘤活性的研究[J].营养学报,2003,25(2):181-182.
[3]Kaneko M,Kisa F,Yamada K,et al.Structure of neuritogenic active ganglioside from the sea cucumber Stichopus japonicus[J].Eur J Org Chem,1999(11):3171-3174 .
[4]Liu H H,Ko W C,Hu M L.Hypolipidemic effect of glycosaminoglycans from the cucumber Metriatyla scabra in rats fed a cholesterol-supple menteddiet[J].J Agric Food Chem,2002,50(12):3602-3606.
[5]胡仁杰,于苏萍,蒋卉,等.仿刺参粘多糖及考的松对小鼠移植瘤 S180 的作用[J].中国肿瘤临床,1992,19(1):72-75.
[6]Kafiya Y,Mulley B,Imai K,et al.Isolation and partial characterization of fucan sulfates from the body wall of sea cucumber Stichopus japonicus and their ability to inhibit osteoclastogenesis[J].Carbohydrate Research,2004,339:1339-1346.
[7]王振立,刘桂敏.仿刺参粘性多糖抑制小鼠肿瘤细胞DNA合成及其代谢研究[J].中国医药工业杂志,1993,24(9):405-408.
[8]周湘盈,徐贵发.东海刺海参冻干粉对荷瘤小鼠的抑制作用及其免疫指标的影响[J].卫生研究,2008,37(1):30-32.
[9]龚非力.医学免疫学[M].北京:科学出版社,2004:71-77.
[10]宁安红,孙晓东,曹婧,等.灵芝多糖抗肿瘤作用的初步探讨[J].中国微生态学杂志,2003,15(6):335-336.
[11]朱彩平,张声华.枸杞多糖对H22肝癌小鼠的抑癌作用[J].中国公共卫生,2006,12(6):717-718.
[12]王静凤,王奕,赵林,等.日本刺参的抗肿瘤及免疫调节作用研究[J].中国海洋大学学报,2007,37(1):93-96.
[13]李君璎,黄惟让.免疫生物学概论[M].北京:高等教育出版社,1992.
[14]Aminin D L,Pinegin B V,Pichugina L V,et al.Immunomodulaltory properties of cumaside[J].International ImmuneI Pharmacol,2006,6(7):1070-1082.
[15]黄益丽,郑忠辉,苏文金,等.二色桌片参的化学成分研究:Ⅲ.二色桌片参多糖-1──岩藻聚糖的免疫调节作用[J].海洋通报,2001,20(1):88-91.
[16]Liu C,Xi T,Lin Q,et al.Immunoreactions activity of polysaccharides isolated from Strongylocentrotus nudus eggs[J].Int lmmunopharmacol,2008,8(13-14):1835-1841.
