粗砂-砾石海滩溢油污染的现场生物修复
2012-06-05梁生康李广茹郭利果杨仕美
梁生康,周 平,李广茹,陈 宇,郭利果,杨仕美,吴 亮
(1. 中国海洋大学化学化工学院,青岛 266100;2. 中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛 266100;3. 中海石油环保服务有限公司,天津 300452)
粗砂-砾石海滩溢油污染的现场生物修复
梁生康1,2,周 平1,2,李广茹3,陈 宇3,郭利果1,2,杨仕美1,2,吴 亮1,2
(1. 中国海洋大学化学化工学院,青岛 266100;2. 中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛 266100;3. 中海石油环保服务有限公司,天津 300452)
在天津港六号码头的粗砂-砾石海滩进行了人工模拟溢油条件下的生物修复现场实验,考察了添加水溶性肥料、添加缓释肥料以及同时添加缓释肥料和石油烃降解菌等修复措施的有效性.结果表明,在 120,d的修复时间内,同时添加缓释肥料和石油烃降解菌的体系石油烃生物降解常数(ks)最高,达0.007,2,d-1,为对照体系的 2.4倍,该体系中氮、磷浓度和石油烃降解菌数量在较长时间内都维持较高水平,表明接种的石油烃降解菌能够直接利用缓释肥料所释放出来的营养元素而快速生长繁殖;添加水溶性肥料的体系短期内氮、磷含量显著提高,石油烃降解菌密度明显增大,石油烃降解速率加快,ks为对照试验池的 1.8倍;而添加缓释肥料的体系氮、磷含量尽管明显高于对照体系,ks却略低于对照体系,这可能是由于土著微生物无法直接利用缓释肥料所释放的营养元素,甚至其释放的尿素在局部形成高氨氮环境而抑制微生物的生长.
溢油;海滩;生物修复;水溶性肥料;缓释肥料;石油烃降解菌
石油工业在国民经济中占有十分重要的地位,是国家综合国力的重要组成部分,然而随着石油工业的飞速发展,海上溢油事故时有发生,而且受石油污染的面积不断加大,污染程度也日趋严重.大量的石油污染物进入环境,不仅破坏生态平衡,制约了经济的发展,而且影响到人类健康和生存[1].
生物修复技术具有二次污染少、费用低廉等优点,已成为现场去除溢油污染的重要选择途径.但由于现场生物修复过程中的影响因素很多,包括海岸线对波浪及潮汐能的暴露或掩蔽程度、海岸线的坡度、溢油品种及数量、污染场地的微生物活性、温度、pH值及营养盐含量等[2].为了确保在污染场地有效地使用生物修复技术,必须在整个处理过程中的各个阶段通过小试和现场中试对工程的可行性进行研究,包括对处理场所石油污染物的浓度与分布、微生物的活动、介质环境行为及地质特征的分析,来选择生物修复方案.
本研究在天津市塘沽区天津港六号码头的潮间带进行,通过模拟溢油污染粗砂-砾石海滩,探讨了生物强化即接种石油烃降解菌和生物刺激即添加营养盐或两种措施同时使用在生物修复溢油污染现场中的作用效果,以期为以后大规模的现场溢油处理提供基础.
1 材料和方法
1.1 溢油污染海岸线模拟
现场修复试验在天津市塘沽区天津港六号码头的潮间带进行,主要为粗砂-砾石基质,划分为并排的4个试验池(5,m×3,m×1,m,长×宽×高).溢油污染海岸线的模拟方法参考文献[3],所用 BXPT原油为中国海洋石油总公司天津分公司从渤海开采的主要油品之一,其 20,℃时密度为 0.921,7,g/cm3,50,℃时的动力黏度为 21.08,mm2/s,硫、蜡、树脂和沥青的质量分数分别为0.15%、15.44%、13.21%和1.68%,为典型低黏度高腊中质原油.油污染基质用海水连续冲刷15,d后,进行生物修复试验.
1.2 溢油污染海岸线生物修复试验设计
人工溢油后的各试验池的处理如表1所示.其中,1号试验池添加 BXPT原油、缓释肥料及混合石油烃降解菌,以考察两者联合使用对原油的强化降解作用;2号试验池中添加BXPT原油及水溶性氮磷肥料,以考察水溶性肥料对原油降解的刺激作用;3号试验池中添加 BXPT原油及缓释肥料,以考察缓释肥料对原油降解的刺激作用;4号试验池只添加BXPT原油,作为对照组考察物理挥发、光化学降解以及土著微生物对石油烃的去除作用.添加的肥料质量根据试验池中原油浓度和基质中营养盐的背景浓度,一般满足C、N和P质量比为100∶10∶1;菌剂添加量根据实验处理前石油烃降解菌总量,使添加后试验池中石油烃降解菌密度提高 2个数量级左右.试验中添加的水溶性肥料为 200,g,NH4NO3和20,g,KH2PO4;所添加的缓释肥料为本实验室自主开发的硫包衣缓释肥,核心肥料为尿素和 KH2PO4,包衣层为硫磺,以石腊密封而成.该肥料氮和磷的质量分数分别为33.2%和4.6%.所添加的石油烃降解菌筛选于天津港六号码头沉积物中,初步鉴定和分析结果表明,该混合菌中的优势菌有6种,其中4株属于芽孢杆菌属(Bacillus sp.),另外2株分别属于不动杆菌属(Acinetobacter sp.)和海杆菌属(Oceanobacillus sp.),将处于对数生长期的菌液用硅藻土固定化后作为降解试验的接种物[4].
1.3 样品采集和监测频率
每一试验池分上、下 2个采样点,采集土表下5~10,cm深处的土壤样品,混合均匀,一部分立即测定石油烃降解菌总数,一部分用于测定间隙水中的总氮和总磷,一部分用于测定石油烃总量和组分.除了石油烃组分每月测定一次之外,石油烃降解菌总数、总氮、总磷及石油烃含量每周测定一次.
1.4 样品测定方法
1.4.1 样品间隙水中总氮和总磷的测定
将从各试验池所取样品混合均匀后,称取 300~500,g样品8,000,r/min进行离心分离15,min后,移取上清液,0.45,μm混合纤维滤膜过滤,稀释 100倍后加入碱性过硫酸钾,121,℃高压锅中硝化 30,min后,分别采用镉柱还原法和磷钼蓝法测定总氮和总磷[5].
1.4.2 石油烃降解菌密度的测定
采用改进的多管发酵法测定[6]:准确称取经高温灭菌的原油 5.00,g,用正己烷定容至 50,mL,得到0.1,g/mL的原油储备液.移取 20,µL原油储备液到96微孔板,待正己烷挥发完全后,再移取 B-H培养基180,µL到96微孔板中;然后移取稀释到相应倍数的菌悬液 20,µL到相应的 96微孔板中,置于恒温培养箱中 25,℃下培养.微孔板培养 2周,加入 50,µL的 INT(3,g/L)溶液,24,h后观察培养液颜色的变化,呈紫红色的孔板计为阳性.根据每个梯度显色的管数,计算对应的菌数.
1.4.3 石油烃含量与组分的测定
参照文献[3]方法,主要包括索氏提取、旋转蒸发、柱层析分离和 GC-MS测定等.仪器为美国安捷伦公司的 6,890,N/5,975,B的气质联用仪,仪器使用条件参照文献[7] .
1.5 石油烃组分生物降解常数的计算
鉴于原油在溢漏现场的蒸发、扩散、光氧化、乳化等过程都会影响其组分和含量,使同一污染源的污染场地存在非均一性与明显的差异性,无法应用重量法来确定石油烃的生物降解.因此,这里采用藿烷作为生物标志物来评价溢油污染现场石油烃的生物降解效果[8].这主要是由于藿烷在生物修复的整个过程中不被生物降解,且藿烷与原油中的其他组分受化学和物理风化作用的影响基本是一样的.这样就能用藿烷损失替代物理和化学损失,因此,原油生物降解速率sk A- 、藿烷损失速率和总损失速率之间存在的关系为
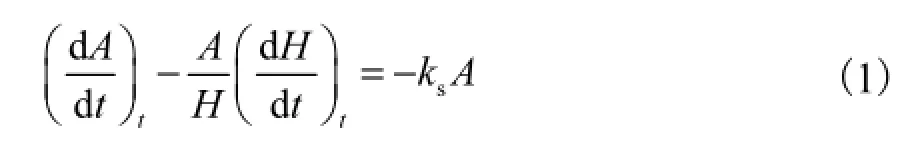
式(1)可以转换成

由式(2)变换得到一级反应方程

2 结 果
2.1 石油烃组分在生物修复过程中的生物降解率
对于检出的碳数为 14~34的正构烷烃组分,其一级降解常数sk随着碳链的增长逐渐减小(见图1).其中,C30以上的正构烷烃sk在 0.000,1~0.003,2,d-1之间,植烷和姥鲛烷的sk在 0.000,8~0.006,1,d-1之间,C20~C29的正构烷烃sk在 0.000,2~0.006,4,d-1之间,C14~C19的正构烷烃sk在 0.004,7~0.020,2,d-1之间.这主要是因为烷烃碳链的增长使其疏水性增大,生物可利用性降低[10].
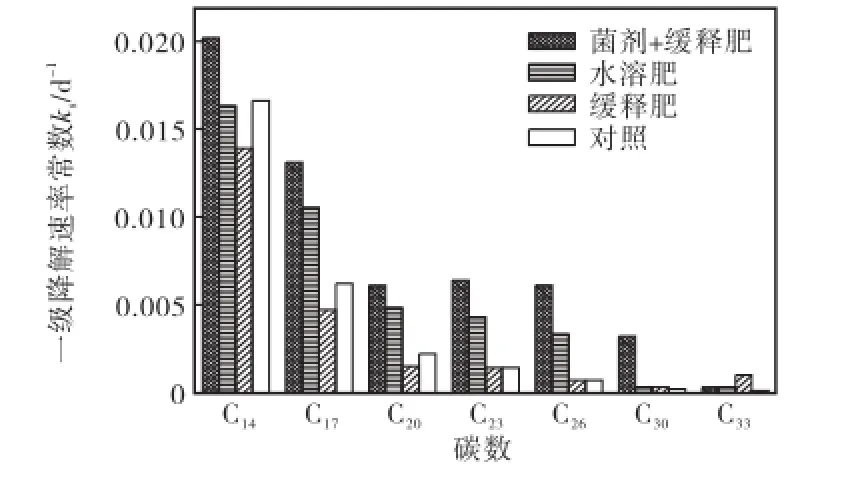
图1 各修复体系中烷烃组分的一级降解速率常数Fig.1 First-order biodegradation rate constants of alkanes in different experiment plots
进一步比较不同试验池中烷烃组分的平均降解速率常数 ks(见表 2),同时添加缓释肥料和接种石油烃降解菌处理体系的 ks最高,达 0.007,2,d-1,约为对照试验池的2.4倍;其次为添加水溶性肥料的处理体系,ks约为对照试验池的 1.8倍;而单独添加缓释肥料处理体系的ks最低,仅为对照的0.8倍左右.
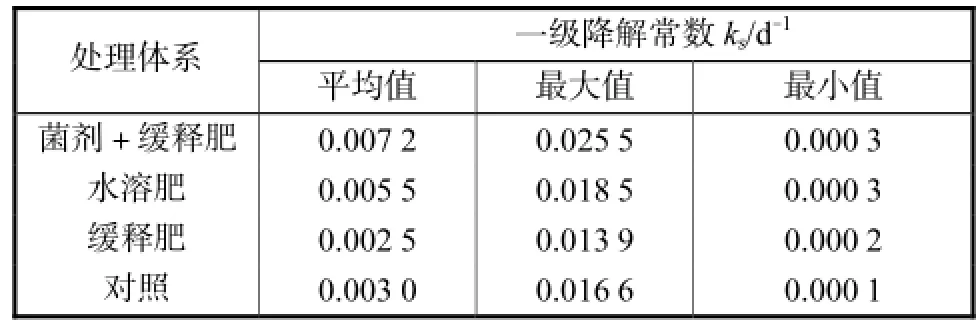
表2 各试验池中不同烷烃组分的一级降解常数Tab.2 Comparison of first-order biodegradation rate constants of alkanes in each experimental pool
2.2 石油烃降解菌总数在生物修复过程中的变化
生物修复过程中,石油烃降解菌是石油烃生物降解的执行者,其数量的高低直接反映生物修复的过程中各种理化因素是否适宜石油烃降解菌的生长和繁殖.图 2表示各试验池中石油烃降解菌细胞密度(ρcell)在生物修复过程中的动态变化曲线.由图 2可知,在实验初期时,即基质喷洒原油前,各试验池的石油烃降解菌细胞密度都较低,基本维持在 2.3×105~4.6×106g-1之间,喷洒原油后的7,d内,各试验池中菌细胞密度都快速增大,相对于溢油前提高了1~2个数量级.对于只喷洒原油的对照处理体系,菌细胞密度在实验开始阶段快速升高,21,d时菌细胞密度达到最高值 2.4×107g-1,然后开始迅速下降,28,d时菌细胞密度达最低值 2.0×104g-1,然后基本保持不变或略有增大;对于添加水溶性肥料的处理体系,菌细胞密度在添加肥料当天即达最高值2.3×107g-1,保持 7,d后开始逐步下降,28,d时降至最低的 2.0× 104,g-1,然后基本维持在 1.0×104~3.0×105,g-1;对于添加缓释肥料的处理体系,菌细胞密度在添加肥料当天即达最高值2.3×107g-1,保持7,d后开始逐步下降,28,d时降至最低的9.0×103g-1,然后呈现锯齿状波动,但基本维持在1.0×104~2.0×106g-1之间;对于同时添加缓释肥料和石油烃降解菌剂的处理体系,菌细胞密度由开始时的2.3×105g-1升高至7,d时的2.4×107g-1,然后基本保持不变,在 28,d时开始减小,42,d时降至最低的2.0×104g-1,然后基本维持在1.0×104~2.0×106g-1.
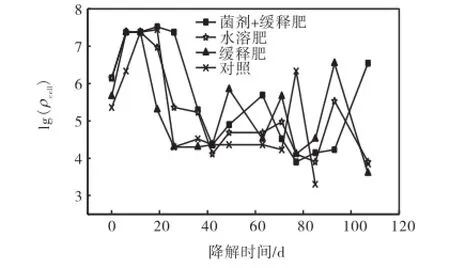
图2 石油烃降解菌细胞密度随修复时间的变化Fig.2 Variations of the oil-degradating bacteria cell density with bioremediation period
整个生物修复过程中石油烃降解菌总数的平均值见表 3,可以看出,同时添加菌剂和缓释肥料的体系菌细胞密度的平均值最高,达 7.9×106g-1,而对照体系和添加水溶性肥料的体系中菌细胞密度的平均值相当,添加缓释肥料的体系则最低,仅为3.8×106g-1.
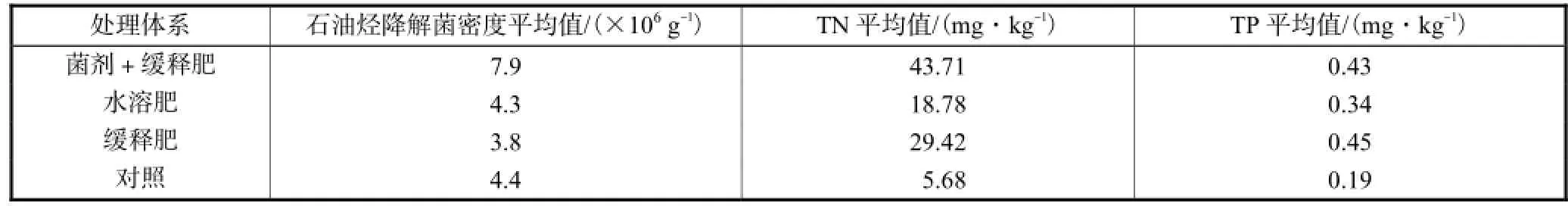
表3 修复过程中各处理体系石油烃降解菌密度和间隙水总氮、总磷平均值Tab.3 Average concentrations of oil-degradating bacteria cell density,TN and TP in the porewater during the whole bioremediation period
2.3 生物修复过程中基质间隙水中氮磷含量的变化
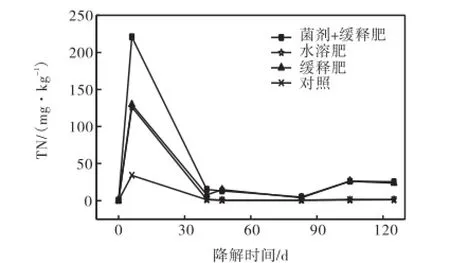
图3 基质间隙水中总氮含量随降解时间的变化Fig.3 Variations of concentration of total dissolved nitrogen in substrate porewater with degradation time
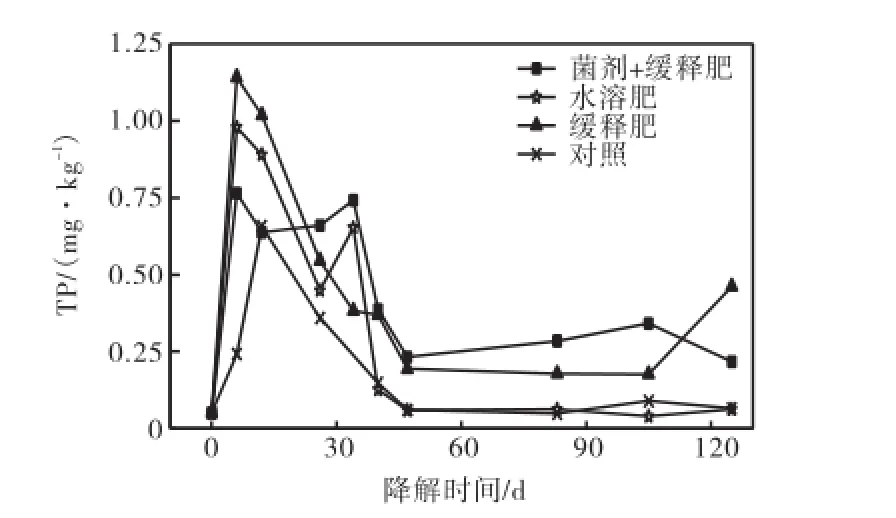
图4 基质间隙水中总磷含量随降解时间的变化Fig.4 Variations of concentration of total dissolved phosphorus in substrate porewater with degradation time
图 3和图 4分别给出了生物修复过程中基质中间隙水的总氮与总磷含量的动态变化曲线.由图可知,未做任何处理的对照体系,总氮与总磷的含量较低,分别保持在0.5~30.0,mg/kg和0.05~0.70,mg/kg的范围内.而添加缓释肥料的体系、添加水溶性肥料的体系和同时添加菌剂与缓释肥料的体系,在处理的当天,其基质中间隙水的总氮与总磷含量都显著增加,总氮的含量分别达到129.5、126.3和 220.9,mg/kg,总磷的含量分别达 1.14、0.98和 0.77,mg/kg,然后各处理体系间隙水中总氮含量随修复时间的增长而逐渐下降,总磷含量逐渐下降或呈锯齿状波动.需要指出的是,由于基质填充的不均匀以及样品采集时深度控制不当,样品基质氧化还原环境有所不同,因而导致总磷含量出现波动[11].但整体而言,相比较添加水溶性肥料的体系,添加缓释肥料体系的总氮总磷含量能够在比较长时间内维持在较高水平.
表 3给出整个生物修复过程中各试验池中间隙水的总氮与总磷含量的平均值,由表 3可知,添加缓释肥料、水溶性肥料及同时添加菌剂与缓释肥料的体系中间隙水的总氮含量分别比对照体系高4.2倍、2.3倍和 6.7倍;总磷含量分别高 1.4倍、0.8倍和 1.3倍.表明水溶性肥料在海水的冲刷过程中会很快流失,而缓释肥料能在较长时间内保持基质间隙水中营养盐维持在较高水平.
3 讨 论
3.1 营养盐对溢油污染生物修复的强化作用
微生物代谢需要氮、磷等营养物质的参与才能顺利进行.溢油发生后,碳源供给充足,氮源和磷源常常是烃类生物降解的限制因素,添加适量营养物可以促进生物降解[12],间隙水中营养盐的浓度应维持在既满足微生物生长最大需求但又不会对其产生毒害作用的水平.本研究结果表明,在整个修复期间,同时添加缓释肥料和石油烃降解菌的处理体系保持了较高的营养盐水平,40,d后总氮和总磷浓度保持在15.2,mg/kg和 0.4,mg/kg左右,分别为对照试验池的15倍和 3倍;而生物修复期间石油烃降解菌密度的动态变化(见图 2)也表明营养盐的添加大大提高了石油烃降解菌的数量,石油烃一级降解常数明显高于未添加营养盐的对照体系.这表明基质中低营养盐含量是限制微生物降解的主要因素,添加营养盐可以显著提高生物修复效率[13].
进一步分析表明,添加缓释肥料和添加水溶性肥料效果不同,添加水溶性肥料可以暂时提高间隙水中营养盐水平,促进土著石油烃降解菌的生长,从而提高污染物去除速率;只添加缓释肥料的体系虽然能在相当长的时间内逐步释放养分,但是添加缓释肥料的体系石油烃降解率不仅低于添加水溶性肥料的体系,甚至低于不添加营养盐的对照体系,这可能是由于缓释肥料虽然能维持间隙水中营养盐较高水平,但土著微生物可能无法直接利用其中的营养元素,甚至其释放的尿素在局部形成高氨氮环境,可能抑制微生物的生长,因此石油烃降解菌数量和石油烃降解率都较低,但这一结论需要进一步验证.上述分析结果表明,溢油污染现场营养盐类型及浓度的确定依赖于油品性质及环境条件.这与国内外其他学者的研究结果基本一致.Wrenn等[14]研究了不同形态氮对轻质阿拉伯原油的生物降解作用的影响,结果发现在缓冲能力较差的海水体系中,硝态氮要优于氨态氮,可能是由于微生物在吸收氨氮的过程中产生的酸性代谢物可能会抑制原油生物降解过程.然而Jackson等[15]分析发现,对于盐沼地土壤环境,氨氮的添加效果要优于硝态氮,达到同样生物修复效果所需氨氮的量仅为硝态氮的 20%.这可能是由于氨氮与有机质的强吸附性使得其不容易从环境中冲刷损失掉.
3.2 接种石油烃降解菌对石油烃污染物的强化作用
作为提高污染场地生物修复效率的主要手段之一,生物强化技术即在污染场地接种高效污染物降解菌已经在溢油污染海岸线的生物修复过程中获得了广泛的应用.但现有的室内和现场实验结果对生物强化措施的有效性一直存在争议.一些研究者认为添加石油污染场地的微生物可以明显提高石油烃的降解效率[16],而另外一些实验结果却表明,添加外源菌剂并不能提高污染物的生物降解效率,因为溢油污染现场已经存在着大量的石油烃降解菌,并且添加进去的外源菌剂很难与土著菌共同作用,也竞争不过土著菌[17].
从本实验修复期间石油烃降解菌随降解时间的变化可以看出,溢油前土著石油烃降解菌数量均较低,溢油后的 7~14,d内,各试验池中菌细胞密度都快速增大,相对于溢油前提高了 1~2个数量级,这表明溢油现场石油烃降解菌数量丰富,可能不是限制生物修复的主要因素[18].
对比只添加缓释肥料的体系和同时添加缓释肥料和石油烃降解菌剂的体系,可以看出,尽管在修复期间,体系间隙水中营养盐都维持在较高水平,但只添加缓释肥料的体系的石油烃降解率并未提高反而有所抑制,而同时添加缓释肥料和石油烃降解菌的体系石油烃降解率显著提高,这可能是由于所选育的石油烃降解菌由高油浓度和高营养盐的培养基中多次富集培养获得,能够耐受高浓度的氨氮,接种到修复场地后能够利用缓释肥料所释放的尿素或分解后形成的氨氮而快速生长繁殖,并在与土著菌的竞争中形成优势,但这一结论需要分子生物学技术(如 PCRDGGE)在确定微生物群落结构的基础上进一步验证.这表明,在现场条件下,缓释肥料和石油烃降解菌剂联合使用,是提高生物修复效率的最有效手段.实际上,Rosenberg等[16]的研究也获得相似的结果,他们为了避免外源菌竞争不过土著菌,把一种尿素与能利用这种尿素的石油烃降解菌混合,制备成同时含有菌剂和氮源的修复剂,结果证明在此条件下外源菌剂由于能够选择性利用这种肥料而比土著菌更具有竞争力,从而提高了生物修复的效率.
4 结 论
生物强化和生物刺激在粗砂-砾石海滩的现场生物修复过程中的作用效果不同.
(1) 尽管溢油场地低营养盐含量是生物修复现场影响污染物降解的主要因子,但是水溶性肥料的添加可以刺激土著石油烃降解菌的生长,从而提高石油烃的降解率;但缓释肥料的作用却与之相反,这表明利用生物刺激手段加快污染物降解时,营养盐类型及浓度的确定至关重要,在适宜的修复场地要选用适宜的营养盐.
(2) 同时添加缓释肥料和石油烃降解菌的修复体系中石油烃污染物降解率最高,生物修复效果最好;但在缓释肥料刺激作用下,外加的石油烃降解菌和土著的石油烃降解菌之间为竞争生长还是协同生长及其作用机制尚不明确,还需要通过分子生物学的方法来进一步研究.
[1] Head I M,Swannell R P J. Bioremidiation of petroleum hydrocarbon contaminants in marine habitats[J]. Current Opinion in Biotechnology,1999,10(3):234-239.
[2] 杨仕美,张翼霄,高光军,等. 不同碳源富集的石油烃降解菌群结构的分析[J]. 海洋科学,2009,33(8):87-92.
Yang Shimei,Zhang Yixiao,Gao Guangjun,et al. Analysis of hydrocarbon-degrading bacterium community structures in enrichment cultures with different carbon sources[J]. Ocean Science,2009,33(8):87-92(in Chinese).
[3] 何云馨,石晓勇,杨仕美,等. 溢油污染海岸线生物修复措施现场应用效果评价[J]. 环境科学与技术,2011,34(3):41-49.
He Yunxin,Shi Xiaoyong,Yang Shimei,et al. Evaluation on in-situ bioremediation of a shoreline polluted by oil spill[J]. Environmental Science and Technology,2011,34(3):41-49(in Chinese).
[4] 王 琳,罗启芳. 硅藻土吸附固定化微生物对邻苯二甲酸二丁酯的降解特性研究[J]. 卫生研究,2006,25(1):23-25.
Wang Lin,Luo Qifang. Biodegradation of dibutyl phthalate by diatomite adsorptive immobilized microorganism[J]. Journal of Hygiene Research,2006,25(1):23-25(in Chinese).
[5] 祝陈坚. 海水分析化学实验[M]. 青岛:中国海洋大学出版社,2006. Zhu Chenjian. Seawater Analytical Chemistry Experiment[M]. Qingdao:Ocean University of China Press,2006(in Chinese).
[6] Brian A W,Albert D V. Selective enumeration of aromatic and aliphatic hydrocarbon degrading bacteria by a most-probable number procedure[J]. Canadian Journal Microbiology,1996,42(3):252-268.
[7] Wang Z,Fingas M,Blenkinsopp S,et al. Comparison of oil composition changes due to biodegradation and physical weathering in different oils[J]. Journal of Chromatography A,1998,809(1):89-107.
[8] Prince R C,Elmendorf D L,Lute J R,et al. 17α (H),21β(H)-Hopane as a conserved internal marker for estimating the biodegradation of crude oil[J]. Environmental Science and Technology,1994,28(1):142-145.
[9] Venosa A D,Suidan M T,Wrenn B A,et al. Bioremediation of an experimental oil spill on the shoreline of Delaware Bay[J]. Environmental Science and Technology,1996,30(5):1764-1775.
[10] Leahy J G,Colwell R R. Microbial degradation of hydrocarbon in the environment[J]. Microbiological Reviews,1990,54(3):305-315.
[11] Marz C,Poulton S W,Beckmann B,et al. Redox sensitivity of P cycling during marine black shale[J]. Geochimica et Cosmochimica Acta,2008,72(15):3703-3717.
[12] Swannell R P J,Lee K,Mcdonagh M. Field evaluations of marine oil spill bioremediation[J]. Microbiological Reviews,1996,60(2):342-365.
[13] Lee K,Mora S D. In situ biodegradation strategies for oiled shoreline environments[J]. Environmental Technology,1999,20(8):783-794.
[14] Wrenn B A,Haines J R,Venosa A D,et al. Effects of nitrogen source on crude oil biodegradation[J]. Journal of Industrial Microbiology,1994,13(5):279-286.
[15] Jackson W A,Pardue J H. Potential for enhancement of biodegradation of crude oil in Louisiana salt marshes using nutrient amendments[J]. Water,Air,and Soil Pollution,1999,109(2):343-355.
[16] Rosenberg E,Lagmann R,Kushmaro A,et al. Petroleum bioremediation:A multiphase problem[J]. Biodegradation,1992,3(2/3):337-350.
[17] Tagger S,Bianchi A,Julliard M,et al. Effect of microbial seeding of crude oil in seawater in a model system[J]. Marine Biology,1983,78(1):13-20.
[18] Pnrice R C,Lessard R R,Clark J R,et al. Bioremediation of marine oil spills[J]. Oil and Gas Science and Technology,2003,58(4):463-468.
Field-Scale Bioremediation of Coarse Sand-Gravel Beach Contaminated by Oil Spill
LIANG Sheng-kang1,2,ZHOU Ping1,2,LI Guang-ru3,CHEN Yu3,GUO Li-guo1,2,YANG Shi-mei1,2,WU Liang1,2
(1. College of Chemistry and Chemical Engineering,Ocean University of China,Qingdao 266100,China;2. Key Laboratory of Marine Chemistry Theory and Technology,Ministry of Education,Ocean University of China,Qingdao 266100,China;3. China Offshore Environmental Service Company Limited,Tianjin 300452,China)
A series of field bioremediation experiments were undertaken on the coarse sand-gravel beach in Tianjin Port NO. 6 jetty,in which crude oil had been intentionally added into plots to simulate oil spill. The objectives were to evaluate the effectiveness of various bioremediation strategies,including addition of slow-release fertilize(SRF),addition of water-soluble fertilizer(WSF)and addition of SRF supplemented with oil-degrading bacteria(ODB). The results showed that the plots treated with addition of SRF and ODB had the highest biodegradation rate constant (ks) of hydrocarbons,which was as high as 0.007,2,d-1and was 2.4 times that of the control plot,and accordingly the contents of dissolved nitrogen and phosphorus,as well as the density of ODB could keep a high level in a longer period of time. This indicated that ODB could directly utilize the nutrients realsed from SRF to multiply rapidly. The contents of nitrogen and phosphorus in the plot treated with addition of WSF rose obviously in a short period of time. Meanwhile,the ODB cell densities increased,and the biodegradation constant of hydrocarbons was 1.8 times that of the control plot. However,the oil-degrading rate in the plot treated with addition of SRF were slower than that in the control plot,in spite of the fact that the contents of nitrogen and phosphorus were higher. This may be because thatthe indigenous bacteria growth was not supported by the urea released from SRF,but inhibited by the high local concentrations of ammonium.
oil spill;beach;bioremediation;water-soluble fertilizer;slow-release fertilizer;oil-degrading bacteria
X172
A
0493-2137(2012)04-0343-06
2011-01-14;
2011-05-25.
山东省自然科学基金资助项目(Y2008B28);中国海洋大学与中海石油环保服务有限公司联合攻关项目(2006004).
梁生康(1972— ),男,博士,副教授.
梁生康,liangshk@ouc.edu.cn.
