β-环糊精及其衍生物对黄曲霉毒素B1荧光增强机理研究
2012-06-01张宇昊
张 敏,郭 婷,刘 馨,肖 洁,张宇昊,3,马 良,3,*
β-环糊精及其衍生物对黄曲霉毒素B1荧光增强机理研究
张 敏1,2,郭 婷1,刘 馨1,肖 洁1,张宇昊1,3,马 良1,3,*
(1.西南大学食品科学学院,重庆 400716;2.四川省资阳产品质量监督检验所,四川 资阳 641300;3.重庆市特色食品工程技术研究中心,重庆 400716)
利用光谱法、Benesi-Hildebrand法、热力学方法研究β-环糊精(β-CD)及其衍生物对黄曲霉毒素B1(AFB1)荧光增强机理,探讨溶剂中甲醇体积比、M-β-CD浓度、时间、干扰离子等因素对荧光增强作用的影响。根据Benesi-Hildebrand法确定7种β-环糊精及其衍生物在低浓度时与AFB1包络比为1:1,高浓度时包络比为2:1。采用热力学方法计算了包合常数最大的M-β-CD与AFB1包合过程的熵变(ΔS)、焓变(ΔH)及自由能变化(ΔG)均为负值,说明包合反应是放热反应且能自发进行,焓变是形成超分子包络物的主要驱动力。紫外吸收光谱及KI淬灭实验表明AFB1进入M-β-CD空腔从而使荧光得到保护。得出结论:7种β-环糊精及其衍生物与AFB1通过形成超分子包络物可大幅增强AFB1荧光发射强度,提高AFB1荧光分析法的检测灵敏度。
β-环糊精;AFB1;荧光增强;超分子包络物
黄曲霉毒素B1(aflatoxin B1, AFB1)是黄曲霉菌和寄生曲霉菌的代谢产物,1993年被世界卫生组织(WTO)的癌症研究机构划定为Ⅰ类致癌物,可引起肝细胞变性、坏死,并且分布广,对人类健康危害极大,因此对AFB1的监测显得十分重要[1]。
在研究AFB1检测技术时,使用荧光检测器来检测AFB1超微量的已经被广泛用来作为黄曲霉毒素的高灵敏度的检测方法[2-3]。但是,AFB1的天然荧光很弱,而且荧光特性受溶剂的影响很大。因此必须研究如何提高荧光检测的敏感度,让AFB1的荧光值大大增加,这样能够解决方法检出限较高,不能与国际接轨的问题。现有的AFB1衍生试剂主要有强氧化剂三氟乙酸(TFA)和卤族元素(碘、溴)以及衍生物过溴化吡啶溴(PBPB)等[4]。但是由于具有种种不足,如加热衍生、稳定性差、试剂有挥发性、腐蚀性,保存寿命短等[5]。研究安全而稳定的新型荧光增强剂,提高光学系统灵敏度成为研究黄曲霉毒素检测技术的重要发展方向。
β-环糊精(β-cyclodextrin,β-CD)作为超分子化学最重要的主体,具有外亲水内疏水的特殊结构,可以和多类客体分子形成超分子包络物[6]。Abdel-Shafi[7]、李香[8]、韩建荣[9]等研究表明β-CD及其衍生物分别与1-萘酚-5-磺酸盐、姜黄素、双臂苯并15-冠-5形成超分子体系的过程中,荧光强度增加。Wagner[10]、段云青[11]、侯法菊[12]等将β-CD及其衍生物分别作为甘氨酸和赖氨酸、 灭鼠剂溴敌隆、铕(Ⅲ)-强力霉素(DC)体系的荧光增敏试剂,提高了检测灵敏度,为高灵敏度检测技术的开发提供了新的思路和方向。Franco[13]、Cavaliere[14]、刘雪芬[15]等研究了β-CDs对AFB1的荧光增强作用,但未对增强机理进行研究。因此,本实验利用荧光光谱法研究了7种β-CDs与AFB1的超分子相互作用,并采用Benesi-Hildebrand双倒数法、热力学、KI淬灭实验等对增强机理进行探索,对影响包络反应的温度、反应时间、反应物质量浓度、干扰离子等因素进行研究,为研究和开发新型高效的荧光增强剂、扩大β-CDs在食品安全中的应用范围提供参考。
1 材料与方法
1.1 材料、试剂与仪器
AFB1(称取0.0010g溶于1mL甲醇中,配制成质量浓度为1.0g/L的标准储备液,密封后,于冰箱中4℃保存,使用时用甲醇稀释) 美国Sigma公司。
甲醇(色谱纯) 天津四友精细化学品有限公司;β-环糊精、2,4-二甲基-β-环糊精(DM-β-CD)、羟丙基-β-环糊精(HP-β-CD)、羟乙基-β-环糊精(HE-β-CD)、甲基-β-环糊精(M-β-CD)、磺丁基-β-环糊精、葡萄糖基-β-环糊精均为分析纯 山东新大精细化工有限公司。
F-2500荧光分光光度仪 日本日立公司;JY2002分析天平(精度0.0001g) 上海精密科学仪器有限公司天平仪器厂。
1.2 方法
1.2.1 荧光光谱扫描方法
取1mL混合均匀的AFB1样液,用1.0cm荧光用石英比色杯放置在F-2500荧光分光光度计中进行荧光发射光谱、激发光谱的扫描(激发光源为150W氙弧灯;响应时间:自动;扫描速率:1200nm/min;扫描光谱进行仪器自动校正),仪器狭缝均置为5nm。固定365nm波长,扫描样液的荧光发射光谱,得到最佳荧光发射波长;固定440nm波长,扫描样液的激发光谱,得到最佳激发波长。
1.2.2 荧光衍生测定方法
取特定质量浓度的AFB1标准品溶液,加入一定体积的β-CDs溶液,混合均匀,用1.0cm荧光用石英比色杯,以最佳激发波长的光源激发,于最佳荧光发射波长处测量荧光强度,荧光分光光度计狭缝均置为5nm。
1.2.3 温度测定方法
将混匀的AFB1-β-CDs溶液于1.0cm荧光用石英比色杯中,加盖,置于自制控温装置中放置2min后,按1.2.2节方法测定荧光强度。
2 结果与分析
2.1 AFB1的荧光光谱
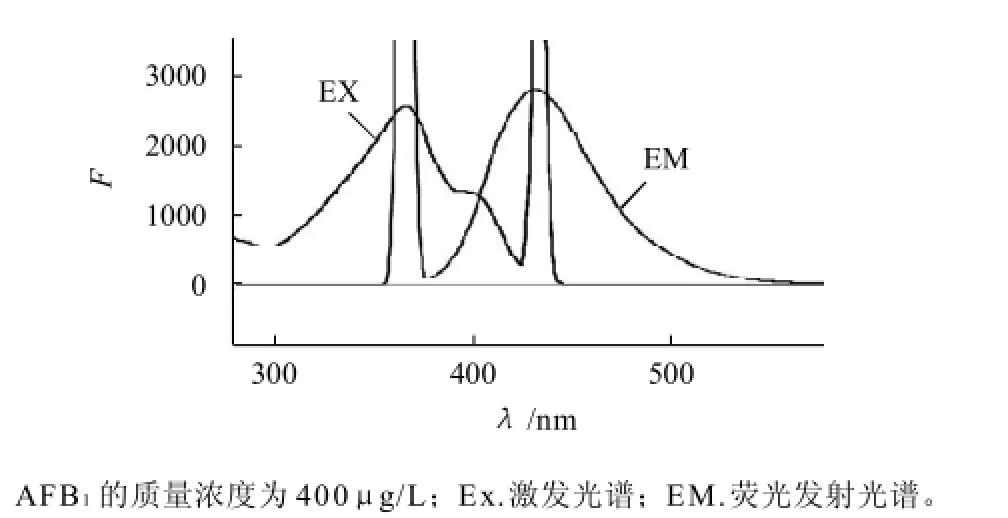
图1 AFB1荧光激发光谱和发射光谱Fig.1 Excitation and emission spectra of AFB1
由图1可知,AFB1的荧光体系最大激发波长是365nm,最大发射波长是432 nm。在这种激发波长和发射波长下,可以对AFB1荧光增强作用进行考察。
2.2 β-CD及其衍生物对AFB1的荧光增敏作用
由图2可知,在室温(20℃)、溶剂中甲醇体积分数为2%、反应时间2min条件下,除β-CD激发光谱略微红移(366~370nm),其余6种β-CDs衍生物均未发生明显移动。7种β-CDs的加入均未使AFB1的发射峰波长发生明显移动。说明β-CDs对AFB1可能只起着物理的包络作用,其荧光性质没有发生变化。7种β-CDs均使AFB1的荧光激发和发射显著增强。这种荧光增敏作用应该是由于在疏水作用、范德华力级氢键力等非共价键作用的驱动下,进入β-CDs空腔形成超分子包络物所致。分析可能原因为:1)β-CDs空腔为AFB1的生色团提供了一个非极性环境,使其处于去水化状态,对增进量子效应从而为增强荧光强度提供了有利的条件;2)当AFB1包合进β-CDs分子的空腔后,β-CDs腔的构造保护了AFB1的荧光单级态分子免于从外部淬灭;3)可能由于增加了疏水性AFB1在水中的溶解度,而增加了荧光强度。
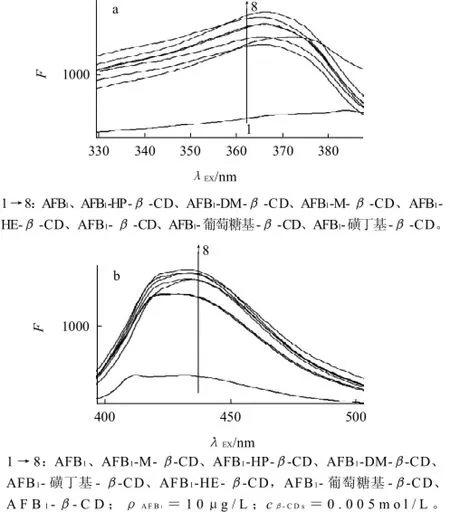
图2 AFB1及AFB1-β-CDs反应物的激发(Ex)和发射(Em)光谱Fig.2 Excitation and emission spectra of AFB1 and AFB1-β-CDs
2.3 包络物包络比及包络常数的测定结果
如果小分子配体具有荧光,当其与大分子作用后荧光强度增大,可利用Benesi-Hildebrand 法研究主客体的结合比。若β-CDs 浓度远大于客体分子(G)浓度(即[β-CDs]≥[G]),根据改进的Benesi-Hildebrand方程[16]:
[AFB1]/(F-F0)=1/[β-CDs]·K·α+1/α (1)
式中:F0和F分别为加入β-CDs前后溶液的荧光强度;α为常数;[AFB1]和[β-CDs]分别为AFB1和CD的总浓度;K是包络常数。K值的大小反映了β-CDs与客体分子形成包络物时结合力的强弱。若 [AFB1]/ (F-F0)对1/[β-CDs]的双倒数图呈线性,则只形成1:1包合,用所得直线的斜率除以截距计算得K。若双倒数图是两条交叉的直线,则β-CDs在不同浓度时与客体分子形成不同包络比的包络物,即低浓度时与AFB1呈1:1包络,在高浓度时呈2:1包络。此方法最有意义之处是可以揭示客体分子与环糊精之间的多级包合,这一特点是其他方法所不能及的[17]。包合过程如下:

包络常数K=K1·K2[18],K1、K2分别由两条交叉直线的斜率与截距计算得出,K1为低浓度时的包络常数;K2为高浓度时的包络常数;β-CDs:AFB1表示β-CDs与 AFB1形成1:1包络物;2β-CDs:AFB1表示β-CDs与AFB1形成2:1包络物。
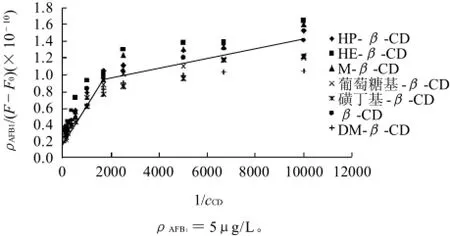
图3 AFB1-CM-β-CD 双倒数图Fig.3 Double reciprocal plots for inclusion complexes between AFB1 andβ-CD or its derivatives
为了确保Benesi-Hildebrand方法的可靠性[19],使初始浓度比cβ-CDs/ρAFB1=6000mol/μg>100mol/μg。20℃时,7种β-CDs的双倒数图均呈两条交叉的直线,如图3所示,说明7种β-CDs与AFB1在低浓度时形成1:1包合,高浓度时形成2:1包合。
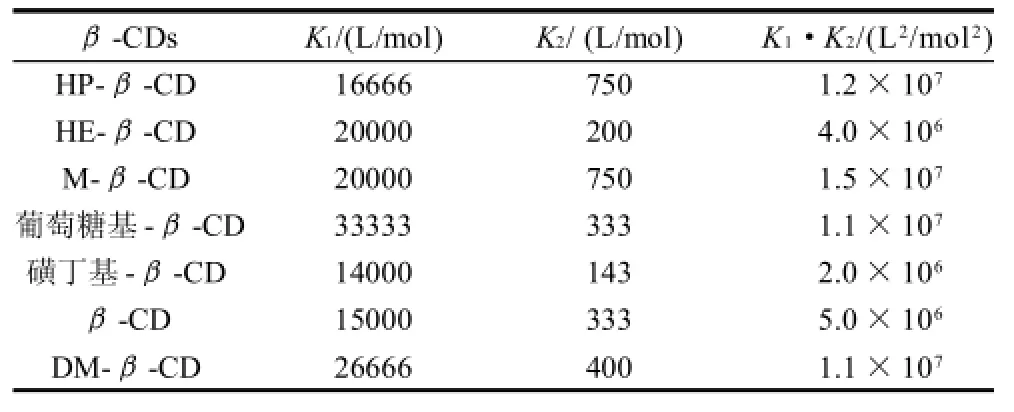
表1 AFB1与不同β-CD的包合常数Table 1 Inclusion constants of AFB1 with β-CD or its derivativess
由双倒数图计算出各自的包络常数,见表1。K2均远小于K1,说明AFB1的一端进入β-CD空腔时,另一端与另一β-CDs分子结合变得困难。这是由于β-CDs空腔直径较大,与AFB1形成1:1包合后可继续沿着AFB1分子穿透,干扰了第2个β-CD分子与AFB1的作用。比较7种β-CD的包合常数大小次序为:M-β-CD>HP-β-CD>DM-β-CD(葡萄糖基-β-CD)>β-CD>HE-β-CD>磺丁基-β-CD。选择包合常数最大的M-β-CD作为AFB1荧光增强剂进行进一步研究。
2.4 包络反应热力学常数
根据范德霍夫方程lnK=-ΔH/RT+ΔS/R,以各温度条件下的lnK对温度的倒数(1/T)进行线性回归,根据直线的斜率和截距可求得包络物形成过程的热力学参数: ΔH及ΔS;再根据热力学定律:ΔH=ΔG+TΔS,可求得包合反应的ΔG[16],结果如表2所示。

表2 不同温度下M-β-CD- AFB1的包络常数和热力学参数Table 2 Effect of temperature on K,ΔG,ΔH andΔS of M-β-CDAFB1
由表2可知,说明随着温度的升高,K值逐渐减小,说明包络物可能趋于离解,客体分子又从M-β-CD空腔内重新进入水相,包络物的稳定性降低,也表明低温有利于包络反应的进行。吉布斯函变ΔG<0,说明包络过程是一个自发的过程;焓变ΔH<0,说明反应是一个放热过程,其源于主客体分子的范德华力及释放M-β-CD空腔内高能水分子。分子的几何形状引起的空间障碍和空腔对客体分子平移和旋转自由度的限制将引起负的熵变,而疏水性客体分子在进入空腔前脱去水壳并释放结合水将引起正的熵变。在本系统中熵变S<0,说明分子的几何形状引起的空间障碍和空腔对客体分子平移和旋转自由度的限制在包络过程中起着非常重要的作用。
2.5 KI淬灭实验
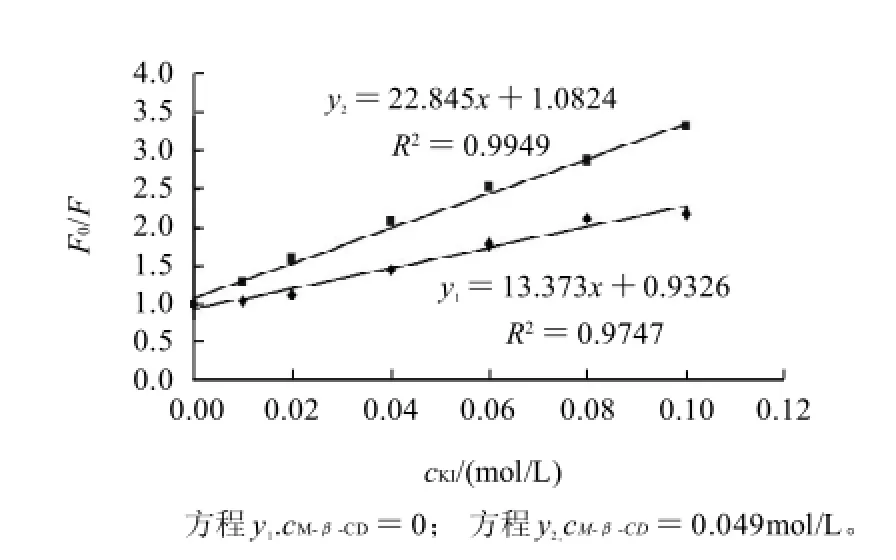
图4 KI对AFB1及M-β-CD- AFB1体系的荧光淬灭Fig.4 AFB1 fluorescence quenching by KI in the absence and presence of M-β-CD
KI是常用的阴离子淬灭剂,可以淬灭许多小分子的荧光。在动态淬灭过程中,荧光体与淬灭剂分子间的相互作用可用Stern-Volmer方程进行描述F0/F=1+Ksv[Q],其中F0与F分别是加入淬灭剂前后的荧光强度,[Q]为淬灭剂浓度/(mol/L),Ksv为动态淬灭常数/(L/mol)[9]。如图4所示,M-β-CD存在时,KI对M-β-CD-AFB1体系荧光的淬灭要比对游离的AFB1弱一些,说明M-β-CD对AFB1的荧光具有保护作用。这为AFB1进入M-β-CD空腔提供了直接证据。
2.6 紫外吸收光谱
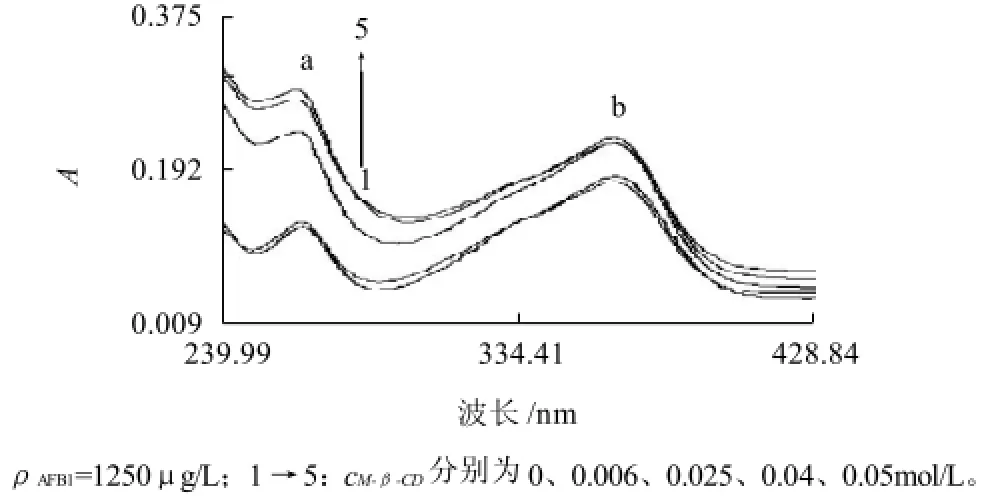
图5 包结前后AFB1的紫外吸收光谱Fig.5 UV absorbance spectra of AFB1 before and after inclusion
由图5可知,AFB1在紫外区有两个吸收峰a(264nm)和b(364nm),b为AFB1分子的吸收峰,推测a可能为构成AFB1分子的双呋喃环或香豆素的特征吸收峰。加入M-β-CD后吸收光谱形状没有发生改变,随着M-β-CD浓度的变化,吸光度发生了相应的变化,为AFB1进入M-β-CD空腔提供了证据。a峰紫外吸收随M-β-CD浓度的增加呈规律性的增加,表明AFB1的某一基团进入M-β-CD空腔,发生了分子间的包结作用。
2.7 M-β-CD- AFB1超分子体系荧光强度影响因素
2.7.1 溶剂中的甲醇体积分数
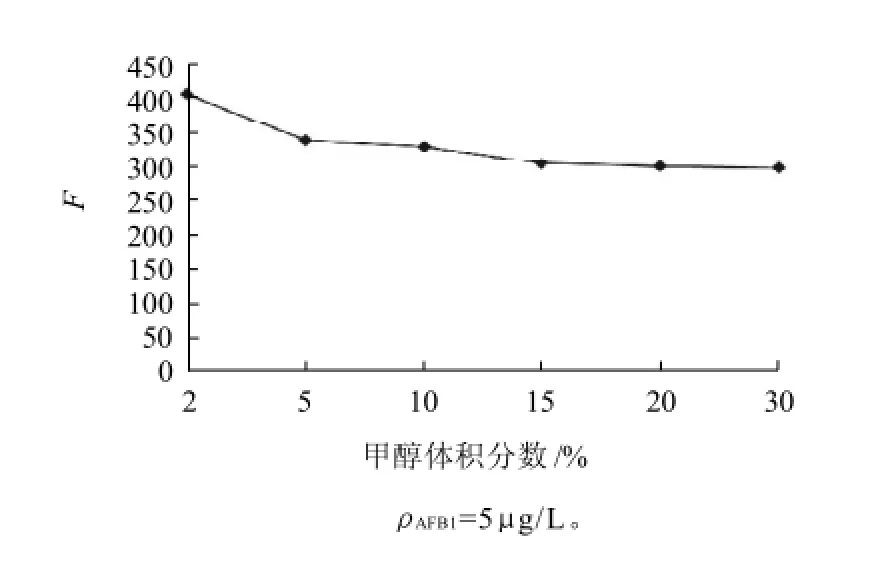
图6 甲醇体积分数对荧光强度的影响Fig.6 Effect of methanol concentration on fluorescence intensity
由于AFB1溶于有机溶剂,在水中溶解度极低;M-β-CD溶于水,能够增加AFB1在水相中的溶解度。因此,甲醇在整个反应体系中的比例对荧光值的增强是一个考察的重点因素。由图6可知,甲醇体积分数越低,荧光值越高。分析原因,有机溶剂主要影响M-β-CD与客体分子间的疏水作用,随甲醇体积分数的增加主客体间的疏水作用减弱。有人认为两个过程可能会导致该现象:一是小分子对M-β-CD空腔的竞争作用致使空腔内的客体被置换到水相中,二是M-β-CD、客体分子及小分子形成三元超分子包结物。分析甲醇和AFB1的结构特点不易与M-β-CD形成三元包结物[20]。所以推测是甲醇分子竞争进入M-β-CD空腔,导致AFB1包合不完全,从而使荧光强度降低。
2.7.2 M-β-CD浓度
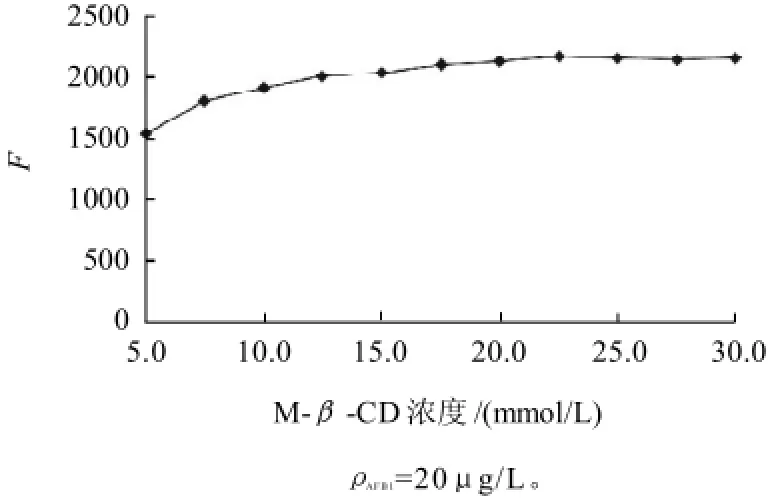
图7 M-β-CD浓度对荧光强度的影响Fig. 7 Effect of M-β-CD concentration on fluorescence intensity
由图7可知,AFB1质量浓度为20μg/L时,随着M-β-CD浓度的增加,体系的荧光强度时,显著增大,至22.5mmol/L时,荧光强度基本稳定,继续增大M-β-CD用量,荧光强度增加很缓慢。
2.7.3 放置时间

图8 放置时间对荧光强度的影响Fig.8 Effect of sitting time on fluorescence intensity
由图8可知,加入试剂摇匀后,室温条件下放置1min荧光强度即可稳定,且较长时间内保持稳定。
2.7.4 干扰离子
由于AFB1主要污染花生、玉米、饲料等,根据文献[2 0]报道,此类农作物及其加工产品中,含有Ca2+、Mg2+、K+、Na+、Fe3+等元素。考虑到这些元素可能会对测定造成干扰,因此在优化实验条件下,考察这些共存离子对测定的影响。以空白干扰信号强度的3倍标准差(S)作为判断干扰与否的标准, 除Fe3+对荧光有强淬灭作用,绝大多数离子不会对测定产生干扰,结果见表3。
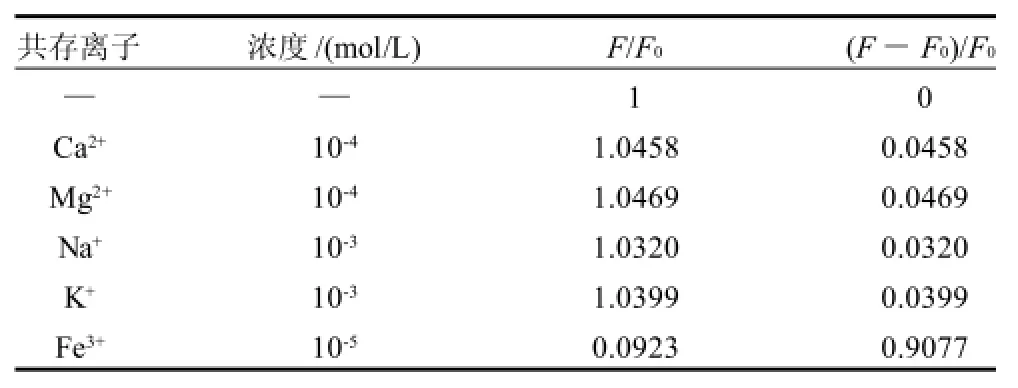
表3 共存离子对AFB1荧光强度的影响Table 3 Effect of interfering ions on AFB1 fluorescence intensity
3 结 论
β-CDs与AFB1通过形成超分子包络物从而大幅度提高了体系的荧光响应值,利用这种特性可提高AFB1荧光检测的灵敏度。实验对β-CDs增强AFB1荧光强度的机理进行了研究,Benesi-Hildebrand表明6种β-CDs低浓度时均能与AFB1形成1:1型的超分子包络物,高浓度时形成2:1型包络物,从而大大增强AFB1的荧光发射强度。但是在某些情况下,对于2:1型作用体系,Benesi-Hildebrand方程可能会给出错误的作用比信息,因此要明确包合比,需在今后进行更严谨的研究。实验选择了包合常数最大的M-β-CD做进一步研究显示,M-β-CD与AFB1包合过程的熵变ΔS、焓变ΔH及自由能变化ΔG均为负值,说明包合反应是放热反应且能自发进行,焓变是形成超分子包络物的主要驱动力。KI淬灭实验结果表明AFB1进入M-β-CD空腔,从而荧光得到保护。溶剂中甲醇体积分数、M-β-CD浓度、时间、温度、干扰离子等对包络反应均有较大影响。在实际应用中,通过对各影响因素的控制,可以达到最佳荧光增强效果。
[1]付成平, 欧阳华学, 刘瑜. 柱前衍生化高效液相色谱法测定中草药提取物中的黄曲霉毒素B1[J]. 西南农业学报, 2009, 22(2): 522-524.
[2]FERREIRA I M P L V O, MENDES E, OLIVEIRAl M B P P. Quantification of aflatoxins B1, B2, G1, and G2 in pepper by HPLC/ fluorescence[J]. Journal of Liquid Chromatography Related Technologies, 2004, 27: 325-334.
[3]ABBAS HAMED K, SHIER W T, HORN B W, et al. Cultural methods for aflatoxin detection[J]. Journal of Toxicology: Toxin Reviews. 2004, 23(2/3): 295-315.
[4]马良. 黄曲霉毒素B1高灵敏度检测技术研究[D]. 北京: 中国农业科学院院, 2007.
[5]李培武, 马良, 杨金娥, 等. 粮油产品黄曲霉毒素B1检测技术研究进展[J]. 中国油料作物学报, 2005, 27(2): 77-81.
[6]童林荟. 环糊精化学: 基础与应用[M]. 北京: 科学出版社, 2001: 145.
[7]ABDEL-SHAFI A A, AL-SHIHRY S S. Fluorescence enhancement of 1-napthol-5-sulfonate by forming inclusion complex with β-cyclodextrin in aqueous solution[J]. Spectrochimica Acta, 2009,72(3): 533-537.
[8]李香, 林秀丽. β-环糊精及其衍生物对姜黄素的增容和荧光增强作用[J]. 中国医药工业杂志, 2008, 39(3): 194-198.
[9]韩建荣, 陈圆圆, 张衡益, 等. 环糊精在水溶液中与双臂苯并15-冠-5相互作用的荧光行为. 大环化学和超分子化学研究进展: 中国化学会全国第十二届大环第四届超分子化学学术讨论会论文集[C]. 北京:中国化学会, 2004.
[10]WAGNER B D, McMANUS G J. Enhancement of the fluorescence and stability of O-phthalaldehyde-derived isoindoles of amino acids using hydroxypropyl-β-cyclodextrin[J]. Analytical Biochemistry, 2003, 317: 233-239.
[11]段云青, 闵顺耕. 杀鼠剂溴敌隆和环糊精的超分子作用及分析应用[J]. 分析实验室, 2009, 28(5): 1-5.
[12]侯法菊. 修饰β-环糊精对铕(Ⅲ)-强力霉素体系荧光的增强作用及其分析应用[J]. 化学工程师, 2008, 159(12): 62-64.
[13]FRANCO C M, FENTE F A, VAZQUEZ B I, et al. Interaction between cyclodextrins and aflatoxins Q, M, and P fluorescence and chromatographic studies[J]. Journal of Chromatography A, 1998, 815: 21-29.
[14]CAVALIERE C, FOGLIA P, PASTORINI E, et al. Liquid chromatography tandem mass spectrometric confirmatory method for determining aflatoxin M1 in cow milk comparison between electrospray and atmospheric pressure photoionization sources[J]. Journal of Chromatography A, 2006, 1101: 69-78.
[15]刘雪芬, 李培武, 张文. 环糊精对花生黄曲霉毒素B1荧光增强作用与应用研究[J]. 中国油料作物学报, 2010, 32(4): 546-550.
[16]COLY A, AARON J J. Fluorimetric analysis of pesticides: methods, recent developments and applications[J]. Talanta, 1998, 46(5): 815-843.
[17]何仲贵. 环糊精包合物技术[M]. 北京: 人民卫生出版社, 2008: 109-110.
[18]李香, 林秀丽. β-环糊精及其衍生物对姜黄素的增溶和荧光增强作用[J]. 中国医药工业杂志, 2008, 39(3): 194-198.
[19]WANG Rui. Validity and reliability of Benesi-Hildebrand method[J]. Acta Phys-Chim Sin, 2007, 23(9): 1353-1359.
[20]戴良香, 万书波, 张志萌, 等. 不同类型花生品种主要矿质元素含量分布及相关性分析[J]. 营养学报, 2009, 31(6): 606-608.
Mechanisms Underlying Fluorescence Enhancement of Aflatoxin B1by β-Cyclodextrin and Its Derivatives
ZHANG Min1,2,GUO Ting1,LIU Xin1,XIAO Jie1,ZHANG Yu-hao1,3,MA Liang1,3,*
(1.College of Food Science, Southwest University, Chongqing 400716, China;2. Product Quality Supervision and Assay Office of Ziyany, Ziyang 641300, China;3. Chongqing Special Food Programme and Technology Research Center, Chongqing 400716, China)
The mechanisms underlying fluorescence enhancement of aflatoxin B1 (AFB1) by β-cyclodextrin (β-CD) and its derivatives were explored using spectroscopy, Benesi-Hidebrand analysis and thermodynamics. Moreover the effects of methanol volume percentage, M-β-CD concentration, reaction time and interfering ions on fluorescence enhancement were analyzed. β-CD and its six derivatives showed an inclusion ratio to AFB1 of 1:1 at low concentrations and 2:1 at high concentrations. The thermodynamic parameters entropy change (ΔS), enthalpy change (ΔH) and free energy change (ΔG) for maximum inclusion constant between M-β-CD and AFB1 were negative, suggesting that the inclusion reaction is exothermic and can occur spontaneously. Enthalpy change was the dominant force during the formation of inclusion complexes. UV absorption spectra and KI quenching experiments showed that AFB1could enter M-β-CD cavity to protect fluorescence. Therefore, βcyclodextrin and its derivatives can allow considerable enhancement in the fluorescence emission intensity of AFB1 by the formation of supramolecular inclusion complexes, resulting in increased sensitivity of AFB1 fluorescence analysis.
β-cyclodextrin;aflatoxin B1;fluorescence enhancement;supramolecular inclusion
TS207.3
A
1002-6630(2012)15-0028-06
2011-07-04
国家“863”计划项目(2007AA10Z427);中央高校基本科研业务费专项(XDJK 2009C056);
西南大学研究生科技创新基金项目(ky2010006)
张敏(1987—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:zmsally@163.com
*通信作者:马良(1979—),女,副教授,博士,研究方向为食品安全检测技术与食品质量控制。E-mail:zhyhml@163.com
