鲜切果蔬品质劣变影响因素及其可能机理
2012-06-01罗海波包永华戴云云郁志芳
罗海波,何 雄,包永华,戴云云,郁志芳,*
鲜切果蔬品质劣变影响因素及其可能机理
罗海波1,2,何 雄1,包永华3,戴云云2,郁志芳2,*
(1.浙江医药高等专科学校生物与食品系,浙江 宁波 315100;2.南京农业大学食品科技学院,江苏 南京 210095;3.浙江经贸职业技术学院应用工程系,浙江 杭州 310018)
鲜切果蔬是指新鲜果蔬原料经预处理、清洗、切分、保鲜、包装和贮藏等多道工序制成的不影响其鲜活状态的一种制品。品质快速劣变是影响其货架寿命的主要原因。本文综述鲜切果蔬品质快速劣变的影响因素及其可能机理,旨在为鲜切果蔬贮藏保鲜新技术的建立和应用提供理论依据。
鲜切果蔬;品质劣变;生理生化;机理
鲜切果蔬是遭受人为机械损伤的生命有机体,是一种保持果蔬原有特殊风味和品质的生鲜食品[1]。切分造成的极大损伤与一般的局部机械损伤不同,对生理生化代谢、风味品质以及安全性都将产生较大的影响,如呼吸速率显著提高、乙烯产生量增加、膜脂过氧化和酚类物质氧化反应加强、易受微生物污染等[2]。此外,切分还诱导次生代谢产物的积累和愈伤组织的形成[3]。
鲜切果蔬品质劣变的研究已有大量报道,且不同鲜切果蔬的主要品质劣变现象也存在差异。苹果、梨、香蕉、荔枝、山药、甘薯、莲藕及蘑菇等的主要品质劣变现象是褐变;枇杷、胡萝卜、竹笋及绿芦笋等的主要品质劣变现象是木质化;而甜瓜、西瓜、草莓、生菜、菠菜、芫荽叶及辣椒等则以微生物腐败为主[4-6]。目前,国内外科研工作者针对鲜切果蔬不同的品质劣变现象提出了其生理生化机制,然而系统性的报道甚少。
本文综述了鲜切果蔬品质劣变的影响因素及其可能机理,以期为鲜切果蔬贮藏保鲜新技术的建立和应用提供理论依据。
1 鲜切果蔬品质劣变相关的生理生化变化与酶
新鲜果蔬经过清洗、切分、保鲜和包装等处理后,组织产生机械损伤,细胞的完整性及酶与底物的区域化结构被破坏,酶与底物直接接触,加之伤信号的迅速传递,从而诱导果蔬组织发生错综复杂的生理生化反应,并扩散、影响远离伤害部位的细胞,使鲜切果蔬组织快速衰老与腐败[7]。
1.1 伤胁迫
果蔬切分造成的机械损伤等胁迫因子称为第一信使。果蔬细胞从感受胞外环境信号和胞间信号后产生的胞内信号分子统称为第二信使。一般认为,切分形成的伤信号包括植物激素(如茉莉酸类,水杨酸、脱落酸、乙烯)、多肽分子(如系统素)、多糖分子(如寡糖素)以及物理信号(如水压、电脉冲)等[8]。此外,伤信号在韧皮部中传递比较快而化学物质信号传递比较慢的事实暗示伤反应可能存在其它的信号[9]。但也有人认为伤信号不是受伤组织特异形成的,而是伤害细胞最初伤响应的副产品[10]。
钙离子作为植物细胞中最重要的第二信使,参与植物对许多逆境信号的转导过程。在非生物逆境条件下如机械损伤,植物细胞质内的钙离子在时间、空间及浓度上会出现特异性变化,即诱发产生钙信号。细胞质中的这种钙离子浓度的特异性变化是它作为细胞次级信使来区分不同原始信号的一种反应,并通过与它的作用介质——钙结合蛋白相互作用而将信号继续向下游传递,进而在细胞内引起一系列的生物化学反应以适应或抵制各种胁迫[11]。
目前关于伤信号的研究报道较少,其确切特征仍不清楚,但对伤信号的鉴定和特点分析将有利于控制鲜切果蔬的伤响应,消除或者弱化伤信号延缓鲜切果蔬品质劣变是值得考虑的途径。
1.2 伤乙烯和伤呼吸
乙烯作为植物生长调节剂,几乎所有植物组织均有产生乙烯的能力,但在多数情况下乙烯产生量较少。当植物受到伤害后乙烯产生量增加,称为伤乙烯[12]。Lulai等[13]研究表明,完整的马铃薯块茎在贮藏(21℃,95% RH)前9d乙烯产生很少,直到第9天发芽时才有所增加,而切分后的马铃薯块茎在贮藏第2天即达到最大值,且比完整马铃薯高出几十倍。伤乙烯的产生促进了果蔬组织的衰老与腐败,尤其在呼吸跃变型果蔬中表现更为突出。此外,果蔬中芳香物质的代谢受乙烯调节。Saltveit[14]研究发现,鲜切生菜经乙烯处理后酚类化合物的含量显著升高。
切分造成的机械伤还会显著增加果蔬组织呼吸速率,即伤呼吸,并随着衰老过程而进一步加强,甚至还会改变某些果蔬呼吸途径。Aguayo等[15]研究表明,切分后的西红柿呼吸速率明显高于未切分的呼吸速率,而且呼吸速率随伤害程度的增加而增加。茭白未切分时呼吸速率为71mg CO2/(kg·h),切分后立即测定即增加到168mg CO2/(kg·h)[16]。不同的切分方式对呼吸速率的影响也不同,切分越细,果蔬表面积增加越大,呼吸速率越高。
鲜切果蔬呼吸速率上升加速了糖类消耗、淀粉降解、三羧酸循环和电子传递链的活化,并产生大量CO2、O2以及剧增的热量释放等生理效应[17]。另外,鲜切果蔬表面的汁液阻塞气孔,气体扩散速率下降,造成局部CO2/O2的比值上升,达到一定程度后诱发无氧呼吸,造成乙醇和乙醛的大量积累,使产品风味发生变化,货架寿命缩短[18]。鲜切果蔬对于温度更为敏感,温度高时生理和生化反应加速,不利于产品品质。一般来说,在一定的温度范围内,降低温度呼吸速率就大大降低。果蔬呼吸速率越小,物质消耗就越慢,货架寿命就会延长[19]。
1.3 细胞膜降解
细胞膜是防止细胞外物质自由进入细胞的屏障,它调节和选择物质进出细胞,保证了细胞内环境的相对稳定,使各种生理生化反应能够有序运行。细胞膜可通过胞饮作用、吞噬作用或胞吐作用吸收、消化和外排细胞膜外、内的物质。在细胞识别、信号传递、纤维素合成和微纤丝的组装等方面,细胞膜也发挥重要作用。
鲜切果蔬加工过程中导致细胞膜结构的破坏及原生质流动性的丧失,引起膜组分迅速降解。细胞膜降解会导致细胞和组织结构的去区域化及正常细胞功能丧失。许多次级反应是由膜降解引起的,最常见的是组织褐变和异味的产生。另外,果蔬组织软化也与细胞壁组分的降解有关。研究[8]表明,鲜切马铃薯在切分后15min内,切片的磷脂减少35%,糖脂减少30%。
切分还可能活化那些在正常条件下活性很低的酶,包括一些控制细胞壁、细胞膜代谢的酶。田密霞等[20]研究表明,鲜切皇冠梨贮藏过程中其多聚半乳糖醛酸酶活性提高了近7倍,脂氧合酶活性提高了近5倍。
1.4 次生代谢物质积累和愈伤组织形成
植物次生代谢是相对于植物初生代谢或称基本代谢而言。次生代谢产物是指植物中一大类并非生长发育所必需的小分子有机化合物,包括苯丙素类、醌类、黄酮类、单宁类、萜类、甾体及其苷、生物碱等,这些物质在植物体内含量不等且有自己独特的代谢途径。植物次生代谢产物是植物对环境的一种适应,是长期进化过程中植物与生物和非生物因素相互作用的结果。在对环境胁迫的适应、植物之间的相互竞争和协同进化、植物对昆虫的危害、草食性动物的采食及病原微生物的侵袭等过程的防御中起着重要作用[21]。
果蔬组织受到切分等伤害后能诱导次生代谢产物的合成与积累。这些物质主要集中在伤口及其附近组织,参与伤愈合反应和抵抗病虫的入侵,往往在受伤后立即开始合成。不同种类的果蔬,即使同一果蔬的不同品种,产生次生物质的种类和数量也有差异,产地不同的同一品种,伤诱导的次生物质也有差异。番茄果皮受伤后表层细胞均发生栓质化反应,而柑橘果皮受伤部位发生木质化反应,在枇杷、胡萝卜、竹笋等果蔬上表现尤为突出[22-24]。栓化或木质化及创伤周皮的形成受组织自身状况和周围环境条件(如温度、湿度、气体组分)的影响,组织的伤愈合能改变鲜切加工产品的外观、影响商品性状和降低食用价值。
1.5 蒸腾与失重
蒸腾是植物失水过程,也是植物吸水和物质转运的重要动力,它能促进水分在植物体内传导和从土壤中吸收矿物质随水上运,并降低叶面温度、免受强光灼伤。蒸腾作用是水分从活的植物体表面以水蒸气状态通过气孔及幼嫩的角质层大量散失到大气中的过程,与物理学蒸发过程不同,蒸腾作用不仅受外界环境条件影响,而且还受植物本身的调节和控制,因此它是一种复杂的生理过程[25]。
鲜切果蔬与完整新鲜果蔬组织一样,含水量高达80%~95%,色泽鲜亮、组织器官饱满、质地脆嫩,显现出新鲜、优良的品质。新鲜果蔬经过整理、清洗和切分等加工处理后,原有的角质层、蜡质层等保护结构及蒸腾作用发生的自然孔道(气孔和皮孔)被破坏,细胞组织直接大面积暴露在空气中,造成蒸腾作用显著增强,同时细胞组织失去的水分又得不到补充,鲜切果蔬就成为一个蒸发体,不断地蒸腾失水,细胞膨压降低,最终导致组织萎蔫、疲软、皱缩,逐渐失去新鲜度,并引发一系列的不良生理反应[26]。
研究表明,果蔬组织失水率达到鲜切果蔬产品总质量的4%~6%时,就会呈现明显的萎蔫和起皱现象,鲜度下降。通常在温暖、干燥的环境中几小时,大部分鲜切果蔬都会出现萎蔫和皱缩[27]。有些鲜切果蔬虽然没有达到萎蔫程度,但失水已影响到果蔬的口感、脆度、硬度、颜色和风味。鲜切果蔬出现失水萎蔫时,水解酶活性提高,细胞中的大分子物质加速向小分子转化,呼吸底物的增加会进一步刺激呼吸作用。严重脱水时,细胞液浓度增高,有些离子如NH4+和H+浓度过高会引起细胞中毒,甚至会破坏原生质的交替结构。过度缺水还会引起脱落酸含量增加,并且刺激乙烯合成,加速器官的衰老[28]。
此外,失水萎蔫破坏了正常的代谢过程,水解作用加强,细胞膨压下降造成结构特性改变,必然影响鲜切果蔬的耐贮性和抗病性[29]。因此,鲜切果蔬加工贮运过程中的蒸腾失水是导致其品质下降,货架寿命缩短的重要方面。
1.6 鲜切果蔬的褐变
褐变是鲜切果蔬加工贮藏过程中普遍存在的一种变色现象,是造成鲜切果蔬品质下降的一个重要原因。褐变不仅可引起鲜切果蔬色、味等感观性状的下降,还会造成营养损失,甚至影响产品的安全性。果蔬褐变一般可分为两大类:一类是在氧化酶催化下的多酚类物质的氧化变色,称为酶促褐变;另一类是如美拉德反应、焦糖化作用等产生的褐变没有酶的参与,称为非酶褐变[30]。而鲜切果蔬中的褐变,常以酚酶引起的酶促褐变反应最为明显。关于果蔬酶促褐变机理,科研工作者曾先后提出过乙醛乙醇毒害学说、自由基伤害假说、保护酶系统假说、酚-酚酶区域化分布学说等理论,目前比较容易接受的解释酶促褐变的是酚-酚酶区域化分布学说。果蔬中酚类物质主要分布在细胞中的液泡中(约占97%),仅有少量(约3%)分布在细胞壁中。正常情况下,由于膜系统的存在使酚类物质与引起褐变的酶类分隔开,酚类物质不易发生氧化而使组织褐变,一旦膜系统被破坏,酚类物质在多酚氧化酶(PPO)、过氧化物酶(POD)等酶的催化作用下快速氧化,导致果蔬组织褐变[31]。
1.6.1 酚类物质
酚类物质是果蔬中含量最多的次生代谢产物之一,其代谢直接影响到果蔬的外观、鲜食和贮运品质。木质素、类黄酮及酚类色素的合成,石细胞的发育,贮藏期间的组织褐变等都与之密切相关[32]。酚类物质根据碳骨架的不同,可分为简单酚类(如氢醌、熊果苷)、木质素、类黄酮类、鞣质类(俗称单宁)和其他酚类等;根据酚类物质的溶解性,可将其分为水溶性酚类物质(包括各种酚酸、黄酮类化合物、花色素、水溶性单宁等,可溶于水和乙醇,但氧化后不溶于水,能溶于乙醇)和非水溶性酚类物质(包括缩合单宁和木质素等)两类[33]。
果蔬组织中的酚类物质种类多样,主要包括肉桂酸、酪氨酸、3,4 -二羟基苯丙氨酸、4-甲基儿茶酚、焦性没食子酸、没食子酸、咖啡酸、绿原酸、儿茶酚、表儿茶酚、愈创木酚、多巴胺及其聚合物和酯化物等。这些酚类物质一般在果蔬生长发育中合成,但若在采收期间或采收后处理不当而造成机械损伤,或在胁迫环境中也能诱导酚类物质的合成[34]。几种代表性果蔬中的主要酚类物质见表1。
酚类物质广泛存在于果蔬组织中,然而通常只有其中的一种或几种能被酶作为底物而氧化,导致果蔬褐变。引起荔枝果皮褐变的主要物质是(—)-表儿茶素[35];南果梨褐变发生时主要是绿原酸在活力较高的PPO作用下氧化所致[36];富士苹果褐变主要是表儿茶素氧化引起[37]。酚类物质的种类、含量及存在状态的差异是造成不同果蔬褐变特性不同的主要原因之一。
1.6.2 酶促褐变相关酶
果蔬组织酶促褐变中涉及的酶包括PPO、POD、苯丙氨酸解氨酶(PAL)和抗坏血酸过氧化物酶(APX)等,其中以PPO和POD研究较多。
1.6.2.1 PPO
催化果蔬酶促褐变反应的酶类主要为PPO,国内外关于PPO的研究已有80多年的历史,在PPO的细胞和组织定位、分离纯化、生化特性、酶反应动力学、同工酶、氨基酸组成和空间结构、基因的碱基序列表达、调控、生理功能和应用等方面取得了许多成果,对其生理功能及与在酶促褐变中的作用也越来越明确。PPO催化的酶促褐变反应分两步进行:单酚羟化为二酚,然后二酚氧化为二醌。PPO以铜离子为辅基,其活性的最适pH值范围为4~8,有一定耐热性,其活性可以被金属离子螯合剂、有机酸、硫化物、酚类底物类似物质所抑制。PPO催化酚类物质氧化导致组织褐变已在苹果、梨、桃、葡萄、草莓、香蕉、荔枝、马铃薯、莲藕和蘑菇等许多果蔬的研究中得到证实[8]。
PPO的类型、分布、活力大小及存在状态等是影响鲜切果蔬褐变速度的关键原因之一。PPO在细胞内有两种存在形式,一种以有活性的游离态(FPPO)形式存在于细胞质中,而另一种以潜在活性的结合态(BPPO)形式结合在质体、线粒体等细胞器内膜和细胞膜上[42]。正常状态下PPO以BPPO形式存在,活性很低;当膜受伤害后,潜在的PPO可被激活,BPPO即向FPPO转化,FPPO活性显著提高,导致或/和加速酶促褐变的发生[8]。
不同果蔬种类、部位PPO的活性、催化特性和最适底物差异性较大,且并非总是和酶同时存在于同一植物中(表1)。荔枝果皮中含量最多的酚类物质是(-)-表儿茶素,组织中PPO最适宜作用底物也是(-)-表儿茶素,两者呈现一致性,因而荔枝果皮褐变的速度快[39];莲藕和溧阳白芹中主要的酚类物质均为儿茶酚,但两者最适宜作用底物却不同,前者为儿茶酚,后者为绿原酸,使两者褐变特性发生差异[38,41]。由此可见,果蔬中PPO存在状态、活力大小、催化特性和最适底物的不同是造成果蔬褐变特性差异的重要原因。
1.6.2.2 POD
POD在有H2O2存在时,可催化酚类、类黄酮等物质的氧化和聚合,参与酚类物质代谢,导致组织褐变。和PPO一样,不同果蔬POD的催化特性和最适底物存在差异(表1)。近年来,POD参与鲜切果蔬酶促褐变的研究越来越受到重视。研究表明,POD是造成鲜切茭白褐变的主要酶[16]。此外,POD会造成果蔬组织中谷胱甘肽和抗坏血酸的氧化、膜脂过氧化,促进果实系统乙烯的合成,加速成熟衰老,因而POD可作为鲜切果蔬成熟和衰老的一个指标[43]。
1.6.2.3 其他酶类
鲜切果蔬酶促褐变可能还与PAL和APX等密切相关。PAL是催化苯丙烷类代谢第一步反应的酶,也是苯丙烷类代谢途径关键酶和限速酶。机械伤害可诱导PAL活化,进而酚类物质积累,加速褐变反应进程。李正国等[44]研究表明,在不同褐变程度的奉节脐橙果实果皮中,PAL活力随着果皮褐变程度增加而增加,同时分子水平检测结果发现,果皮一旦发生褐变,PAL2基因的表达即迅速增强。APX也被认为与果蔬的褐变有关。鸭梨果心发生褐变时APX活力达到最高点,而PPO活力则变化不大[38]。
1.7 鲜切果蔬的木质化
木质素是一种具芳香族特性的三维高分子化合物。作为地球上含量仅次于纤维素的天然有机物,木质素具有重要的生理功能,是植物从水生进化到陆生的物质基础。木质素填充于纤维素构架中赋予了细胞壁坚硬的结构特征,增加了植物体的刚性;其疏水性使植物细胞壁具有不透水性,保证了植物体内的长距离运输;同时,木质素亦加强了植物对生物与非生物逆境的防御能力[45]。
机械损伤等外界环境胁迫因子能诱导果蔬组织在伤害部位细胞的胞壁中大量产生和沉积木栓质或/和木质素[6-7]。然而,木质素的过量合成会使细胞壁增厚,从而导致木质化,影响鲜切果蔬质地和品质。研究表明,木质化是导致枇杷果实、竹笋、绿芦笋及胡萝卜等品质劣变的直接原因[22-24,46]。
2 鲜切果蔬品质劣变的其他影响因素
2.1 营养成分损失
营养成分是影响生鲜果蔬品质好坏的决定性因素,是果蔬感官性状得以维持的物质基础。鲜切果蔬由于破坏了细胞的完整性,营养物质直接流出损失(尤其是水溶性和易氧化的成分);另一方面,鲜切果蔬仍是生命活体,在贮藏过程中必然发生内部营养成分的分解和变化,进而引起果蔬色、香、味和营养价值的降低,超过一定极限,果蔬就会衰老甚至腐烂而丧失商品价值。切割韭菜在10℃贮藏7d,其干物质、可溶性固形物、抗坏血酸及总可溶性酚含量分别下降了13.8%、19.1%、38.5%及29.5%,感官品质也急剧下降[47]。鲜切大头菜在5℃贮藏14d,感官评分从8.7降到3.8,失去商品价值[48]。鲜切生菜在4℃贮藏9d,抗坏血酸含量损失80.3%[49]。
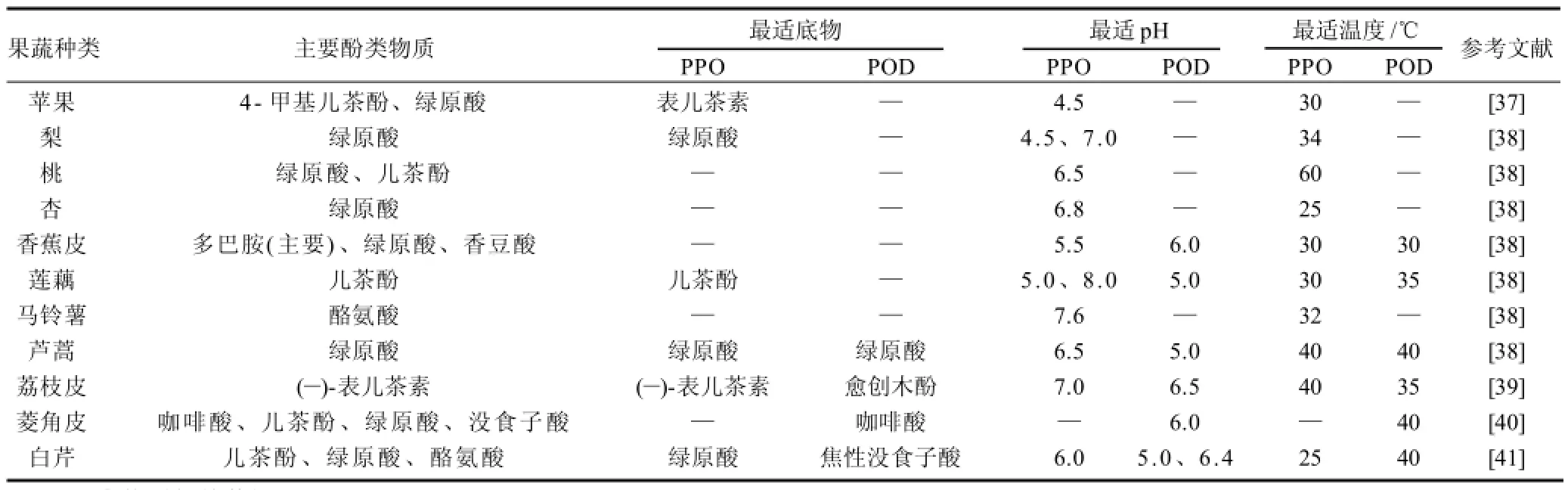
表1 不同鲜切果蔬中主要酚类物质及其PPO和POD的最适作用底物、pH值和温度Table 1 Major phenols and optimal substrate, temperature and pH of PPO and POD from different fruits and vegetables
2.2 微生物污染
鲜切果蔬从原料、加工、包装、贮藏、运输到销售等各个环节,常常与环境发生各种方式的接触,因而极易受到外界微生物的污染而导致腐败变质,其主要原因有以下几个方面:1)鲜切果蔬经过加工后细胞组织结构受到破坏,造成大量的机械损伤,表面积成倍增加,营养物质外溢,给微生物的侵染、生长和繁殖提供了有利条件;2)切分造成果蔬原有保护系统破坏,自然抵抗能力下降,更多种类和数量的微生物侵染机会增加;3)大多数果蔬属碱性食品且含水量较高,给微生物提供了理想的生长环境。研究表明,鲜切甜瓜于5℃条件下贮藏10d后,微生物从2.51×102CFU/g上升到108CFU/g,增加了6个数量级[6]。鲜切西红柿于5℃条件下贮藏15d微生物达到了8.13×106CFU/g[15]。微生物的迅速繁殖不仅缩短了鲜切果蔬的货架寿命,而且在很大程度上影响产品的安全性。引起鲜切果蔬品质劣变的常见微生物见表2、3。
3 鲜切果蔬品质劣变的可能机理
综上所述,鲜切果蔬加工过程中造成细胞膜破坏,营养成分流失,给微生物污染和繁殖创造了良好的条件;切分增大了果蔬表面积,加速了蒸腾作用和水分损失;切分产生的伤信号使各种生理生化反应加剧,伤乙烯大量产生,呼吸速率显著提高,次生代谢产物和自由基积累,最终影响到产品的香气、风味、质地、外观及营养品质。鲜切果蔬品质劣变的可能机理概括如图1所示。

表2 引起鲜切蔬菜品质劣变的常见微生物[8]Table 2 Common microorganisms causing quality deterioration of fresh-cut vegetables[8]

表3 引起鲜切水果品质劣变的常见微生物[8]Table 3 Common microorganisms causing quality deterioration of fresh-cut fruits[8]

图1 鲜切果蔬品质劣变的可能机理Fig.1 Possible mechanisms underlying quality deterioration in freshcut fruits and vegetables
4 结 语
目前,鲜切果蔬品质劣变影响因素已有多方面的研究,在其品质劣变机理方面的研究也已取得了不少进展,但是关于伤信号分子及其信号转导机制还尚未明确,一些可能的机理还有待进一步的实验证实,相信随着采后生物学研究的深入,鲜切果蔬品质劣变机理将被进一步揭示,从而为鲜切果蔬贮运保鲜新方法的建立奠定理论基础。
[3]CHOI Y J, TOMAS-BARBERAN F A, SALTVEIT M E, et al. Woundinduced phenolic accumulation and browning in lettuce (Lactuca sativa L.) leaf tissue is reduced by exposure to n-alcohols[J]. Postharvest Biology and Technology, 2005, 37(1): 47-55.
[5]VILLALOBOS-CARVAJAL R, HERNADEZ-P, ALBORS A, et al. Barrier and optical properties of edible hydroxypropyl methylcellulose coatings containing surfactants applied to fresh cut carrot slices[J]. Food Hydrocolloids, 2009, 23(2): 526-535.
[6]FE,RNANDEZ A, PICOUET P, LLORET E. Cellulose-silver nanoparticle hybrid materials to control spoilage-related microflora in absorbent pads located in trays of fresh-cut melon[J]. International Journal of Food Microbiology, 2010, 142(1/2): 222-228.
[7]RHODES J D, THAIN J F, WILDON D C. Evidence for physically distinct systemic signaling pathways in the wounded tomato plant[J]. Annals of Botany, 1999, 84(1): 109-116.
[8]胡文忠. 鲜切果蔬科学与技术[M]. 北京: 化学工业出版社, 2009.
[9]LEONARDIA C, GUICHARD S, BERTIN N. High vapour pressure deficit influences growth, transpiration and quality of tomato fruits[J]. Scientia Horticulturae, 2000, 84(3/4): 285-296.
[10]毛国红, 郭毅, 崔素娟. 伤害信号分子及其信号转导[J]. 西北植物学报, 2002, 22(6): 1504-1511.
[11]周艳超, 沈应柏. Ca2+信号在植物细胞适应逆境中的调节作用[J]. 北方园艺, 2010(3): 181-185.
[12]KATO M, KAMO T, WANG R, et al. Wound-induced ethylene synthesis in stem tissue of harvested broccoli and its effect on senescence and ethylene synthesis in broccoli florets[J]. Postharvest Biology and Technology, 2002, 24(1): 69-78.
[13]LULAI E C, SUTTLE J C. The involvement of ethylene in woundinduced suberization of potato tuber (Solanum tuberosum L.): a critical assessment[J]. Postharvest Biology and Technology, 2004, 34(1): 105-112.
[14]SALTVEIT M E. Effect of 1-methylcyclopropene on phenylpropanoid metabolism, the accumulation,phenolic compounds, and browning of whole and fresh-cut ,iceberg lettuce[J]. Postharvest Biology and Technology, 2004, 34(1): 75-80.
[15]AGUAYO E, ESCALONA V H, ARTES F. Effect of cyclic exposure to ozone gas on physicochemical, sensorial and microbial quality of whole and sliced tomatoes[J]. Postharvest Biology and Technology, 2006, 39 (2): 169-177.
[16]LUO Haibo, JIANG Li, ZHANG Li, et al. Quality changes of whole and fresh-cut Zizania latifolia during refrigerated (1℃) storage[J]. Food and Bioprocess Technology, 2012, 5(4): 1411-1415.
[17]VANDEKINDEREN I, DEVLIEGHERE F, MEULENAER B D, et al. Impact of decontamination agents and a packaging delay on the respiration rate of fresh-cut produce[J]. Postharvest Biology and Technology, 2008, 49(2): 277-282.
[18]IGUAL M, CASTELLO M L, ORTOLA M D, et al. Influence of vacuum impregnation on respiration rate, mechanical and optical properties of cut persimmon[J]. Journal of Food Engineering, 2008, 86(3): 315-323.
[19]CASTELLO M L, FITO P J, CHIRALT A. Effect of osmotic dehydration and vacuum impregnation on respiration rate of cut strawberries[J]. LWT-Food Science and Technology, 2006, 39(10): 1171-1179.
[20]田密霞, 胡文忠, 姜爱丽, 等. 海藻酸钠复合涂膜对鲜切皇冠梨软化生理的影响[J]. 食品研究与开发, 2009, 30(9): 165-168.
[21]SCHREINER M, KRUMBEIN A, MEWIS I, et al. Short-term and moderate UV-B radiation effects on secondary plant metabolism in different organs of nasturtium (Tropaeolum majus L.)[J]. Innovative Food Science and Emerging Technologies, 2009, 10(1): 93-96.
[22]CAI Chong, XU Changjie, LI Xian, et al. Accumulation of lignin in relation to change in activities of lignification enzymes in loquat fruit flesh after harvest[J]. Postharvest Biology and Technology, 2006, 40(2): 163-169.
[23]CHAUHAN O P, RAJU P S, RAVI N, et al. Effectiveness of ozone in combination with controlled atmosphere on quality characteristics including lignification of carrot sticks[J]. Journal of Food Engineering, 2011, 102(1): 43-48.
[24]LUO Zisheng, XU Xiaoling, CAI Zhenzhen, et al. Effects of ethylene and 1-methylcyclopropene (1-MCP) on lignification of postharvest bamboo shoot[J]. Food Chemistry, 2007, 105(2): 521-527.
[25]MAHAJAN P V, OLIVEIRA F A R, MACEDO I. Effect of temperature and humidity on the transpiration rate of the whole mushrooms[J]. Journal of Food Engineering, 2008, 84(2): 281-288.
[26]罗云波, 蔡同一. 园艺产品贮藏加工学(贮藏篇)[M]. 北京: 中国农业大学出版社, 2001.
[27]KARAKURT Y, HUBER D J. Activities of several membrane and cellwall hydrolases, ethylene biosynthetic enzymes, and cell wall polyuronide degradation during low-temperature storage of intact and fresh-cut papaya (Carica papaya) fruit[J]. Postharvest Biology and Technology, 2003, 28(2): 219-229.
[28]SHIBAIRO S I, UPADHYAYA, M K, TOIVONEN P M A, et al. Changes in water potential, osmotic potential, and tissue electrolyte leakage during mass loss in carrots stored under different conditions[J]. Scientia Horticulturae, 2002, 95(1/2): 13-21.
[29]LEONARDI C, GUICHARD S, BERTIN N. High vapour pressure deficit influences growth, transpiration and quality of tomato fruits[J]. Scientia Horticulturae, 2000, 84(3/4): 285-296.
[30]CHISARI M, TODARO A, BARBAGALLO R N, et al. Salinity effects on enzymatic browning and antioxidant capacity of fresh-cut baby romaine lettuce (Lactuca sativa L. cv. Duende)[J]. Food Chemistry, 2009, 119(4): 1502-1506.
[31]DEGL, INNOCENTI E, GUIDI L, PARADOSSI A, et al. Biochemical study of leaf browning in minimally processed leaves of lettuce (Lactuca sativa L. var. Acephala)[J]. Journal of Agricultural and Food Chemistry, 2005, 53(26): 9980-9984.
[32]SGARBI E, FORNASIERO R B, LINS A P, et al. Phenol metabolism is differentially affected by ozone in two cell lines from grape (Vitis vinifera L.) leaf[J]. Plant Science, 2003, 165(3): 951-957.
[33]石碧, 狄莹. 植物多酚[M]. 北京: 科学出版社, 2000.
[34]BOUDET A M. Evolution and current status of research in phenolic compounds[J]. Phytochemistry, 2007, 68(22/24): 2722-2735.
[35]LIU Liang, CAO Shaoqian, XU Yujuan, et al. Oxidation of (-)-epicatechin is a precursor of litchi pericarp enzymatic browning[J]. Food Chemistry, 2010, 118(3): 508-511.
[36]马岩松, 车芙蓉, 张平, 等. 南果梨多酚氧化酶最适作用酶促褐变底物的分析确定[J]. 食品科学, 2000, 21(1): 11-13.
[37]乜兰春, 孙建设, 辛蓓, 等. 苹果果实酶促褐变底物及多酚氧化酶活性的研究[J]. 园艺学报, 2004, 31(4): 502-504.
[38]郁志芳. 鲜切芦蒿的品质和酶促褐变机理研究[D]. 南京: 南京农业大学, 2006.
[39]SUN Jian, JIANG Yueming, WEI Xiaoyi, et al. Identification of (-)-epicatechin as the direct substrate for polyphenol oxidase isolated from litchi pericarp[J]. Food Research International, 2006, 39(8): 864-870.
[40]李妍. 菱角采后品质、生理生化和酶促褐变特性研究[D]. 南京: 南京农业大学, 2006.
[41]李延清. 溧阳白芹贮藏期间品质和生理变化及褐变特性研究[D]. 南京: 南京农业大学, 2007.
[42]MAYER A M, HAREL E. Polyphenol oxidases in plants[J]. Phytochemistry, 1979, 18(2): 193-215.
[43]TADEO F R, PRIMO-MILLO E. Peroxidase activity changes and lignin deposition during the senescence process in citrus stigmas and styles[J]. Plant Science, 1990, 68(1): 47-56.
[44]李正国, 高雪, 樊晶, 等. 奉节脐橙果实苯丙氨酸解氨酶活性及其基因表达与果皮褐变的关系[J]. 植物生理与分子生物学学报, 2006, 32 (3): 381-386.
[45]BOUDET A M. Lignins and lignification: selected issues[J]. Plant Physiology and Biochemistry, 2000, 38(1/2): 81-96.
[46]SOTHORNVIT R, KIATCHANAPAIBUL P. Quality and shelf-life of washed fresh-cut asparagus in modified atmosphere packaging[J]. LWTFood Science and Technology, 2009, 42(9): 1484-1490.
[47]TSOUVALTZIS P, GERASOPOULOS D, SIOMOS A S, et al. Effects of base removal and heat treatment on visual and nutritional quality of minimally processed leeks[J]. Postharvest Biology and Technology, 2007, 43(1): 158-164.
[48]ESCALONA V H, AGUAYO E, ARTES F. Metabolic activity and quality changes of whole and fresh-cut kohlrabi (Brassica oleracea L. gongylodes group) stored under controlled atmospheres[J]. Postharvest Biology and Technology, 2006, 41(2): 181-190.
[49]ZHANG Likui, LU Zhaoxin, LU Fengxia, et al. Effect of γ irradiation on quality-maintaining of fresh-cut lettuce[J]. Food Control, 2006, 17 (3): 225-228.
Affecting Factors and Possible Mechanisms of Quality Deterioration in Fresh-cut Fruits and Vegetables
LUO Hai-bo1,2,HE Xiong1,BAO Yong-hua3,DAI Yun-yun2,YU Zhi-fang2,*
(1. Department of Biology and Food, Zhejiang Pharmaceutical College, Ningbo 315100, China;2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;3. Department of Applied Engineering, Zhejiang Economic and Trade Polytechnic, Hangzhou 310018, China)
Fresh-cut fruits and vegetables are products that is freshly cut, washed, packaged and maintained in fresh state through refrigeration. Rapid quality deterioration during storage is the major problem affecting the shelf life of fresh-cut fruits and vegetables. In this paper, the factors accelerating quality deterioration are comprehensively reviewed. Meanwhile, the possible mechanisms underlying quality deterioration of fresh-cut fruits and vegetables are also discussed with the aim of providing a theoretical basis for the development and application of new preservative techniques in fresh-cut products.
fresh-cut fruits and vegetables;quality deterioration;physiological and biochemical;mechanisms
TS255
A
1002-6630(2012)15-0324-07
2011-07-10
罗海波(1979—),男,讲师,博士,研究方向为果蔬采后生物学与处理技术。E-mail:luohaibo_1216@126.com
*通信作者:郁志芳(1960—),男,教授,博士,研究方向为果蔬采后生物学与贮藏加工。E-mail:yuzhi88@yahoo.com.cn
