韭菜过氧化物酶的分离纯化及性质
2012-06-01敬海明成丽丽刘玉杰唐云明
敬海明,邓 玉,成丽丽,赵 芯,刘玉杰,唐云明
韭菜过氧化物酶的分离纯化及性质
敬海明,邓 玉,成丽丽,赵 芯,刘玉杰,唐云明*
(西南大学生命科学学院,重庆市甘薯工程研究中心,三峡库区生态环境教育部重点实验室,重庆 400715)
经匀浆、抽提、硫酸铵分级沉淀、CM-Sepharose 离子交换层析、Superdex-200凝胶过滤层析,获得电泳纯的韭菜过氧化物酶(POD)。该酶比活力达到14031.41U/mg,纯化倍数为102.96,回收率为10.85%。该酶分子质量约为28.4kD,最适温度40℃、最适pH值为4.6。该酶在20~40℃以及pH 4.0~8.0有较好的稳定性,在最适条件下测得其Km值为18.15mmol/L。低浓度草酸、Zn2+、Mg2+等对该酶有较强激活作用;甲醇、乙醇、异丙醇、SDS、抗坏血酸(AsA)以及Mn2+、Fe3+等对该酶有较强的抑制作用。
韭菜;过氧化物酶;分离纯化;性质
过氧化物酶(peroxidase,POD)是一类以血红素为辅基的氧化酶,在生物界中广泛存在,主要催化H2O2和有机过氧化物对多种有机物和无机物的氧化作用[1]。作为一种抗氧化剂,参与了细胞木质化,生长激素的氧化,次生物质代谢、植物防卫反应等多种生理过程[2-4],该酶现已广泛的应用于环保、食品工业、医学诊断、生物传感器等行业[5-8]。目前,该酶主要来源于辣根中,且国内该酶大部分来源靠进口,因此寻找低成本来源的POD尤为重要。
韭菜(A. tuberosum Rott, ex Spr.)属百合科多年草本植物,来源广泛,四季均可取材,且又含有挥发油及硫化物,具有良好的药用价值。故本实验主要从韭菜中分离纯化POD并研究其部分酶学性质,以期为该酶的来源及进一步研究和韭菜的综合开发利用提供科学参考。
1 材料与方法
1.1 材料与试剂
韭菜购自重庆市北碚区天生丽街永辉超市。
CM-Sepharose、Superdex-200、凝胶过滤层析分子质量标准品、蛋白质SDS-PAGE标准品 美国GE公司;丙烯酰胺和甲叉-双丙烯酰胺 瑞士Fluka公司;其余试剂都为国产分析纯。
1.2 仪器与设备
GL-21M高速冷冻离心机 湖南湘仪仪器有限公司;UV-2550型分光光度计 日本岛津公司;AKTA primeplus蛋白质纯化系统 美国GE公司;冷冻干燥仪 德国Uni Equip公司;垂直板电泳槽、电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 粗酶液的提取
新鲜韭菜,用双蒸水清洗,擦干,称质量后剪碎,按1:2(m/V)的比例加入预冷的0.05mol/L pH7.2的磷酸盐缓冲液,匀浆后4℃条件下静置抽提2h;然后在4℃条件下10000r/min离心30min,取上清液;加入硫酸铵至35%饱和度,4℃静置2h后,10000r/min离心20min,收集上清液;再加入硫酸铵至70%饱和度,4℃盐析2h,10000r/min离心20min,取沉淀,用提取缓冲液将其全部溶解,在4℃条件下透析即得粗酶液[9]。
1.3.2 CM-Sepharose层析
经0.05mol/L磷酸缓冲液(pH6.0)平衡层析柱后,上样粗酶液10mL,用0~1mol/L的NaCl溶液(含0.05mol/L、pH6.0的磷酸缓冲液)进行线性梯度洗脱,流速0.5mL/min,每管收集5mL;测定各管酶活性和蛋白含量,收集活性较高的酶液,透析脱盐,冷冻干燥后进行凝胶过滤。
1.3.3 Superdex-200层析
取上述酶液3mL上样于Superdex-200层析柱,用提取缓冲液洗脱,流速0.3mL/min,每管收集3mL;测定每管酶活性和蛋白含量;收集活性较高的酶液,透析脱盐冷冻干燥后,于-20℃冰箱保存备用。
1.3.4 POD纯度鉴定以及分子质量测定[10]
采用SDS-聚丙烯酰胺凝胶电泳进行纯度鉴定,12%分离胶、5%浓缩胶,加样量10μL。经SDS-PAGE和凝胶过滤层析测定其分子质量。
1.3.5 蛋白质含量的测定
采用紫外分光光度法和Bradford法(考马斯亮蓝染料法)测定[11]。
1.3.6 POD活性的测定
按照陈贻竹等[12]的方法进行。测定体系为3mL,其中含2.775mL 0.05mol/L 磷酸盐缓冲液(pH7.0)、0.1mL 1% H2O2、0.1mL 4% 愈创木酚。加入0.025mL 酶液后开始反应,在25℃条件下记录470nm波长处2min内光密度(OD)值的变化值。一个酶活力单位(U)定义为:在测定条件下每分钟引起OD值改变0.01所需的酶量。
1.3.7 POD性质的研究[9,13]
1.3.7.1 POD最适温度和最适pH值
分别在不同温度(20~70℃)和不同pH值(2.2、3.0、4.0、4.6、5.0、5.6、6.0、7.0、8.0)的条件下测定酶活力。二者均以最适条件下测得的酶活力作为100%,其余各条件下测得的酶活力分别与之相比即得相对酶活力。1.3.7.2POD热稳定性和pH值稳定性
分别将酶液放置在不同温度(20~60℃)和不同pH值(2.2、3.0、4.0、5.0、6.0、7.0、8.0)条件下,每隔1h测定该酶液的活力。温度稳定性以25℃的酶活力为100%,pH值稳定性以pH 7.0 的酶活力为100%,其余温度和pH值条件下测得的酶活力分别与之相比即得相对酶活力。
1.3.7.3 米氏常数(Km)的测定
在最适温度和最适pH值条件下,以不同浓度的H2O2(0.01、0.02、0.03、0.04、0.05mol/L)为底物,测定POD的活力,采用双倒数作图法(Lineweaver-Burk法)[10]求出该酶的Km值。
1.3.7.4 不同有机溶剂对POD活性的影响
分别将甲醇、乙醇、异丙醇这3种有机溶剂与缓冲液和酶液混合,混合后体积分数分别为10%、20%、30%、40%、50%,在25℃条件下作用30min,再测定POD活力,以不加有机溶剂时的酶活力为100%。
1.3.7.5 不同化合物对POD活性的影响
分别将NaCl、AsA、SDS、KSCN、尿素、草酸配成100mmol/L母液,再按一定比例分别与缓冲液和酶液混合,混合后终浓度分别为0.01、0.02、0.03、0.04、0.05mol/L,在25℃条件下作用30min,再测定POD活性,以不加化合物时的酶活力为100%。
1.3.7.6 不同金属离子对POD活性的影响
分别将各种金属离子配成100mmol/L母液,再按一定比例分别与缓冲液和酶液混合,混合后终浓度分别为0.01、0.02、0.03、0.04、0.05mol/L,在25℃条件下作用30min,再测定POD活力,以不加金属离子时的酶活力为100%。
2 结果与分析
2.1 韭菜POD的分离纯化
粗酶液经CM-Sepharose层析后,所得的结果如图1所示,表明杂蛋白和POD达到了较好的分离效果,收集活性峰,透析冷冻干燥后经Superdex-200层析,结果如图2所示。酶的整个分离纯化结果如表1所示,该酶的回收率较低,还需优化实验条件进一步提高其纯度。
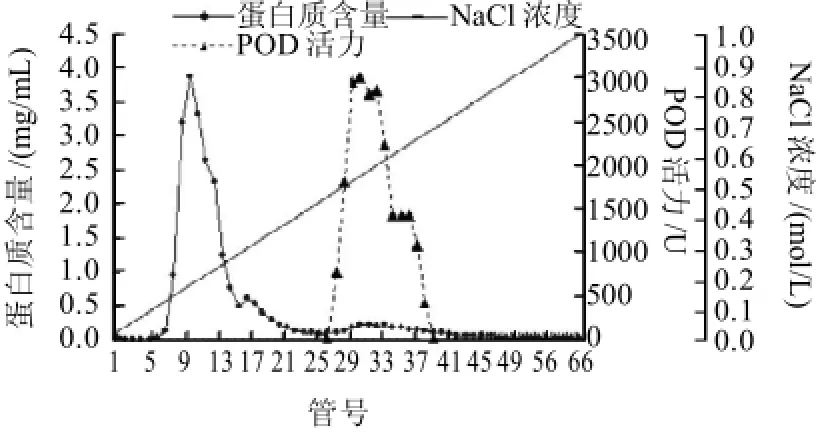
图1 韭菜POD的CM-Sepharose离子交换层析Fig.1 Elution profile of POD from Chinese chives on CM-Sepharose column

图2 韭菜POD的Superdex-200凝胶过滤层析Fig.2 Elution profile of POD from Chinese chives on Superdex-200 column

表1 韭菜过氧化物酶的纯化Table 1 Summary of separation and purification of POD from Chinese chives
2.2 韭菜POD分子质量
收集图2活性峰,透析冷冻干燥后样品经SDSPAGE,显示为单一条带(图3),说明该POD样品已达到电泳纯。测得其亚基相对分子质量约为28.4kD;通过Superdex-200凝胶过滤层析测得的全酶相对分子质量约为29kD,由此基本上可断定韭菜POD是由单一亚基组成,与大多数文献报道相符[9,14-20]。

图3 韭菜POD的SDS-PAGE电泳图谱Fig.3 SDS-PAGE of purified POD from Chinese chives
2.3 韭菜POD的部分理化性质研究
2.3.1 韭菜POD最适温度和热稳定性
由图4可知,韭菜POD的最适反应温度为40℃。由图5可知,在20~40℃韭菜POD有较好的热稳定性,保温5h后剩余活力仍有轻微的激活作用,但在温度超过50℃保温1h后,酶活力丧失达60%以上,此后变化不大。
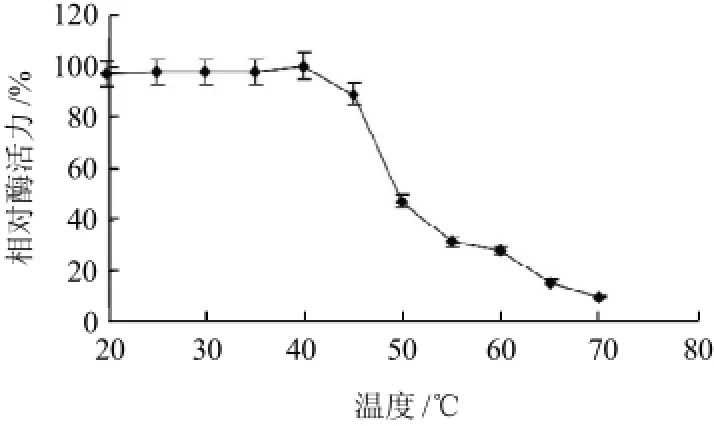
图4 温度对韭菜POD活力的影响Fig.4 Effect of temperature on the activity of POD from Chinese chives
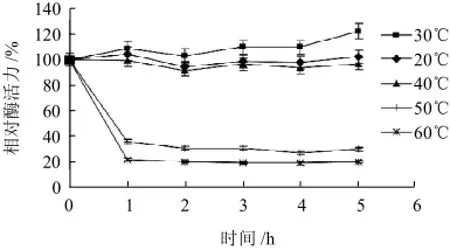
图5 韭菜POD的热稳定性Fig.5 Thermal stability of POD from Chinese chives
2.3.2 韭菜POD最适pH值和pH值稳定性
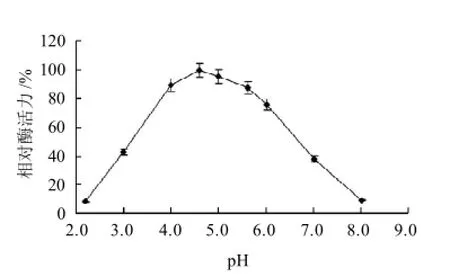
图6 pH值对韭菜POD活力的影响Fig.6 Effect of pH on the activity of POD from Chinese chives

图7 韭菜POD的pH值稳定性Fig.7 pH stability of POD from Chinese chives
由图6可知,韭菜POD的最适反应pH值为4.6。由图7可知,在pH4.0~8.0的环境下,稳定性较好,但pH值低于3.0及以下,放置1h后酶活力会丧失50%以上,随后变化趋势逐渐减缓。
2.3.3 韭菜POD米氏常数的测定
采用双倒数作图法(图8),在最适作用条件下,用韭菜POD催化不同浓度(0.01~0.05mol/L)的H2O2与愈创木酚反应,测定POD活力,从而求得该酶的Km值为18.15mmol/L。

图8 双倒数法测韭菜POD的米氏常数Fig.8 Lineweaver-Burk plot for Km determination of POD from Chinese chives
2.3.4 不同有机溶剂对韭菜POD活性的影响

图9 甲醇、乙醇、异丙醇对韭菜POD活力的影响Fig.9 Effects of methanol, ethanol and isopropyl alcohol on the activity of POD from Chinese chives
由图9可知,甲醇、乙醇、异丙醇3种有机溶剂均对该酶有较强的抑制作用,随着有机溶剂体积分数的增大,抑制作用越明显,当体积分数达到30%时,甲醇抑制了该酶70%以上的活性,乙醇及异丙醇基本上完全抑制了该酶活性。
2.3.5 不同化合物对韭菜POD活性的影响
由图10可知,不同化合物以及同一化合物的不同浓度对韭菜POD活性的影响存在着较大的差异。草酸对该酶的作用具有两重性:低浓度时有明显激活作用,但浓度超过0.01mol/L,则会明显抑制相对酶活力,达到0.03mol/L时相对酶活力则完全被抑制;尿素、KSCN对该酶活力有轻微的抑制作用;而SDS、AsA对该酶活力具有很强的抑制作用,在0.01mol/L的AsA浓度下就可以完全抑制该酶活力。

图10 不同化合物对韭菜POD活力的影响Fig.10 Effects of various compounds on the activity of POD from Chinese chives
2.3.6 不同金属离子对韭菜POD活性的影响

图11 不同金属离子对韭菜POD活力的影响Fig.11 Effect of metal ions on activity of POD from Chinese chives
由图11可知,Zn2+、Mg2+对该酶有很强的激活作用,说明这两种离子有可能促进了该酶空间构象的改变,从而提高了酶的催化活性;Ba2+、Ca2+、K+、Li+对该酶有轻微的激活作用;而Mn2+、Fe3+对该酶有明显的抑制作用,在0.02mol/L的Fe3+浓度条件下就可以完全抑制酶活力。
3 讨 论
本实验通过一系列方式获得的电泳纯韭菜过氧化物酶,与其他材料来源的POD相比有以下特点:首先,取材方便,一年四季均可,价格相对又便宜;其次,使纯化步骤简便化,但仍获得了较高的比活力,纯化倍数和回收率。韭菜POD在20~40℃有较好的热稳定性,5h以内温度对酶活力还有轻微的激活作用,最适反应温度为40℃;pH值耐受范围较广,在pH4.0~8.0的环境下,5h以内酶活变化不大,最适pH4.6。该酶的分子质量约为28.4kD,Km值为18.15mmol/L,这些理化性质与其他来源的POD差异比较如表2所示。说明不同种属间的过氧化物酶在性质上是有差异的,且这又与它们所处的生物体环境相适应。

表2 不同来源的POD理化性质间的比较Table 2 Physicochemical properties of POD of different origins
不同有机溶剂、化合物、金属离子对POD活性均有一定影响,这是由POD的结构特点决定的,Halpin等[21]研究表明,铁离子是POD活性中心的必需成分,即POD是一种由单一肽链与卟啉构成的血红素蛋白, 脱辅基蛋白分子必须与血红素结合才构成全酶[4]。当随着有机溶剂体积分数增大,酶活性越来越低,主要是因为酶在水溶液中,空间构象的稳定由氢键、疏水键、范德华力等维持,在酶分子表面形成了一个极性水化层,但有机溶剂的加入却破坏了该水化层,使溶液的极性降低了,从而导致了维持酶构象的次级键遭到破坏,引起空间构象的改变,让酶活性中心的微环境变化导致酶活性的丧失。有机化合物草酸对该酶具有双重性,原因可能是:在低浓度条件下,草酸的加入让酶的构象发生了一定改变,降低了酶活性,但这也使更多的该酶活性中心暴露了,从而使酶的结合部更加有利于结合底物,且后者的影响程度超过了前者,从而在整体上来说该酶的活性增高了,但在高浓度条件下,它又表现出了类似有机溶剂的特性,使该酶的空间构象遭到了更大的破坏,从而不能维持酶活性中心的存在,进而引起酶活性的完全丧失,SDS、AsA对该酶活性有明显的抑制作用,其中SDS是一种变性剂,能够破坏蛋白质分子中的疏水键和氢键,进而改变酶的空间构象,导致酶活性降低,AsA会破坏含铁血红素亚基,从而破坏该酶构成的完整性,引发酶失活,KSCN对该酶活性没有明显的影响,而甘薯叶[9]实验中KSCN对其活性有明显的作用;金属离子Mn2+、Fe3+对该酶有明显的抑制作用,Ca2+对该酶作用不明显,而在甘薯叶[9]实验中Ca2+活性对其活性有明显抑制作用。
[1]DUNFORD H B, STILLMAN J S. On the function and mechanism of peroxidase[J]. Coord Chem Rev, 1976, 19: 187-251.
[2]ROS B A. Lignification in plant cell walls[J]. Int Rev Cytol, 1997, 176: 87-132.
[3]PASSARDI F, PENEL C, DUNAND C. Performing the paradoxical: how plant peroxidases modify the cell wall[J]. Tren Plant Sci, 2004, 9: 534-540.
[4]田国中, 李怀方, 裘维番. 植物过氧化物酶研究进展[J]. 武汉植物学研究, 2001, 19(4): 332-344.
[5]杨暖, 张妙直, 宋洪英, 等. 木素过氧化物酶应用研究进展[J]. 现代农业科学, 2009, 16(4): 19-20.
[6]La ROTTA C E, BON E P. 4-Chlorophenol degradation by chloroperoxidase from Caldariomyces fumago: formation of insoluble products[J]. Applied Biochemistry and Biotechnology, 2002, 98(3): 191-204.
[7]GUILBAUT G G. Handbook of enzymatic methods of analysis[M]. New York and Basel: Marceldekker Inc, 1976.
[8]钟薇, 秦培勇, 刘长霞, 等. 辣根过氧化物酶修饰电极的电化学研究[J]. 北京化工大学学报: 自然科学版, 2009, 36(2): 18-22.
[9]付伟丽, 唐靓婷, 王松, 等. 甘薯叶过氧化物酶的分离纯化及其部分性质研究[J]. 食品科学, 2010, 31(7): 223-227.
[10]张龙翔, 张庭芳, 李令媛. 生化实验方法和技术[M]. 2版. 北京: 高等教育出版社, 1997: 100-106; 116-124; 144-152.
[11]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[12]陈贻竹, 王以柔. 荔枝果实过氧化物酶(POD)的研究[J]. 中国科学院华南植物研究所集刊, 1989 (5): 47-52.
[13]王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 北京: 高等教育出版社, 2002: 378-380.
[14]王瑧, 廖祥儒, 张建国, 等. 女贞果实过氧化物酶的纯化及热稳定性研究[J]. 河北农业大学学报, 2007, 30(5): 23-27.
[15]徐淑霞, 张跃灵, 张世敏, 等. 黄孢原毛平革菌过氧化物酶的分离、纯化和酶学特性研究[J]. 农业环境科学学报, 2007, 26(1): 295-300.
[16]阙瑞琦, 张丽丽, 郭小路, 等. 莲藕过氧化物酶的分离纯化及性质研究[J]. 西南大学学报: 自然科学版, 2007, 29(12): 63-67.
[17]庞学群, 段学武, 张昭其, 等. 荔枝果皮过氧化物酶的纯化及部分酶学性质的研究[J]. 热带亚热带植物学报, 2004, 12(5): 449-454.
[18]刘稳, 方靖, 高培基. 豆壳过氧化物酶的分离纯化及其性质研究[J].中国生物化学与分子生物学报, 1998, 14(5): 577-582.
[19]卢蓉蓉, 许时婴, 王璋. 乳过氧化物酶的分离纯化和酶学性质研究[J]. 食品科学, 2006, 27(2): 100-104.
[20]林建城, 吴智雄, 彭在勤. 枇杷果肉过氧化物酶的分离纯化及其性质研究[J]. 四川农业大学学报, 2007, 25(4): 419-424.
[21]HALPIN B, PRESSEY R, JEN J, et al. Purification and characterization of peroxidase isoenzymes from green peas (Pisum sativum)[J]. J Food Sci, 1989, 54: 644-649.
Isolation, Purification and Characterization of Peroxidase from Chinese Chives
JING Hai-ming,DENG Yu,CHENG Li-li,ZHAO Xin,LIU Yu-jie,TANG Yun-ming*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Chongqing Sweet-potato Engineering Research Center, School of Life Science, Southwest University, Chongqing 400715, China)
Electrophoresis-pure peroxidase (POD) from Chinese chives was obtained after sample homogenization, extraction, ammonium sulfate precipitation, CM-Sepharose chromatography and Superdex-200 gel filtration. The purified POD had an activity of 14031.41U/mg. The purification factor was 102.96 and the recovery rate was 10.85% . The molecular weight of this enzyme was 28.4 kD, the optimum temperature and pH were 40 ℃ and 4.6, respectively. The POD enzyme was stable under 20-40℃ and pH 4-8. The Kmof this enzyme was determined to be 18.15 mmol/L under optimum conditions. Its activity could be strongly activated by low concentrations of oxalic acid, Zn2+and Mg2+, but inhibited by methanol, ethanol, isopropanol, SDS, ascorbic acid, Mn2+and Fe3+.
Chinese chives;peroxidase;isolation and purification;characterization
Q554.6
A
1002-6630(2012)15-0226-05
2011-07-28
重庆市科委重点攻关项目(CSTC2011AB1027)
敬海明(1986—),男,硕士研究生,主要从事蛋白质与酶工程研究。E-mail:jinghming@163.com
*通信作者:唐云明(1960—),男,教授,博士,主要从事蛋白质与酶工程研究。E-mail:tbright@swu.edu.cn
