鸡胸软骨酶解产物的表征及对类风湿关节炎大鼠的免疫调节作用
2012-06-01张忠慧许时婴
曹 慧,张忠慧,许时婴
(1.上海理工大学医疗器械与食品学院,上海 200093;2. 爱普香料集团股份有限公司,上海 201809;3. 江南大学食品学院,江苏 无锡 214036 )
鸡胸软骨酶解产物的表征及对类风湿关节炎大鼠的免疫调节作用
曹 慧1,张忠慧2,许时婴3
(1.上海理工大学医疗器械与食品学院,上海 200093;2. 爱普香料集团股份有限公司,上海 201809;3. 江南大学食品学院,江苏 无锡 214036 )
目的:探讨鸡软骨酶解产物的理化性质及对类风湿性关节炎(RA)大鼠的免疫调节作用。方法:采用胃蛋白酶水解鸡胸软骨,研究软骨酶解产物的组成及理化性质,并建立大鼠类风湿性关节炎模型,探讨软骨酶解产物对大鼠类风湿性关节炎的免疫调节作用。结果:鸡胸软骨酶解产物的主要成分为Ⅱ型胶原,变性温度为43.843℃,在pH值大于5.8,NaCl浓度大于0.9mol/L时,溶解度较低。口服鸡胸软骨酶解产物显著抑制了RA大鼠的足掌肿胀,并降低了其血清抗Ⅱ型胶原(CII)抗体及滑膜炎性细胞因子的水平。结论:鸡胸软骨酶解产物可能通过调节Th1细胞因子的表达、纠正失衡的Th1/Th2细胞因子网络及降低血清特异性抗CII抗体的水平对RA产生防治作用。
鸡胸软骨酶解产物;类风湿性关节炎;免疫调节功能;细胞因子
类风湿性关节炎(rheumatoid arthritis, RA)是临床常见的多发病,是一种以关节滑膜炎为特征的慢性全身性自身免疫性疾病[1],发病率约占我国人口的0.35%~0.4%。目前对类风湿性关节炎尚没有一个较好的治疗方法,早期对关节行滑膜切除可以有效地延缓病变的发展过程,但如果病变已经到了晚期,关节软骨完全破坏,则除了行关节置换,别无其他选择[2],因此,如何通过改善机体的免疫功能达到预防RA的目的已经成为全社会共同关注的焦点。
国外对RA发病机制及防治的研究已经深入到分子和基因水平,他们认为 RA的发生很可能是由于机体内的T细胞因子引起关节组织内部对特异性隐蔽抗原进行的自身免疫反应,而II型胶原是其主要的免疫原,因此通过口服未变性的II型胶原诱导免疫耐受可有效防治RA[3-4]。软骨是畜禽加工的副产物,目前主要应用于食品与饲料工业中,研究表明,鸡胸软骨中II型胶原的含量高达50%以上,但主要是以不可溶的原胶原形式存在[5],因而本研究拟采用胃蛋白酶对鸡胸软骨进行水解,使其变为可溶性II型胶原,并对水解产物的理化性质及抗RA机制进行初步研究。
1 材料与方法
1.1 实验动物、材料与试剂
实验用清洁级SD 大鼠共40只,雄性,2~3月龄,体质量为220~250g,购于上海斯莱克实验动物有限责任公司。实验大鼠按清洁级饲养,温度恒定于(25±0.5)℃。实验过程中大鼠自由摄食及水,采用标准饲料喂养。
鸡胸软骨 内蒙古草原兴发集团;胃蛋白酶、II型胶原标准品、脂多糖、完全弗氏佐剂 美国Sigma公司;II型胶原酶 美国Gibco公司; 兔抗小鼠IgG 抗体 美国Novus公司;小牛血清 上海华美公司;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、γ干扰素(interferon-γ,INF-γ)及白介素113(Interleukin-1β,IL-1β)试剂盒 南京建成生物有限公司;其余试剂均为分析纯,购自于上海国药集团。
1.2 仪器与设备
细胞培养箱 德国Hereus公司;多功能酶标仪 瑞士Tecan公司;CF7D2高速离心机 日本日立公司;Pyris差示扫描量热仪 Perkin Elmer 公司;CL20-B型冷冻离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 鸡胸软骨超微结构的测定
将新鲜鸡胸软骨切成小块,再按常规方法进行固定、脱水、包埋、切片(厚度约为2μm)及染色,采用JEM-2000EX透射电镜观察(加速电压为10kV)。
1.3.2 鸡胸软骨酶解产物制备流程及化学组成分析
商品鸡胸软骨→清洗→剔除肌肉、腱、骨膜等非软骨物质→冷冻粉碎→甲醇-氯仿(体积比2:1)脱脂→1g/100mL胃蛋白酶20℃酶解36h→ 3mol/L氯化钠盐析24h→10000r/min离心后取上清冷冻干燥→软骨酶解产物
鸡胸软骨酶解产物中羟脯氨酸及II型胶原的测定按照Woessner法[6]进行,糖胺聚糖的测定按照1,9-二甲基亚甲蓝法[7]进行,粗脂肪及灰分的测定分别按照国标GB/T 14772—2008《食品中粗脂肪的测定》和GB 5009.4—2010《食品中灰分的测定》进行。
1.3.3 鸡胸软骨酶解产物变性温度的测定
鸡胸软骨切片至2mm×3mm大小,厚为0.5mm的薄块,与已制备的软骨酶解产物浸于pH7.4的溶液中,并在4℃平衡48h,取出吸干表面水分,置于差示扫描量热仪(DSC)样品容器中密封。温度扫描范围25~80℃,升温速度:8℃/min。
1.3.4 鸡胸软骨酶解产物溶解度的测定
将30mg鸡胸软骨酶解产物样品分散于0.5mol/L的醋酸溶液中,采用0.1mol/L的HCl或NaOH调节pH(1.5~9.5),并定容至10mL,缓慢搅拌1h后,以10000r/min离心15min,测定样品上清液中胶原蛋白的含量。酶解产物溶解度的计算见式(1)。

溶解度与所测样品中最高溶解度之比即为相对溶解率。
将软骨酶解产物分散于0.5mol/L的醋酸溶液(pH2.5)中,分别添加不同量的NaCl,使NaCl的终浓度分别为0.1、0.2、0.4、0.6、0.8、1.0、1.5、2mol/L,再按以上方法测定软骨酶解产物的溶解度。相对溶解率的计算方法同上。
1.3.5 大鼠类风湿性关节炎模型的建立
类风湿性关节炎模型的制作采用经典方法[8]:将II型胶原标准品溶于0.05mol/L的醋酸中,与等量完全弗氏佐剂混和,混和后II型胶原的终质量浓度为2mg/mL,将混合物充分乳化,以200μg/只的剂量,注射于大鼠左后足跖部,作为初次致敏。两周后,以100μg/只的剂量进行尾根部散点注射增强免疫[9]。致敏后大鼠随机分成4组,每组8只。于初次致敏同时经灌胃针灌注给予大鼠相应实验品,每2d一次,共40d。具体分组为:正常组(未致敏大鼠)、致敏组、剂量组(6、60、600μg/(kg·d))。
1.3.6 鸡胸软骨酶解产物对大鼠脚掌厚度的影响
于致炎前采用游标卡尺测量各组大鼠脚掌厚度,并分别于初次致敏后第1、7、14、21、28天同法测量各组大鼠脚掌厚度。
1.3.7 鸡胸软骨酶解产物对大鼠血清抗CII抗体水平的影响
初次致敏后第35天,从大鼠尾部采血,分离血清,ˉ20℃存储。以ELISA法检测血清中抗CII抗体的水平。
1.3.8 鸡胸软骨酶解产物对大鼠滑膜细胞炎性因子分泌的影响
初次致敏后第40天,乙醚麻醉处死各组大鼠,无菌取下关节滑膜组织,用无Ca2+、Mg2+的Hank液反复冲洗,剪成小块,移入含有10g/100mL小牛血清的RPMI1640培养液和0.4g/100mLⅡ型胶原酶(二者体积比为1:1)的培养瓶中,于37℃、5% CO2培养箱中消化6h,1000r/min离心5min后弃上清液,再加入适量0.25g/100mL胰蛋白酶消化30min,200目尼龙网过滤,去除结缔组织,洗涤、离心、镜下计数,调细胞悬液10×106个/L。用含有5mg/L脂多糖(LPS)的培养液配制滑膜细胞悬液(5× 105个/mL),加入24孔培养板中,每孔1mL,于培养箱培养48h,收集上清液,300×g离心10min、过滤,ˉ20℃保存。采用ELISA试剂盒测定滑膜细胞上清液中的IL-1β、INF-γ和TNF-α的水平。
1.3.9 数据统计
采用SPSS 11.5统计分析软件对实验数据进行统计学处理,数值以(±s)表示,显著水平为P<0.05。
2 结果与分析
2.1 鸡胸软骨酶解产物的组成及理化性质
2.1.1 鸡胸软骨的超微结构
软骨内的Ⅱ型胶原主要由软骨细胞所分泌,Ⅱ型胶原纤维具有坚强的刚性,可作为软骨组织的骨架,使软骨呈一定的形状。通过透射电镜可以清晰的观察到鸡胸软骨的胶原纤维网络和其中的软骨细胞(图1),软骨内胶原纤维排列致密,直径很细,并相互交织成网状。软骨细胞则呈卵圆形,细胞核呈圆形,核膜光滑,有典型的核仁。
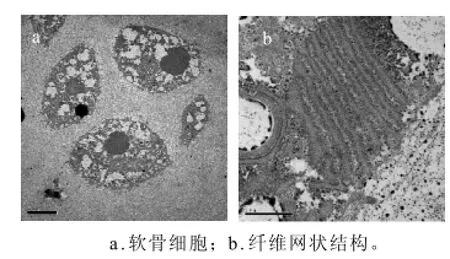
图1 原料软骨的超微结构Fig.1 Ultrastructure of chicken sternal cartilage
2.1.2 鸡胸软骨酶解产物的化学组成

表1 鸡胸软骨酶解产物的主要组成Table 1 Main components of the pepsin hydrolysate of chicken sternal cartilage
采用胃蛋白酶水解鸡胸软骨后,对软骨酶解产物的组成进行了分析。由表1可见,经过1.3.2节的提取步骤以后,鸡胸软骨酶解产物中的主要成分为II型胶原蛋白,其质量分数已达到89.14%,而糖胺聚糖及脂肪的含量相对较低。
2.1.3 鸡胸软骨酶解产物的变性温度
研究表明,只有未变性的Ⅱ型胶原才可充分诱导免疫耐受[10]。天然状态的Ⅱ型胶原由3条多肽链缠绕而成,当其被酶解时,由于温度和时间的作用,可能会导致氢键断裂,天然构象被破坏,这种状态的变化过程都会伴随着能量的变化[11],因此采用差示扫描量热仪(DSC)测定了软骨酶解产物的稳定性。由图2可见,软骨酶解产物及天然鸡胸软骨的变性温度分别为43.843℃和44.113℃。胶原的收缩实际上是一个熔化现象,它具有一级相转变的特征,也就是聚合物结晶区熔化的典型特征。变性温度越高,说明聚合物的结晶度越高,维持胶原纤维稳定的分子间静电相互作用和共价交联越大。而当胶原发生热变性时,胶原链之间的稳定性会被破坏,其三股螺旋结构变为单螺旋结构。由本实验的结果可见,胃蛋白酶作用的软骨酶解产物的变性温度仅有微弱降低,这说明在这说明软骨酶解产物在制备的过程中并没有破坏其三股螺旋结构。

图2 鸡胸软骨及软骨酶解物的变性温度Fig.2 Denaturation temperatures of chicken sternal cartilage and its pepsin hydrolysate
2.1.4 鸡胸软骨酶解产物的溶解性
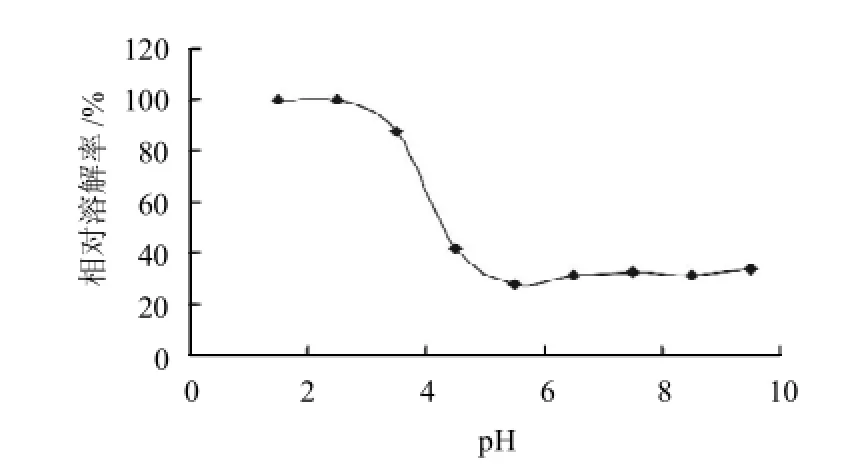
图3 pH值对鸡胸软骨酶解产物溶解性的影响Fig.3 Effect of pH on the solubility of the pepsin hydrolysate
由图3可见,鸡胸软骨酶解产物在偏离等电点的酸性条件下,溶解度较高,随着pH值的增加,溶解度降低,当pH值为5.8左右时,其溶解度达到最低值,即为其等电点。这是因为软骨酶解产物中的Ⅱ型胶原是十分典型的两性聚电解质,由于氨基端、羧基端、侧链酸性基团和碱性基团的存在,在水溶液中易电离为大分子离子,从而导致溶解度增高。
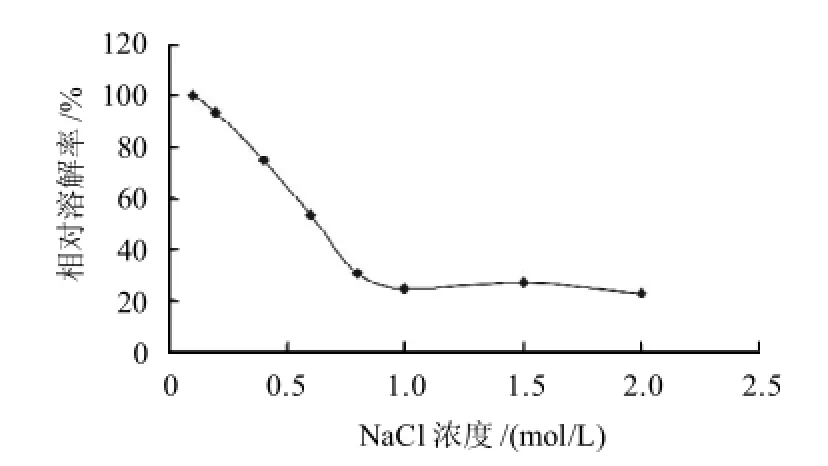
图4 NaCl浓度对鸡胸软骨酶解产物溶解性的影响Fig.4 Effect of NaCl concentration on the solubility of the pepsin hydrolysate
由图4可见,随着NaCl浓度的增加,酶解产物的溶解度逐渐下降,当NaCl的浓度到达0.9mol/L时,软骨酶解产物的溶解度最低。这可能是由于溶液中高浓度的中性盐离子有很强的水化能力,会夺取胶原蛋白分子的水化层,使其失水,发生聚集而沉淀析出。另外,NaCl是一种强电解质,压缩胶原分子的双电层,胶原分子间静电斥力减小,引起胶原分子之间聚集而沉淀,因而溶解度下降。
2.2 鸡胸软骨酶解产物对类风湿性关节炎大鼠的免疫调节作用
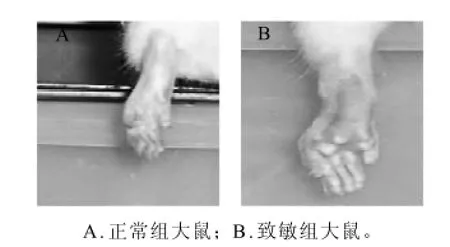
图5 正常大鼠及致敏后的患病大鼠Fig.5 Rat paws before and after suffering from RA
2.2.1 大鼠类风湿性关节炎模型的建立与对照组相比,接受Ⅱ型胶原注射诱导的大鼠的踝关节及掌趾部出现明显红肿(图5)。除关节表现外,动物还有轻度体毛脱落,活动减少、反应迟钝等表现,同时伴有局部皮温升高。
2.2.2 鸡胸软骨酶解产物对大鼠足掌厚度的影响
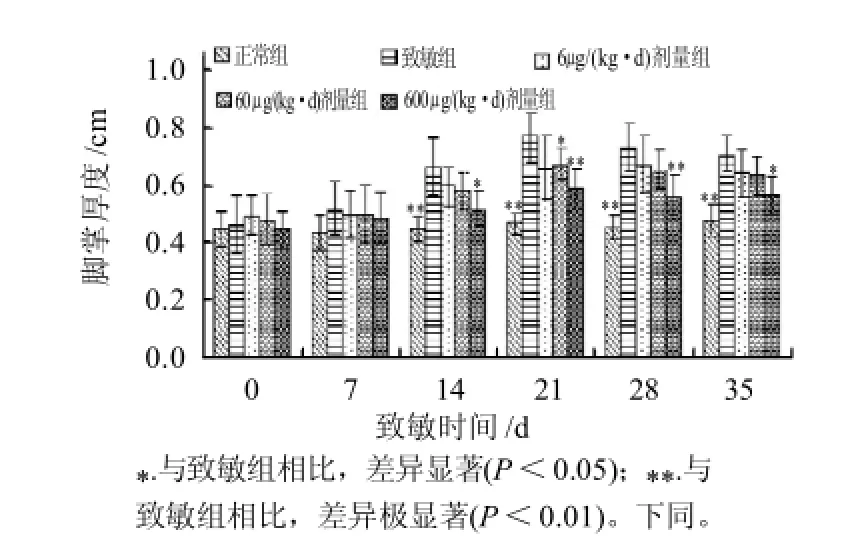
图6 鸡胸软骨酶解产物对大鼠足掌厚度的影响Fig.6 Effect of the pepsin hydrolysate on the thickness of paw of RA rats
初次致敏后的大鼠于次日就出现左后足发红、发热、肿胀等急性炎症表现,约14d后,除左后足关节炎症加重外,其他脚掌和关节也陆续出现多关节炎症。继发性多关节炎病情于初次致敏约3周后达到高峰,此后随病程延长,多关节炎虽反复出现,但累计数量及程度均减轻。由图6可见,与致敏组相比,鸡胸软骨酶解产物显示出剂量依赖性抑制大鼠足肿胀的作用,在致炎后20d左右,600μg剂量组大鼠足掌厚度的下降程度达到峰值(P<0.01)。
2.2.3 鸡胸软骨酶解产物对大鼠抗CII抗体的影响
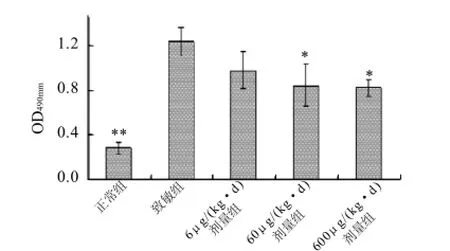
图7 鸡胸软骨酶解产物对血清抗CII抗体水平的影响Fig.7 Effect of the pepsin hydrolysate on the serum level of anticollagen type II antibody in RA rats
采用ELISA法检测了大鼠血清中抗CII抗体的水平,结果如图7所示。相比于致敏组大鼠,60μg(kg·d)和600μg(kg·d)剂量组的软骨酶解产物显著降低了RA大鼠的抗CII抗体的水平,其在490nm的OD值分别为0.842±0.184 (P<0.05)和0.821±0.081(P<0.05)。而6μg(kg·d)剂量组的软骨酶解产物对RA大鼠抗CII抗体的水平无显著影响。
2.2.4 鸡胸软骨酶解产物对大鼠滑膜细胞炎性因子分泌的影响


图8 鸡胸软骨酶解产物对炎性细胞因子的影响Fig.8 Effects of the pepsin hydrolysate on proinflammatory cytokines in RA rats
采用试剂盒测定了RA大鼠滑膜细胞培养液中炎性细胞因子的水平,结果如图8所示。RA大鼠均显示出非平衡的细胞因子分泌状态,其TNF-α、IFN-γ和IL-1β水平显著高于正常组(P<0.05)。相比于致敏组,600μg/ (kg·d)剂量组酶解产物显著降低了滑膜液中TNF-α、IL-1β(P<0.05)和 IFN-γ(P<0.01)的水平,这提示其治疗作用机理可能与抑制滑膜细胞分泌炎性细胞因子及纠正Th1和Th2细胞平衡失调有关。
3 讨 论
到目前为止,类风湿性关节炎仍无有效的根治方法,也缺乏有效安全的防治措施。最近在研究人类类风湿性关节炎的过程中,一些学者报道了口服未变性的II型胶原产生免疫耐受可使类风湿性关节炎的发病过程受到抑制,无论是动物实验还是临床观察中均发现令人鼓舞的结果[12-13]。然而天然软骨中的II型胶原是不可溶的,只有去除其端肽时,才能转变为可溶性的Ⅱ型胶原,在去除其端肽的过程中,II型胶原的天然三股螺旋可能被破坏。本实验的研究结果表明,采用胃蛋白酶低温处理的鸡胸软骨酶解产物未发生变性,同时在pH值小于5.8,NaCl浓度小于0.9mol/L时,保持较高的溶解性。
近年来的研究发现,类风湿性关节炎的病理过程与滑膜细胞功能改变有关[14-15]。在RA滑膜大量浸润的CD4+细胞(Th)中,以致炎性的Th1细胞占优势,而具有相对保护作用的Th2细胞减少。Th1可促进巨噬细胞活化的细胞毒性T细胞分化,并释放大量炎性细胞因子(如INF-γ、TNF-α、IL-1等),这些细胞因子可促进胶原酶、金属蛋白酶的合成,增强细胞间黏附因子、血管细胞黏附分子的表达,从而促进局部炎症细胞浸润,导致软骨降解,造成滑膜成纤维细胞增殖,形成RA 特征性血管翳[16]。本实验的研究结果表明,口服软骨酶解产物显著抑制了RA大鼠的足掌肿胀,并降低了其血清抗CII抗体及滑膜炎性细胞因子的水平,这表明软骨酶解产物可能通过调节Th1细胞因子的表达、纠正失衡的Th1/Th2细胞因子网络及降低血清特异性抗CII抗体的水平对RA产生防治作用。
[1]RODA A , MANETTA A C, PIAZZA F, et al. A rapidand sensitive 384-microtiter wells format chemiluminescentenzyme immunoassay for clenbuterol[J]. Talanta, 2000, 52(2): 311-318.
[2]JOHN S, DAVIES N, WORTHINGTON J. Genes for rheumatoid arthritis offer new insights into disease mechanisms[J]. Drug Discovery Today: Disease Mechanisms, 2005, 2(3): 337-345.
[3]TAYLOR P C, FELDMANN M. Rheumatoid arthritis: pathogenic mechanisms and therapeutic targets[J]. Drug Discovery Today: Disease Mechanisms, 2004, 1(3): 289-295.
[4]VITAL E M , EMERY P. The development of targeted therapies in rheumatoid arthritis[J]. Journal of Autoimmunity, 2008, 31(3): 219-227.
[5]JU J H, CHO M L , JHUN J Y, et al. Oral administration of type II collagen suppresses IL-17-associated RANKL expression of CD4+T cells in collagen induced arthritis[J]. Immunology Letters, 2008, 117 (1): 16-25.
[6]WOESSNER J F. The determination of hydroxyproline in tissue and protein samples containing small proportions of this imino acid[J]. Arch Biochem Biophys, 1961, 93(2): 440-447.
[7]PIEPER J S, HAFMANS T, VEERKAMP J H, et al. Development of tailor-made collagen-glycosaminoglycan matrices: EDC/NHS crosslinking, and ultrastructural aspects[J]. Biomate, 2000, 21(6): 581-593.
[8]MAYERS L K, TANG B AND BRAND D D, et al. Efficacy of modified recombinant type II collagen in modulating autoimmune arthritis[J]. Arthritis Rheum, 2004, 50(9): 3004-3011.
[9]CHO Y G, CHO M L , MIN S Y. Type II collagen autoimmunity in a mouse model of human rheumatoid arthritis[J]. Autoimmunity Reviews, 2007, 7(1): 65-70.
[10]ZHAO Wei, TONG Tong, WANG Ling, et al. Chicken type II collagen induced immune tolerance of mesenteric lymph node lymphocytes by enhancing beta 2-adrenergic receptor desensitization in rats with collagen-induced arthritis[J]. International Immunopharmacology, 2011, 11(1): 12-18.
[11]GELSE K, PO..SCHL E, AIGNER T. Collagens-structure, function, and biosynthesis[J]. Advanced Drug Delivery Reviews, 2003, 55(12): 1531-1546
[12]GARCIA G, KOMAGATA Y , SLAVIN A J, et al. Suppression of collagen-induced arthritis by oral or nasal administration of type II collagen[J]. Journal of Autoimmunity, 1999, 13(3): 315-324.
[13]李学义, 朱平, 王彦红, 等. 重组人II型胶原250-270多肽的表达及活性研究[J]. 中华微生物学和免疫学杂志, 2003, 23(2): 152-154.
[14]MATSUMOTO T, AMETANI A, HACHIMURA S, et al. Intranasal administration of denatured type II collagen and its fragments can delay the onset of collagen-induced Arthritis[J]. Clinical Immunology and Immunopathology, 1998, 88(1): 70-79.
[15]UCHIYAMA Y, KOIKE N. Anemia in monkey collagen-induced arthritis is correlated with serum IL-1, but not TNFα[J]. Rheumatology International, 2008, 28(9): 879-883.
[16]FRIDKIS-HARELI M, ROSLONIEC E F , FUGGER L, et al. Synthetic peptides that inhibit binding of the collagen type II 261-273 epitope to rheumatoid arthritis-associated HLA-DR1 andˉDR4 molecules and collagen-specific T-cell responses[J]. Human Immunology, 2000, 61(7): 640-650.
Characterization of Pepsin Hydrolysate of Chicken Sternal Cartilage and Its Immunoregulatory Function in Rats with Rheumatoid Arthritis
CAO Hui1,ZHANG Zhong-hui2,XU Shi-ying3
(1.Medical Equipment and Food Institute, University of Shanghai for Science and Technology, Shanghai 200093, China;2. Apple Flavor & Fragrance Group Co. Ltd., Shanghai 201809, China;3. School of Food Science and Technology, Jiangnan University, Wuxi 214036, China)
Purpose: To investigate physicochemical properties of the pepsin hydrolysate of chicken sternal cartilage and its immunoregulatory function in rats with rheumatoid arthritis (RA). Methods: RA was induced in rats by collagen type II injections. Results: The pepsin hydrolysate consisted mainly of collagen type II with a denaturation temperature of 43.843℃. However, the solubility was low at pH above 5.8 and NaCl concentrations above 0.9 mol/L. Oral administration of the hydrolysate decreased significantly the swelling of paws, the serum level of anti-collagen type II antibody and secretion of proinflammatory cytokines in RA rats. Conclusion: The pepsin hydrolysate can prevent and treat RA probably by regulating the expression of Th1 and Th2 cytokines, correcting the imbalance of Th1/Th2 cytokines network, and decreasing the serum concentration of anti-collagen type II antibody.
chicken sternal cartilage hydrolysate;rheumatoid arthritis;immunoregulatory function;cytokines
TS201.2
A
1002-6630(2012)03-0243-05
2011-06-30
上海市自然科学基金项目 (11ZR1424400)
曹慧(1976—),女,讲师,博士,研究方向为功能性配料及添加剂。E-mail:caohuian@yahoo.com.cn
