猪背最长肌焦磷酸酶的分离纯化与酶学特性
2012-06-01靳红果万可慧田锐花彭增起王蓉蓉
靳红果,万可慧,田锐花,彭增起*,王蓉蓉
(南京农业大学 教育部肉品加工与质量控制重点实验室,江苏 南京 210095)
猪背最长肌焦磷酸酶的分离纯化与酶学特性
靳红果,万可慧,田锐花,彭增起*,王蓉蓉
(南京农业大学 教育部肉品加工与质量控制重点实验室,江苏 南京 210095)
通过离心、50%~70%饱和硫酸铵沉淀、DEAE-52离子交换柱层析,从猪背最长肌中分离纯化出焦磷酸酶(PPase)。变性聚丙烯酰胺凝胶电泳图谱显示,PPase分子质量约72kD。焦磷酸酶酶学特性研究表明,最适反应温度和pH值分别为50℃和7.5。Mg2+是PPase的激活剂,在浓度4.75mmol/L时,酶活力最强。但Na+和K+都能抑制酶的活力,且Na+的抑制效果强于K+。PPase水解焦磷酸钠(TSPP)的动力学参数Vmax为0.086μmol /(L·min)),Km为0.36mmol/L。
焦磷酸酶;纯化;酶学特性;猪肉
焦磷酸盐常被添加到肉制品如西式火腿、灌肠中用来改善肉的持水性和黏结性。许多研究指出,焦磷酸盐可以与肌肉蛋白发生特异的相互作用[1-2],有效地解离肌动球蛋白。焦磷酸钠能提供很高的pH值,所以能赋予肉制品很好的保水性[3],可以有效改善PSE(pale soft and exudative,PSE)肉加工特性[4]。研究表明,焦磷酸盐在肉中通过酶解和自身降解两种途径水解成正磷酸盐,目前已证实主要通过酶解的形式进行[5-6]。在不同物种中焦磷酸盐的水解速率差异很大[7-8],除了与肌肉内环境因素如pH值、贮藏温度等有关外,主要与不同物种中焦磷酸酶(PPsae)的活力有关[8-10]。自20世纪60年代,Nakamura等[11]对兔肉中焦磷酸酶进行初步研究,发现有酸性焦磷酸酶和中性焦磷酸酶,后来Morita等[12]对兔肉中的中性焦磷酸酶进行了纯化和酶学特性研究。姚蕊[13]、孙珍珍[14]等分别对鸡肉和牛肉中焦磷酸酶进行了研究,但对于猪肉中焦磷酸酶的研究尚未见报道。本实验以猪背最长肌为材料,通过逐级纯化得到焦磷酸酶并对其酶学特性进行研究。焦磷酸酶的研究对提高焦磷酸盐在肉中功能效用的发挥既有理论意义又有实际应用价值。
1 材料与方法
1.1 材料与试剂
宰后约4h的猪背最长肌,购于南京苜蓿园农贸市场),4℃条件下迅速预冷,剔除可见结缔组织和脂肪,待用。
焦磷酸四钠(TSPP) 美国Sigma公司;宽范围的蛋白质10~250kD Marker、PageRulerTMPlus Prestained Protein Ladder #SM1811 中国Fermentas分公司;DEAE-52美国Whatman公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Waring Blender 8010ES高速度组织匀浆机 美国Waring公司;Beckman AvantiJ-E高速离心机 美国Beckman Coulter公司;pH 211 HANNA 台式酸度计 葡萄牙Hanna公司;AKTA prime蛋白低压层析系统 瑞典GE Healthcare公司;Mini-Protean 3 cell伯乐电泳仪美国伯乐公司;GelDocTMXR TY4133凝胶成像系统 美国Bio-Rad公司;SpectraMax M2酶标仪 美国分子仪器公司。
1.3 方法
1.3.1PPase的分离纯化
1.3.1.1 粗酶液的提取
将冷却的猪背肌,取100g切成0.5cm3碎丁,加入4倍体积的提取液(25mmol/L Tris-HCl,5mmol/L MgCl2,pH7.0)用Waring Blender匀浆60s(20s转,20s停)。静置30min(提取更多的水溶性酶),然后将溶液10000×g离心30min。测定上清和沉淀的焦磷酸酶酶活力,确定焦磷酸酶存在于上清中,弃沉淀取上清。
1.3.1.2 硫酸铵沉淀与透析
将固体硫酸铵研磨之后,在4℃条件下缓慢搅拌加入50%饱和度的硫酸铵,静置4h,然后4℃条件下10000×g离心30min,弃沉淀取上清并加入固体硫酸铵至70%饱和度,静置4h,然后4℃、10000×g离心30min,取沉淀用提取液溶解。用移液器将蛋白质溶液移入透析袋(截留范围8000~14400D),置于提取液中透析,此过程中用磁力搅拌器缓慢搅拌以促进溶液交换。透析24h,更换4次透析缓冲液。
1.3.1.3 离子交换树脂层析
DEAE-52预处理材料用25mmol/L Tris-HCl、5mmol/L MgCl2,pH7.0处理浸泡12h后,装柱(1.6cm×20cm)。利用AKTA prime蛋白低压层析系统进行分离,用A液(25mmol/L Tris-HCl、5mmol/L MgCl2、1mmol/L二硫苏糖醇(DTT),pH7.0)平衡DEAE-52离子交换柱,平衡体积60mL,自动上样2mL,流速0.6min/mL,等待穿刺峰出现后,启动B液(1mol/L NaCl、25mmol/L Tris-HCl、5mmol/L MgCl2、1mmol/L DTT,pH7.0),通过自动混合器在0~1mol/L NaCl范围内洗脱,洗脱体积100mL,自动收集器收集各洗脱峰,每管收集5mL。测定不同洗脱峰的酶活力和蛋白含量。
1.3.2PPsae的鉴定
1.3.2.1 非变性凝胶电泳(Native PAGE)
采用Blue Native PAGE,8%分离胶,5%浓缩胶,用考马斯亮蓝R250染色。
1.3.2.2SDS变性凝胶电泳(SDS- PAGE)
采用SDS聚丙烯酰胺凝胶电泳,10%分离胶,5%浓缩胶,考马斯亮蓝R250染色[15]。
1.3.3 酶活力的测定
焦磷酸酶活力测定参考Yamazaki等[16]的方法。反应体系:将50μL焦磷酸酶和50μL底物TSPP置于600μL的离心管,混匀,50℃条件下反应15min,用35μL SDSEDTA(13.3%SDS、0.12mol/L EDTA,pH7.0)终止反应。之后添加265μL显色剂(0.5% Fe2SO4、0.5% 钼酸铵、0.5mol/L H2SO4),25℃条件下放置15min,然后用酶标仪在640nm波长处测定吸光度。对照组均在添加底物之前加入35μL SDS-EDTA使酶变性。根据标准曲线计算水解得到的Pi量。以焦磷酸四钠为底物,以单体磷的释放量来反映酶活力。酶活力单位(U)的定义为:在反应条件下每分钟转化得到1μmol产物Pi所需的酶量。
1.3.4 温度对酶活力的影响
将底物与酶反应体系分别在pH7.0,不同温度(25、30、40、45、50、55℃和60℃)下反应15min后,测定酶的催化活力。最适温度下测得的酶活力定义为100%,其余条件下测定的酶活力换算成相对酶活力。绘制酶最适温度曲线。
1.3.5pH值对酶活力的影响
在pH4~9范围内,选择0.1mmol/L的缓冲体系:柠檬酸-柠檬酸钠(pH4、5),组氨酸-氢氧化钠(pH6、6.5),Tris-HCl(pH7、7.5、8、9)。在最适反应温度50℃条件下,测定不同pH值条件下酶的活力。最适pH值测得的酶活力定义为100%,其余条件下测定的酶活力换算成相对酶活力。绘制酶最适pH值曲线。
1.3.6 盐类对酶活力的影响
在反应体系中添加不同浓度的NaCl或者KCl (0、0.1、0.2、0.4、0.6mol/L),在最适反应条件下(pH7.5、50℃)测定酶的活力。以不添加NaCl或者KCl的酶活力为100%,其余条件下测定的酶活力换算成相对酶活力,比较不同盐离子浓度对酶活力的影响。
1.3.7Mg2+对酶活力的影响
在反应体系中添加不同浓度的Mg2+(0.25、1.25、2.5、4.75、9.25、13.75、18.25mmol/L),在最适反应条件下(pH7.5、50℃)测定酶活力,将测定后最大酶活力定义为100%,比较不同Mg2+浓度对酶活力的影响。
1.3.8 底物浓度对酶活力的影响
将50μL含有5mmol/L MgCl2的PPase酶,再加入50μL不同浓度的TSPP,使反应体系内底物终浓度分别为0.2、0.4、0.6、0.8、1mmol/L,混合后,在最适反应条件下(50℃、15min和pH7.5)反应后,测定反应速度。采用Lineweaver-Burk plot双倒数法作图[17],求米氏常数(Km)及最大反应速率(Vmax)。
1.3.9 蛋白质含量的测定
纯化过程中的各过程,除离子交换层析收集管中的蛋白采用考马斯亮蓝G-250测定蛋白质量浓度外[18],其他均采用双缩脲法测定蛋白质量浓度[19]。
1.3.10 统计分析
实验做3次重复,6个平行。采用软件Origin 8.0处理分析数据并作图。
2 结果与分析
2.1DEAE-52阴离子交换层析
经硫酸铵分级沉淀的酶液,以10mg/mL的蛋白质量浓度,通过自动上样器,进样2mL,通过PrimeView Chromatography Software自动记录洗脱条件,如图1所示。在没有梯度洗脱的30min内出现了穿刺峰,即为一些上样后没有与柱子结合的蛋白。开始洗脱后,在60~100min,120~160min出现了蛋白吸收峰,不同蛋白被分离出来。通过测定酶活力,发现只有11、12、13管有酶活力,但11、13管酶活力比较微弱,目的蛋白主要存在于12管中。目的蛋白主要为0.35~0.45mol/L NaCl浓度下洗脱出来的成分。通过电泳对12管中目的蛋白做纯度鉴定。
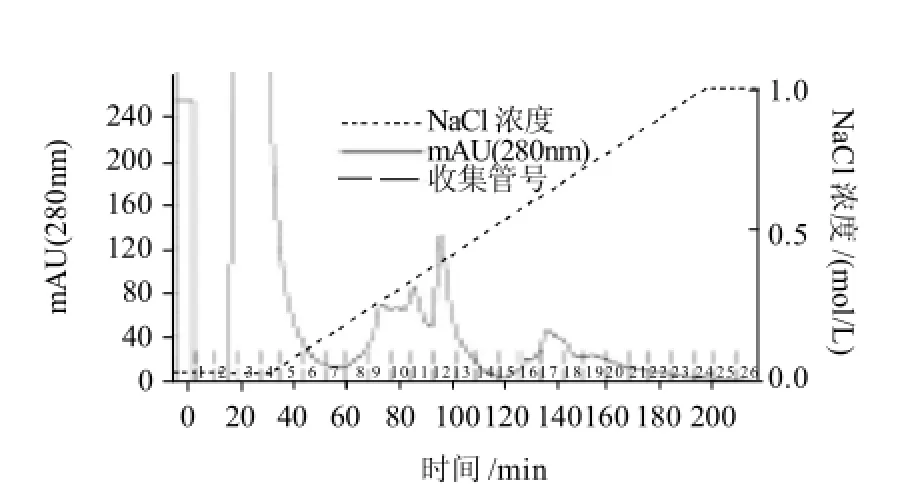
图1 DEAE-52 离子交换图谱Fig.1 Chromatogram of PPase on DEAE-52 column
2.2PPsae的鉴定

图2 非变性凝胶电泳Fig.2 Native-PAGE of purified PPase

图3 SDS变性凝胶电泳Fig.3 SDS-PAGE of purified PPase
实验分别用变性、非变性的聚丙烯酰胺凝胶电泳对PPase进行鉴定。经DEAE-52纯化后,非变性的聚丙烯酰胺凝胶电泳显示的PPase为1条带(图1),变性的聚丙烯酰胺凝胶电泳也显示PPase为1条带(图2),分子质量约为72kD。结果表明,经过纯化后的蛋白质中不含杂质蛋白,表明实验已成功的从猪背最长肌中提取了纯的PPase。
2.3PPase分离纯化效果

表1 猪背最长肌中焦磷酸酶的分离纯化结果Table 1 Purification results of PPase from pork longissimus dorsi muscle
PPase分离纯化结果如表1所示,将PPase纯化30.7倍,酶活回收率为8%。
2.4 温度对PPase活力的影响

图4 温度对PPase相对酶活力的影响Fig.4 Effects of temperature on the activity of PPase
由图4可知,PPase的最适温度为50℃,在此温度下,相对酶活力最强,同时,此时的酶促反应速率也最大。在25~45℃范围内,随温度的上升相对酶活力从41%提高到94%。然而50℃以后温度继续增加,相对酶活力开始快速下降,55℃时相对酶活力下降到66%,当温度达到60℃时,相对酶活力仅8%左右,说明此时大部分酶被破坏,发生不可逆的热变性。结果表明:过高或过低的温度都会降低酶的催化效率。
2.5 pH值对PPase活力的影响
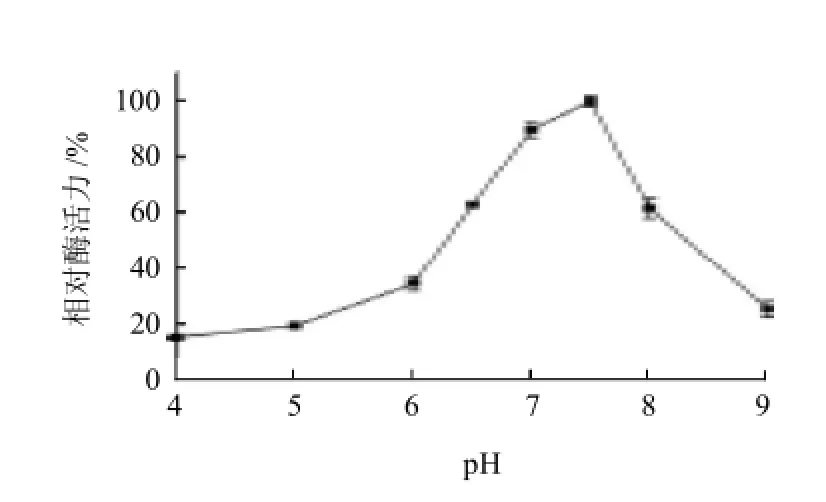
图5 pH值对PPase相对酶活力的影响Fig.5 Effects of pH on the activity of PPase
通过测定在不同pH值条件下PPase的相对酶活力,发现pH值对相对酶活力有较大影响。由图5可知,酶最适pH值为7.5。当pH值在6.5~8.0范围内,PPase的相对酶活力均在60%以上,而当pH值小于6.5(偏酸)或大于8.0(偏碱)时,相对酶活力均下降很快。说明PPase适合存在于中性pH值范围内,可以说此酶为中性焦磷酸酶。
2.6 盐类对PPase活力的影响

图6 NaCl和KCl对PPase相对酶活力的影响Fig.6 Effects of NaCl and KCl on the activity of PPase
由图6可知,KCl和NaCl对PPase活力都有抑制作用,只是抑制程度有所差异。当KCl和NaCl浓度低于0.2mol/L时,对PPase活力的抑制作用差异不明显,相对酶活力均保持在80%以上。KCl浓度继续增加,相对酶活力下降缓慢,0.6mol/L时相对酶活力为72%,而NaCl浓度继续增加,相对酶活力快速下降,0.6mol/L时相对酶活力仅有33%。说明NaCl对PPase活力有强烈的抑制作用。由此推断这也可能是NaCl能与TSPP起到协同作用的原因。NaCl抑制了PPase的活力,使得TSPP在肉中的水解速度变慢,延长了发挥作用的时间,NaCl和TSPP能更好的提取肉中的盐溶性蛋白。
2.7 Mg2+对PPase活力的影响
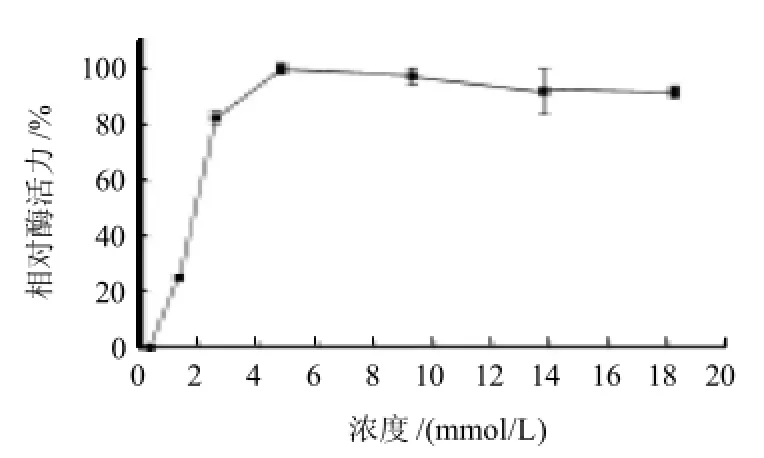
图7 Mg2+浓度对PPase相对酶活力的影响Fig.7 Effects o f Mg2+on the activity of PPase
如图7所示,不存在或存在低浓度Mg2+时焦磷酸酶的酶活力很低,尝试在提取过程中不添加Mg2+,在酶活力体系测定中也不添加Mg2+离子的条件下,没有检测到PPase的活力。这充分说明Mg2+对于PPase酶的稳定和激活作用是必须的。当添加0.25~1.25mmol/L Mg2+时,相对酶活力从0.2%上升到24.98%。继续增加Mg2+浓度,相对酶活力迅速增加,2.5mmol/L浓度时,相对酶活力是82.6%。当Mg2+的浓度达到4.75mmol/L时,PPase相对酶活力达到最大,激活作用明显。此后Mg2+浓度再增大PPase相对酶活力逐渐平缓下降,随后在13.75~18.25mmol/L之间形成一个平台期。由此可见,在该酶起作用时必须有较高浓度的镁离子存在。
2.8PPase的酶动力学曲线
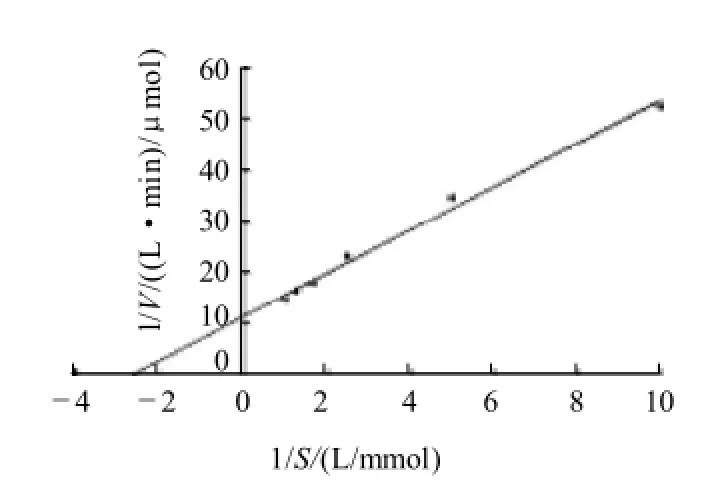
图8 PPase的米氏常数Fig.8 Kinetic analysis of PPase
添加不同浓度的底物,研究猪背最长肌中焦磷酸酶的动力学特征,采用双倒数作图法作图,结果如图8所示。在实验反应条件下测定PPase的Vmax为0.086μmol/(L·min),Km为0.36mmol/L。
3 讨 论
对于焦磷酸酶的纯化,Nakamura等[11]在兔肉中发现了两种焦磷酸酶,一种酸性焦磷酸酶是在18000×g离心的沉淀中得到的,一种中性焦磷酸酶是水溶性的。通过比较,酸性焦磷酸酶的活力远低于中性焦磷酸酶,所以在肌肉中分解焦磷酸盐起主要作用的应该是中性焦磷酸酶。Matsunaga 等[20-21]在漂洗过程中通过测定鱼肉组织中焦磷酸酶的活力也证明了这一点,发现漂洗次数越多,肉中焦磷酸酶的活力越低。这主要是因为焦磷酸酶是水溶性的。Gao Ruichang等[23]发现在鱼肉漂洗液中的焦磷酸酶的活力比鱼肉中要高,而且在漂洗液中纯化得到了焦磷酸酶。本实验主要从肌浆蛋白中提取得到水溶性的焦磷酸酶。对于不同物种中的焦磷酸酶分子质量都不大相同,根据先前的研究报道,兔骨骼肌中焦磷酸酶的分子质量在67kD有两个亚基在35kD左右。Gao Ruichang等[23]研究发现鳙鱼中焦磷酸酶的分子质量为50kD。本实验只是纯化得到了焦磷酸酶,通过SDSPAGE测定该酶的分子质量约为72kD。而对于此焦磷酸酶是否有亚基,没有进一步证实。
温度是影响酶活力的重要因素。猪肉中焦磷酸酶的最适温度为50℃。Morita等[22]在测定猪肉乳化肠中添加的焦磷酸盐水解速率时发现,将焦磷酸盐和猪瘦肉、脂肪等原料一起匀浆后的乳化液分别置于15、50、70℃保温,50℃时,在pH5.6~6.2焦磷酸盐水解最快。Gao Ruichang等[23]测定鳙鱼中的焦磷酸酶的最适温度也在50℃。在牛肉匀浆物中温度超过40℃,组织中的酶将失活[24]。而在从牛肉半腱肌纯化得到的焦磷酸酶的最适温度为47℃[14]。说明纯化后酶的特性和在匀浆物中非纯化酶的特性有所差异。综上所述,肌肉中焦磷酸酶的最适温度都在50℃附近,超过此温度,焦磷酸酶容易热变性而失活。pH值会影响酶的活力和稳定性。Nakamura等[11]和Morita等[12]测定兔肉中性焦磷酸酶的最适pH值均为7.4。本实验测定的猪背最长肌中最适pH值为7.5,与兔肉中的相差不大。而与牛肉匀浆物中未纯化焦磷酸酶的最适pH值在6.7~6.8之间[9]有一定的差异。
有研究表明添加3%的NaCl将会大大减慢PPase在鸡肉的水解速率,水解速率只有原来的1/2或者更低[7]。德国学者同样发现NaC1会抑制牛肉匀浆物中未纯化焦磷酸酶的活力[10]。本研究也发现猪肉中NaCl和KCl的添加可影响PPase的活力。在小于0.2mmol/L NaCl条件下,对酶的抑制作用不明显,继续增加将会强烈抑制酶的活力。KCl对酶活力的抑制作用比NaCl弱,添加0.6mmol/L KCl与添加0.25mmol/L NaCl对酶活力的抑制效应相当。
对于二价金属离子对焦磷酸酶的影响,研究者们一直都很关注。Mg2+是酶中常见的一种激活剂,而且它还影响肉蛋白凝胶的特性。已证实Mg2+是焦磷酸酶的稳定剂和激活剂。本实验中同样证明了这一点。Mg2+在0~25mmol/L之间时牛肉中焦磷酸酶的活力不断增加,超过25mmol/L时酶活力保持稳定[14]。在咸鱼糜中发现PPase的降解对Mg2+非常依赖,当Mg2+浓度3mmol/L时,PPase的水解需要20h,然而在13mmol/L Mg2+条件下,PPase的水解只需要8h[20]。这也从另一方面证明了Mg2+是肌肉中PPase必要的激活剂。本实验的结果发现猪肉中的PPase活力在Mg2+浓度为4.75mmol/L时达到最高,之后非常平缓下降,几乎形成了一个平台期,与以上的研究结果相一致。
4 结 论
本实验从猪背最长肌中纯化了PPase,纯化倍数为30.7,酶活回收率为8%。PPase最适反应温度为50℃,pH值为7.5。Mg2+对PPase有激活作用。NaCl和KCl均会抑制PPase的活力。PPase水解的动力学参数Vmax为0.086μmol/(L·min),Km为0.36mmol/L。
[1]YASUI T, FUKAZAWA T, TAKAHASHI K, et al. Phosphate effects on meat, specific interaction of inorganic polyphosphates with myosin B[J]. Journal of Agricultural and Food Chemistry, 1964, 12(5): 399-404.
[2]XIONG Y, LOU X, WANG C, et al. Protein extraction from chicken myofibrils irrigated with various polyphosphate and NaCl solutions[J]. Journal of Food Science, 2000, 65(1): 96-100.
[3]ALVARADO C, SAMS A. Injection marination strategies for remediation of pale, exudative broiler breast meat[J]. Poultry Science, 2003, 82(8): 1332-1336.
[4]ZHENG M, DETIENNE N A, BARNES B W, et al. Tenderness and yields of poultry breast are influenced by phosphate type and concentration of marinade[J]. Journal of the Science of Food and Agriculture, 2001, 81(1): 82-87.
[5]O, NEIL I K, RICHARDS C. Specific detection of polyphos- phates in frozen chicken by combination of enzyme blocking and 31P-FTNMR spectroscopy[J]. Chem Ind, 1978, 2: 65-67.
[6]DOUGLASS M, MCDONALD M, O,NEILL I, et al. Technical note: a study of the hydrolysis of polyphosphate additives in chicken flesh during frozen storage by31P-FTNMR spectroscopy[J]. International Journal of Food Science & Technology, 1979, 14(2): 193-197.
[7]BELTON P S, PACKER K J, SOUTHON T E.31P NMR studies of the hydrolysis of added phosphates in chicken meat[J]. Journal of the Science of Food and Agriculture, 1987, 40(3): 283-291.
[8]LI R R, KERR W L, TOLEDO R T, et al.31P NMR analysis of chicken breast meat vacuum tumbled with NaCl and various phosphates[J]. Journal of the Science of Food and Agriculture, 2001, 81(6): 576-582. [9]HAMM R, NERAAL R. On the enzymatic breakdown of tripolyphos-phate and diphosphate in minced meat. VI. Influence of pH on th,e tripolyphosphatase and diphosphatase activities in bovine muscle (authors transl)[J]. Zeitschrift f.u.r Lebensmittel-Untersuchung und-Forschung, 1977, 163(3): 213-235.
[10]HAMM R, NERAAL R. On the enzymatic breakdown of tripolyphosphate and diphosphate in comminuted meat. VII. Influence of sodium chloride on the tripolyphosphatase and diphosphatase activity in bovine muscle (author ,s transl)[J]. Zeitschrift f.u.r Lebensmittel-Untersuchung und-Forschung, 1977, 164(1): 34-37.
[11]NAKAMURA S, YAMAGUCHI M, MORITA J, et al. Muscle pyrophosphatases[J]. Journal of Agricultural and Food Chemistry, 1969, 17(3): 633-638.
[12]MORITA J, YASUI T. Purification and some properties of a neutral muscle pyrophosphatase[J]. Journal of Biochemistry, 1978, 83(3): 719-726.
[13]姚蕊, 彭增起, 周光宏, 等. 鸡胸大肌中焦磷酸酶的分离纯化及特性研究[J]. 食品科学, 2007, 28(7): 299-304.
[14]孙珍珍, 彭增起, 靳红果, 等. 牛肉半腱肌中焦磷酸酶的分离纯化及特性研究[J]. 食品科学, 2010, 31(5): 160-164.
[15]LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[16]YAMAZAKI M, SHEN Q, SWARTZ D. Tripolyphosphate hydrolysis by bovine fast and slow myosin subfragment 1 isoforms[J]. Meat Science, 2010, 85(3): 446-452.
[17]LINEWEAVER H, BURK D. The determination of enzyme dissociation constants[J]. Journal of the American Chemical Society, 1934, 56 (3): 658-666.
[18]STOSCHECK C M. Quantitation of protein[J]. Methods in Enzymology, 1990, 182: 50-68.
[19]GORNALL A G, BARDAWILL C J, DAVID M M. Determination of serum proteins by means of the biuret reaction[J]. J Biol Chem, 1949, 177(2): 751-766.
[20]MATSUNAGA A, OOIZUMI T, YAMAMOTO A, et al. Degradation of polyphosphates during the manufacturing process of surimi-based products: effect of magnesium concentration on enzymatic degradation[J]. Journal of the Food Hygienic Society of Japan, 1997, 38(1): 1-6.
[21]MATSUNAGA A, OOIZUMI T, YAMAMOTO A, et al. Washing effect of minced fish muscle in water on degradation of polyphosphates during manufacturing process of surimi-based products[J]. Bulletin of the Japanese Society of Scientific Fisheries (Japan), 1992, 51(8): 79-83.
[22]MORITA J I, NAGAHASHI T, TANIZAKI A, et al. Measurement of inorganic pyrophosphate in sausage emulsions[J]. Journal of the Faculty of Agriculture, 1983, 61(3): 351-363.
[23]GAO Ruichang, XUE Changhu, YUAN Li, et al. Purification and characterization of pyrophosphatase from bighead carp (Aristichthys nobilis) [J]. LWT-Food Science and Technology, 2008, 41(2): 254-261.
[24]NERAAL R, HAMM R. On the enzymatic breakdown of tripolyphosphate and diphosphate in comminuted meat. XI. Influence of heating and freezing (author, s transl)[J]. Zeitschrift f.u.r Lebensmittel-Untersuchung und-Forschung, 1977, 164(2): 101-104.
Purification and Characterization of Pyrophosphatase from Pork longissimus dorsi Muscle
JIN Hong-guo,WAN Ke-hui,TIAN Rui-hua,PENG Zeng-qi*,WANG Rong-rong
(Key Laboratory of Animal Products Processing and Quality Control, Ministry of Education, Nanjing Agricultural University, Nanjing 210095, China)
Pyrophosphatase (PPase) from pork longissimus dorsi muscle was purified by ultracentrifugation, 50%ˉ70% saturated ammonium sulfate fractionation, DEAE-52 anion-exchange chromatography. The purified enzyme with molecular mass of 72 kD ran as a single band on SDS-polyacrylamide gel. The optimum pH and temperature for the isolated PPase was 7.5 and 50 ℃, respectively. Mg2+was necessary for PPase and the activity reached maximum at a concentration of 4.75 mmol/L. Na+and K+inhibited the enzyme activity and the inhibitory effect of Na+was stronger than K+. The kinetic constant Km and Vmax using TSPP as substrate were determined as 0.36 mmol/L and 0.086μmol/(L·min), respectively.
pyrophosphatase;purification;characterization;pork
TS251.1
A
1002-6630(2012)03-0168-06
2011-04-28
靳红果(1983—),女,博士研究生,研究方向为肉品加工与质量控制。E-mail:jhg83@163.com
*通信作者:彭增起(1956—),男,教授,博士,研究方向为畜产品加工与质量控制。E-mail:zqpeng@njau.edu.cn
