犬源贾第虫EF1α基因的克隆及序列分析*
2012-05-31王培园刘远佳郭建超孟祥龙李国清
李 结,王培园,张 萍,刘远佳,郭建超,孟祥龙,李国清
(华南农业大学兽医学院,广东广州 510642)
贾第鞭毛虫(Giardiasp.)简称贾第虫,是一种呈全球性分布的重要人兽共患性寄生原虫,能广泛寄生于人、哺乳动物、鸟类、两栖类及啮齿类动物的肠道,导致腹泻和消化不良等症状,诸多临床病例和流行病学资料均已证明贾第虫病是一种具有重要公共卫生意义的原虫病[1-3]。贾第虫病是一种水源性传播的疾病,常年流行但多见于夏季。饮用水被污染是造成该病流行和暴发的重要因素。本病已被列为全世界危害人类健康的10种主要寄生虫病之一[4]。近年来研究显示,贾第虫合并人免疫缺陷病毒(HIV)感染,并在同性恋者中流行的报道不断增多[5]。
近年来,宠物犬贾第虫感染也较普遍,且可流行和传播人兽共患的贾第虫基因型,对人类健康构成潜在威胁。因此,对贾第虫进行研究就显得尤为重要。贾第虫延长因子(elongation factor 1alpha,EF1α)基因是蛋白质合成过程中肽链延伸所需的蛋白因子的基因,进化速率相对较慢,因此常被用于贾第虫的基因型鉴定。本试验以广州犬粪便中发现的贾第虫为研究对象,针对其EF1α基因设计引物,进行PCR扩增、克隆和测序,通过序列分析比对,对本次分离的犬源贾第虫进行了分子鉴定,为贾第虫的分子遗传学和分子诊断学研究及贾第虫病的防治研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 粪便样品 犬粪便样品采自广东广州某宠物医院。每个粪样取10g~15g,加5倍自来水搅匀,60目铜筛过滤,将滤液以2 500r/min离心10min,弃上清,按粪便量的5倍体积加入330g/L硫酸锌漂浮液,然后用小铁丝环蘸取漂浮液表层涂片镜检。将形态学鉴定为阳性的粪便样品保存至4℃冰箱备用。
1.1.2 主要试剂和仪器 DNA提取试剂盒(Stool DNA Kit)、WizardTM DNA Clean-Up System试剂盒、pGEM -T Easy Vector,均为Promega公司产品;dNTPs(2.5mmol/L)、ExTaqDNA 聚合酶、6×Loading buffer、DNA Marker DL 2 000、IPTG和X-gal均为宝生物工程(大连)有限公司产品;蛋白酶K为Merk公司产品;Biometra PCR仪器为德国Biometra公司产品;Bio-RAD电泳系统为美国Bio-RAD公司产品;凝胶图像分析系统为英国Uvitec公司产品。
1.2 方法
1.2.1 DNA提取及引物设计 将纯化后的包囊用Promega公司的粪便提取试剂盒(Stool DNA Kit)抽提贾第虫全基因组DNA,并置于-20℃冰箱保存备用。引物由上海英骏生物技术有限公司合成,上游引物 EF:5′-CTGGTCACCGCGACTTCA-3′,下游 引 物 ER:5′-ACTCCTCGGCCTTCTTCC-3′,预期扩增片段为288bp。
1.2.2 PCR扩增目的片段 PCR扩增体系为25μL:EF/ER引物各0.25μL,10×buffer 2.5μL,dNTP 2μL,MgCl23μL,Ex-Taq酶0.25μL,无菌水15μL,DNA样品2μL。PCR反应条件为:94℃预变性3min;94℃30s,60℃30s,72℃30s,循环35次;最后72℃5min。同时设置阴性对照组,只加入与样品DNA量相同的无菌双蒸水。PCR产物在以0.5×TBE为电泳液的10g/L琼脂糖凝胶中电泳,0.5mg/L溴化乙锭(EB)染色,紫外分析仪下观察,凝胶成像系统摄像。
1.2.3 PCR产物的克隆及筛选 用DNA胶回收试剂盒对扩增片段进行纯化,纯化产物连接到pGEM-T Easy载体上,将连接产物转化至感受态细胞JM 109中,振荡培养后涂布在含氨苄青霉素和

图1 犬源贾第虫EF1α基因的PCR扩增结果Fig.1PCR amplification result of EF1αgene from Giardia lamblia
2.3序列测定及分析
犬源贾第虫EF1α基因PCR扩增序列长为288bp,其序列核苷酸组成(图3)。将测序结果在NCBI中进行Blast比对,然后从GenBank中下载IPTG的LB平板上,过夜培养后挑选白色的单菌落,进行菌液PCR鉴定,筛选出阳性克隆。

图3 犬源贾第虫EF1α基因的序列Fig.3 Sequence of the dog-derived Giardia EF1αgene
1.2.4 序列测定与分析 挑选样本中鉴定为阳性的菌液送上海英潍捷基贸易有限公司进行测序,Blast比对测序结果,然后从GenBank下载相关序列用DNA Star软件进行序列分析与比较,并构建分子系统进化树。
2 结果
2.1 PCR扩增结果
PCR扩增出的片段为288bp左右,与预期目的片段大小一致(图1)。
2.2克隆、转化及菌液PCR
用纯化回收试剂盒回收样品的PCR产物并将之克隆到pGEM-T Easy载体中,然后转化至感受态细胞JM 109,然后进行菌液PCR鉴定,得到的片段为288bp左右,与预期目的条带大小一致(图2)。相关序列,采用DNA Star软件建立系统进化树(图4)。结果表明本次分离的广州犬源贾第虫基因型为D型。
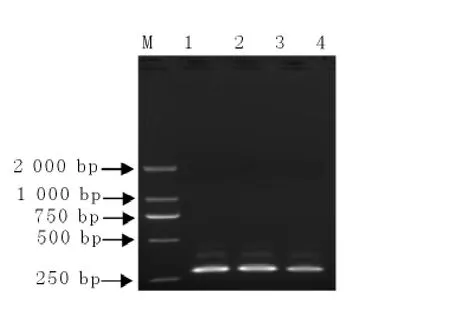
图2 重组质粒的PCR鉴定Fig.2dentification of recombinant plasmids by PCR

图4 犬源贾第虫EF1α基因的系统进化树Fig.4 The phylogenetic tree on EF1αgene of the dog-derived Giardia
3 讨论
蓝氏贾第虫(Giardialamblia)是一种呈世界性分布的人兽共感染的寄生性原虫。据WHO估计,贾第虫全世界人口的感染率约为30%,在我国,各地区感染率不同,约在1%~20%左右(平均约2.54%)[6]。在美国,每年大约有2.8×106人感染贾第虫,因此贾第虫被称为“头号肠道寄生虫”[7]。近年来,宠物犬深受人们喜爱,但宠物犬能感染人兽共患贾第虫基因型,这可能会通过多种途径传染给人,对人类健康构成潜在威胁[8]。因此,对宠物犬源贾第虫进行分子鉴定及准确分型具有重要的公共卫生意义。
蓝氏贾第虫是一个复杂的集合体,至少可分为7个有效集聚体或基因型(A~G)。其中只有A和B型是人兽共患的基因型,可感染包括人在内的大部分哺乳动物。A型主要有AⅠ和AⅡ,AⅠ为人兽共患型,AⅡ只感染动物;B型是人兽共患型且宿主范围较广;C和D型主要感染犬;E型可感染反刍动物;F和G型可分别感染猫和家鼠[9]。分子生物学技术是对贾第虫进行分子鉴定及基因型鉴定的重要手段,目前,常用于贾第虫基因型鉴定的分子标记主要有小亚基核糖体RNA基因(SSU-rRNA)、磷酸丙糖异构酶基因(tpi)、谷氨酸脱氢酶基因(gdh)、β-贾第素基因(bg)和α-延伸因子1基因(ef1-α)等[10]。肖淑敏等[11]针对16SrRNA基因和内转录间隔区ITS-rRNA基因序列设计引物,首次对我国分离的牛源贾第虫进行了基因型鉴定,结果为E型。朱海波等[12]用16SrRNA基因和gdh基因作为分子标记,对广东首株犬源贾第虫进行了基因型鉴定,16S-rRNA基因的序列分析结果显示该犬源贾第虫的基因型为A型,对gdh基因序列进一步分析显示该基因型为AⅠ亚型,属于人兽共患基因型。Minvielle M C等[13]利用tpi基因设计引物,对采自阿根廷的60份儿童粪样进行基因型鉴定,结果显示43份为阳性,其中3份为AⅡ型,40份为B型。Caccio S M等[14]用bg基因鉴定出人源贾第虫的基因型为AⅠ、AⅡ、BⅠ和BⅡ和BⅢ。Lalle M等[15]针对bg基因设计引物对意大利的含有贾第虫包囊的37份人粪样和25份狗粪样进行巢式PCR扩增,结果显示,人粪样中只检测到A型和B型。狗粪样中6份为A型,其余均为C型和D型,
本研究根据GenBank中登录的贾第虫EF1α基因序列设计引物,首次对我国广州犬粪中分离的贾第虫EF1α基因进行了扩增、克隆和测序。结果表明,本次分离的犬源贾第虫基因型为蓝氏贾第虫D型,且EF1α基因适合做分子标记,可准确地对贾第虫进行基因分型。同时,本试验所测得的贾第虫EF1α序列系国内首次报道,为贾第虫的分子遗传学及分子流行病学的进一步研究提供了有价值的科学资料。
[1]Xiao L,Fayer R.Molecular characterisation of species and genotypes of Cryptosporidium and Giardia and assessment of zoonotic transmission[J].Int J Parasitol,2008,38(11):1239-1255.
[2]Sulaiman I M,Fayer R,Bern C,et a1.Triosephosphate isomerase gene characterization and potential zoonotic transmission ofGiardiaduodenalis[J].Emerg Infect Dis,2003,9(11):1444-1452.
[3]CacciòS M,Ryan U.Molecular epidemiology of giardiasis[J].Mol Biochem Parasitol,2008,160(2):75-80.
[4]Sandhu H,Mahajan R C,Ganguly N K.Flowcytometric assessment of the effect of drugs on Giardia lamblia trophozoitesinvitro[J].Mol Cell Biochem,2004,265:151-160.
[5]Elmendorf H G,Dawson S C,McCaffery J M.The cytoskeleton of Giardia lamblia[J].Int J Parasitol,2003,33(1):3-28.
[6]卢思奇.国内蓝氏贾第鞭毛虫研究[J].寄生虫与医学昆虫学报,1999,6(4):193-197.
[7]卫 茹,田喜风,阎静波,等.蓝氏贾第鞭毛虫感染的免疫学诊断方法[J].世界华人消化杂志,2006,14:3487-3492.
[8]Smith H V,Cacci S M,Cook N,et a1.Cryptosporidium and Giardia as foodborne zoonoses[J].Vet Parasitol,2007,149(1-2):29-40.
[9]Scaramozzino P,Cave D D,Berrilli F,et al.A study of the prevalence and genotypes of Giardia duodenalis infecting kennelled dogs[J].Vet J,2009,182(2):231-234.
[10]CacciòS M,Thompson R C,Mclauchlin J,et al.Unravelling Cryptosporidium and Giardia epidemiology[J].Trends Parasitol,2005,21(9):430-437.
[11]肖淑敏,李国清,王 波,等.我国首株牛源贾第虫的分子鉴定[J].中国人兽共患病学报,2006,22(9):861-863.
[12]朱海波,李国清,张 萍,等.广东首株犬源贾第虫的基因型鉴定[J].中国兽医科学,2011,41(2):143-147.
[13]Minvielle M C,Molina N B,Polverino D,et al.First genotyping of Giardia lamblia from human and animal feces in Ar-gentina,South America[J].Mem Inst Oswaldo Cruz,2008,103(1):98-103.
[14]CacciòSM,De Giacomo M,Pozio E.et al.Sequence analysis of beta-giardin gene and development of a polymerase chain reaction-restriction fragment length polymorphism assay to genotype Giardia duodenalis cysts from human faecal samples[J].Int J Parasitol,2002,32(8):1023-1030.
[15]Lalle M,Pozio E,Capelli G,et al.Genetic heterogeneity at theβ-giardin locus among human and animal isolates of Giardia duodenalis and identification of potentially zoonotic subgenotypes[J].Int J Parasitol,2005(2):35:207-213.
