田七总皂苷的制备及其免疫活性试验*
2012-05-31谢丽丽胡庭俊潘贵珍苏子杰
谢丽丽,胡庭俊,潘贵珍,苏子杰
(广西大学动物科学技术学院,广西南宁 530005)
田七(Panaxnotoginseng(Burk)FH Chen))又名三七、金不换、田七参、人参田七等[1],属五加科人参属植物,主产于云南、广西及四川等地,是我国的传统珍贵药材。田七含有皂苷、倍半萜、脂肪酸、酯类、苯取代物、烷烃等多种有效成分[2],其中皂苷是田七的主要有效成分,总皂苷含量为12%[3]。田七除了具有传统的止血补血、消肿止痛,双向调节血糖、血脂的功效外,还有抗血栓、抗炎、抗肿瘤等作用[4],具有广阔的开发应用前景。田七主要活性成田七总皂苷(Panaxnotoginsengsaponins,PNS)近年来国内外有不少研究报道田七总皂苷具有改善心肌缺血、抗心律失常、降血脂、降血压、降血糖、抗纤维化、抗氧化、改善微循环、抗炎镇痛等功效作用[5-7],但其对免疫功能影响研究报道相对较少。本试验从田七中分离纯化出田七总皂苷,进行薄层色谱鉴定及含量测定,观察田七总皂苷对小鼠机体免疫功能的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 60只昆明系健康小鼠,雌雄各半,平均体重为18g~22g,购自广西医科大学实验动物中心。
1.1.2 主要药物与试剂 田七(60头)购于广西南宁湘乡大药房(原产地:云南)。D101型大孔吸附树脂,天津市光复精细化工研究所生产。人参皂苷Rg1、三七皂苷R1和人参皂苷Rb1标准品,购于中国药品生物制品检定所。薄层板H,青岛海洋化工厂生产(规格:10cm×10cm×5cm),批号20110608。注射用环磷酰胺(CTX),江苏恒瑞医药股份有限公司生产(批号,10082521)。小鼠IL-2、IFN-γ和TNF-αELISA试剂盒,均购自南宁博仁生物有限公司。
1.2 方法
1.2.1 田七总皂苷制备
1.2.1.1 700mL/L乙醇回流提取 取100g田七粉末装入圆底烧瓶中,加700mL/L乙醇1 000mL,浸泡0.5h,90℃水浴回流2h。收集滤液,再加700mL/L乙醇800mL,回流1.5h。收集滤液,并将两次滤液合并。用旋转蒸发仪回收乙醇,将剩余的少量液体于蒸发皿挥发至膏状,然后冷冻干燥得皂苷粗提物。
1.2.1.2 大孔树脂分离纯化 称取预处理好的D101型大孔树脂10g(干重),湿法装柱,药液(浓度6.5mg/mL)以2mL/min流速通过树脂柱,收集流出液,直至达到吸附平衡。用50g/L香草醛-冰醋酸判定平衡终点。水洗,以Molish反应判定水洗终
点。然后用800mL/L乙醇以2mL/min进行洗脱,收集流出液,用50g/L香草醛-冰醋酸判定洗脱终点。回收洗脱液中乙醇,剩余少量浓缩液进行冷冻干燥,得到较纯田七总皂苷。
1.2.2.1 硅胶板活化 使用前将购买的硅胶H板放置105℃活化30min以上。
1.2.2.2 供试品制备 取待检样品粉末10mg,加甲醇1mL使溶解完全,作为供试品。
1.2.2.3 对照品制备 另取人参皂苷Rb1,人参皂苷Rg 1及三七皂苷R1,加甲醇制成每1mL各含0.5mg的混合液,作为对照溶液。
1.2.2.4 点样及展开 吸取上述两种溶液各0.8μL,分别点于同一硅胶H薄层板上,以三氯甲烷-乙酸乙酯-甲醇-水(15∶40∶22∶10)10℃以下放置的下层溶液为展开剂,展开,取出,晾干。
1.2.2.5 显色 均匀喷以硫酸溶液(100mL/L浓硫酸),在105℃加热至斑点显色清晰。观察供试品色谱中,在与对照色谱相应的位置上,是否有对应的斑点,置紫外光灯(365nm)下检视,是否显相同颜色的荧光斑点。
1.2.3紫外分光光度法测总皂苷含量
本研究所有的研究对象均为2016年到2018年我院血透中心的所有医护人员,共计选择15名护理人员进行分层管理,根据《护士岗位管理实施方案》的相关规定,并且根据我科的实际情况对于血液透析室的护理人员岗位管理制度进行制定,通过合理的方案进行落实,对于各个层级护理人员岗位职责和工作要求进行落实。
1.2.3.1 对照品溶液制备 精密称取田七皂苷Rg1标准品2.9mg,加甲醇定容至25mL。即为每毫升含0.116mg田七皂苷Rg1的对照品溶液。
1.2.3.2 标准曲线绘制 吸取0.5、1.0、1.5、2.0、2.5mL对照品溶液,分别置于10mL具塞试管中,挥干溶剂。加现配50g/L 香草醛-冰醋酸溶液0.2mL,高氯酸0.8mL,60℃水浴15min,立即置冰水中冷却至室温。加冰醋酸5mL,混匀,放置15min,相应试剂作空白对照。560nm测定吸光度OD[9],以OD值为横坐标(X),对应具塞试管总皂苷的含量(mg)为纵坐标(Y),绘制标准曲线。
1.2.3.3 供试品测定 取供试品溶液0.5mL,水浴挥干,显色,在560nm处测其吸光度值,并根据回归方程计算出田七总皂苷的含量。每个供试品作3个重复,取其平均值。
1.2.4 田七总皂苷对小鼠免疫调节作用
1.2.4.1 试验动物分组与处理 60只小鼠随机分为6组,即Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组、Ⅴ组和Ⅵ组,每组10只,雌雄各半,试验前适应3d。Ⅰ组为空白对照组,每只每天上午腹腔注射0.5mL生理盐水,下午注射0.3mL生理盐水;Ⅱ组为环磷酰胺(Cyclophospamide,CTX)组,上午腹腔注射0.5mL生理盐水,下午腹腔注射CTX 30mg/kg;Ⅲ组~Ⅵ组为药物处理组,上午分别腹腔给药5、25、50、75mg/kg PNS,下午腹腔给药30mg/kg CTX。持续给药7d。
1.2.4.2 测定方法与组织学观察 末次给药后次日,将全部小鼠称重,眼球采血,断颈椎处死,取其胸腺、脾脏称重,计算胸腺指数和脾脏指数。将胸腺、脾脏浸泡在100mL/L甲醛水溶液中固定7d,做组织切片,HE染色,显微镜下观察胸腺和脾脏的组织学变化。从眼球采血得到的血液中分离血清,用ELISA试剂盒按照说明检测血清中IL-2、IFN-γ和TNF-α的水平。
1.2.5 统计学处理 试验数据用SPSS16.0软件进行统计分析。
2 结果
2.1 薄层色谱鉴别结果
图1A、1B分别为日光下、紫外光下色谱图。观察可知,供试品色谱中,在与对照品色谱3个相应的位置上显相同颜色的荧光斑点。表明供试品中含有人参皂苷Rg1、三七皂苷R1、人参皂苷Rb1。
2.2 田七总皂苷含量测定结果
2.2.1 标准曲线 标准曲线见图2。以人参皂苷Rg1标准品作为对照,得到回归方程:y=0.150 1x+0.013 6(R2=0.996 4),表明在0.009 7mg/mL~0.048 3mg/mL范围内线性良好。
2.2.2 总皂苷含量 700mL/L乙醇回流提取得总皂苷含量为38.30%,经大孔吸附树脂纯化后总皂苷纯度明显提高,总皂苷含量为70.52%。
2.3 对小鼠免疫功能的影响
2.3.1 田七总皂苷对小鼠胸腺和脾脏指数的影响
由表1可见,Ⅱ组(环磷酰胺模型组)与Ⅰ组比较,胸腺指数和脾脏指数有明显下降,分别为极显著(P<0.01)和显著差异(P<0.05);Ⅲ组~Ⅵ组(药物处理组)与Ⅱ组相比,胸腺指数与脾脏指数均无显著升高。另外,Ⅲ组、Ⅳ组的脾脏指数与Ⅰ组也无显著差异。
2.3.2 田七总皂苷对血清中细胞因子水平的调节作用 通过ELISA试剂盒检测,3种细胞因子水平变化结果见表2。Ⅱ组血清中IL-2、IFN-γ及TNF-α水平相比Ⅰ组都有所下降,其中IFN-γ水平显著下降(P<0.05)。Ⅲ组~Ⅵ组给予田七总皂苷处理后,IL-2水平呈现随给药剂量增加而升高的趋势,但与Ⅱ组相比各组均无显著差异;IFN-γ水平呈现出先升高后降低,与Ⅱ组比较,Ⅳ组有显著升高(P<0.05);TNF-α水平类似IFN-γ水平的变化趋势,先升高后降低,与Ⅱ组比较,Ⅳ组、Ⅴ组TNF-α水平显著升高(P<0.05)。
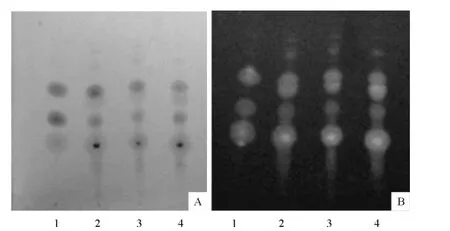
图1 田七总皂苷的薄层鉴别Fig.1TLC identification of Panax notoginsengsaponins
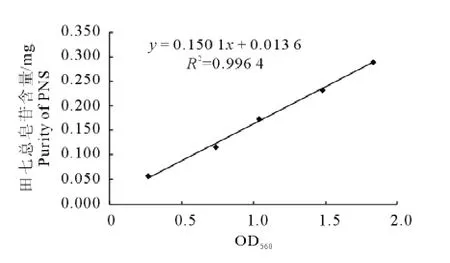
图2 田七总皂苷含量标准曲线Fig.2Standard curve of PNS purity
2.3.3 组织学变化
2.3.3.1 胸腺 在显微镜下可见,Ⅰ组小鼠胸腺分叶明显,皮质与髓质分界清晰,皮质厚而淋巴细胞密度高(图3A);Ⅱ组小鼠胸腺有非常明显的萎缩,其皮质髓质分界较模糊,皮质明显变薄,细胞稀疏(图3B);Ⅲ组、Ⅳ组两个低剂量组与模型组(Ⅱ组)相比,皮质有所增厚,细胞密度也有所增加(图3C、图3D);Ⅴ组、Ⅵ组高剂量组与模型组相比,皮质增厚明显,细胞密度增加也更明显(图3E、图3F)。
2.3.3.2 脾脏 在显微镜下观察脾脏可见,Ⅰ组小鼠脾脏红髓与白髓分界清楚,脾小结大,而且淋巴细胞密集(图4A);Ⅱ组即模型组,其脾脏红、白髓分界相对模糊,脾小结有明显的缩小,淋巴细胞密度下降(图4B);Ⅲ组、Ⅳ组、Ⅴ组和Ⅵ组4个田七总皂苷药物处理组与模型组相比,脾小结都有不同程度的增大,且脾小结数量也有所增多,淋巴细胞密度也有比较明显的增加(图4C、图4D、图4E、图4F)。
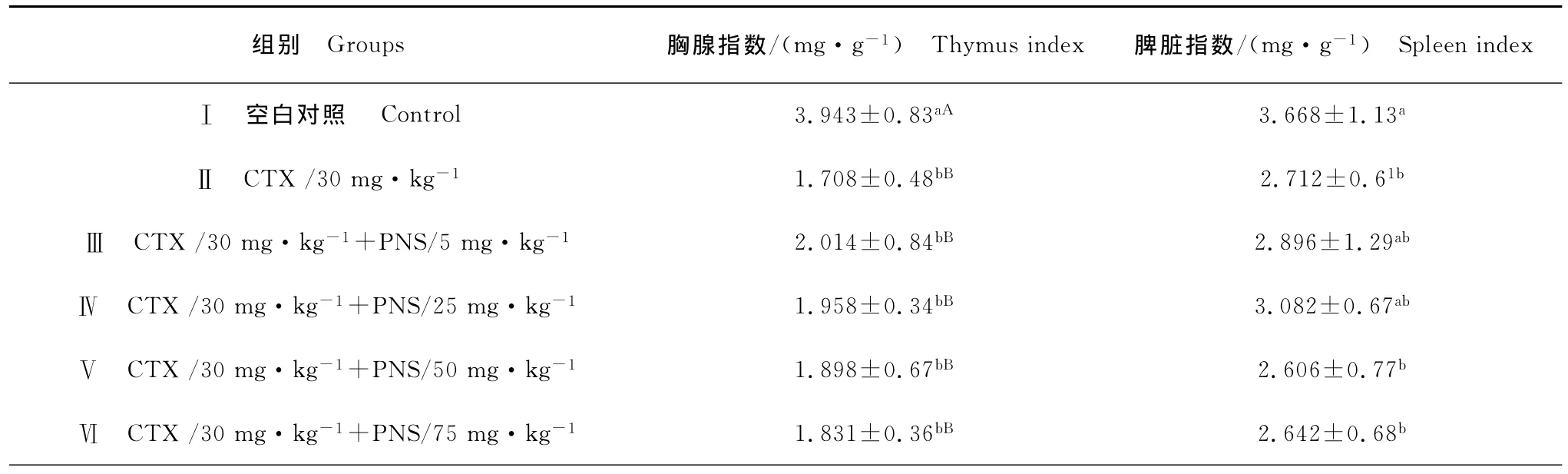
表1 田七总皂苷(PNS)对胸腺和脾脏指数的影响Table 1Effect of Panax notoginsengsaponins(PNS)on the thymus and spleen indices

表2 田七总皂苷(PNS)对血清中IL-2、IFN-γ及TNF-α水平的影响Table 2Effects of Panax notoginsengsaponins(PNS)on IL-2,IFN-γand TNF-αlevels in serum of mice
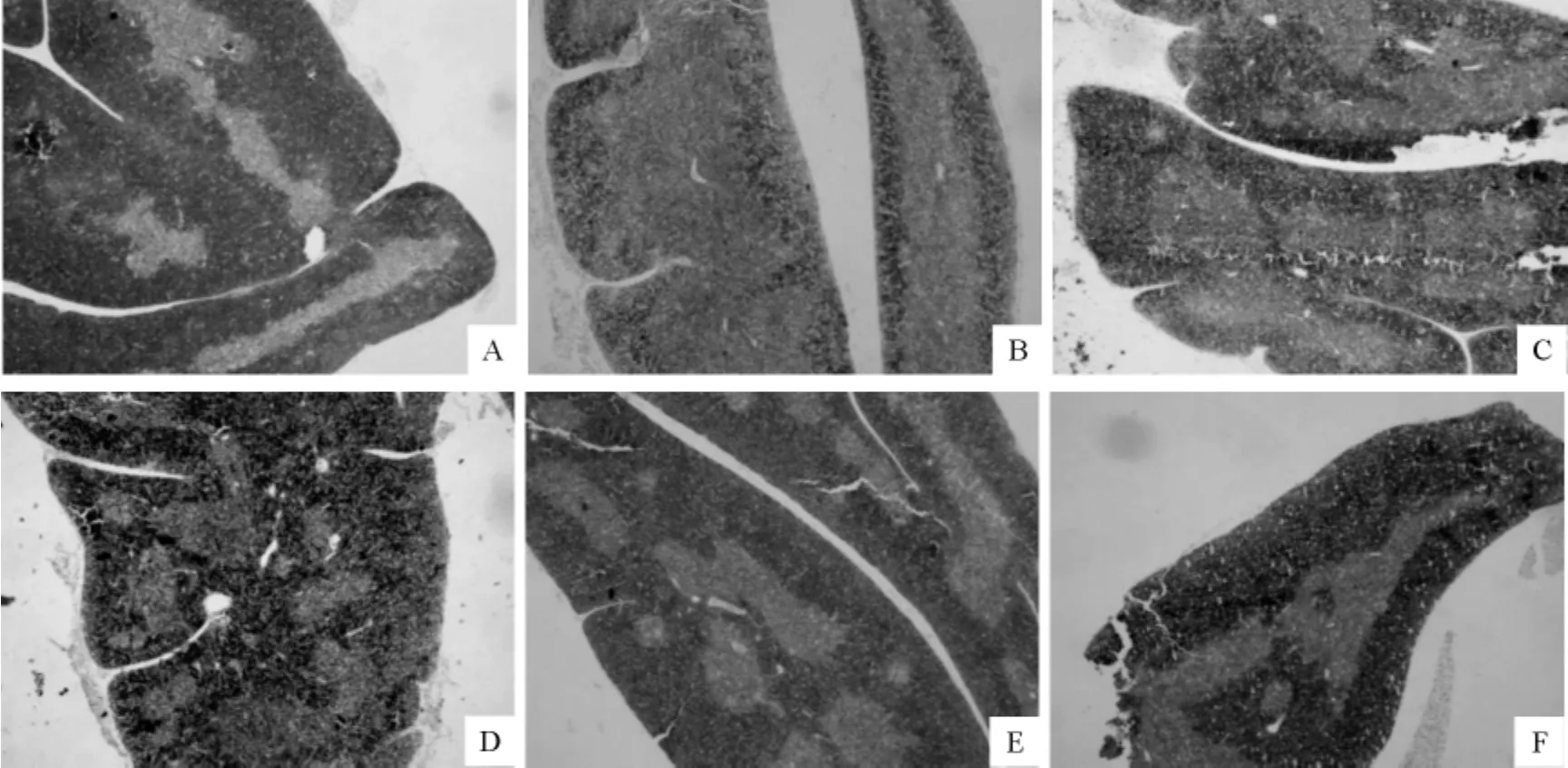
图3 小鼠胸腺组织学变化Fig.3The histological changes in thymus of mice
3 讨论
3.1 田七总皂苷的制备和鉴别
本试验采用传统的乙醇回流法提取田七总皂苷,根据药典对注射剂制备的要求,用新兴并已经得到广泛应用的大孔吸附树脂技术分离纯化皂苷。因影响大孔吸附树脂吸附与洗脱的因素繁多,本试验仅考虑了其中几个主要因素,纯化的最佳条件还有待进一步优化。皂苷成分是田七的主要有效成分,迄今为止,已经从田七的不同部位分离出二三十种单体皂苷成分,其中有很多与同属植物人参相同,其中以人参皂苷Rg1(40%)和 Rb1(35%)含量最高,还含有三七皂苷R1(15%)、R2、R3等田七特有的成分[10-11]。进行薄层色谱鉴别可知,本试验分离纯化得到的田七总皂苷中含有人参皂苷Rg1、人参皂苷Rb1和三七皂苷R1的3种主要成分,并测得总皂苷含量达70.52%。
3.2 免疫调节作用
3.2.1 建立免疫抑制模型 环磷酰胺是临床上常用的细胞毒性化疗药物,其在杀伤肿瘤细胞的同时,可损伤机体的免疫器官,抑制机体的体液免疫和细胞免疫反应,造成免疫功能的低下[12]。在前期试验的基础上,以30mg/kg剂量环磷酰胺腹腔注射给药小鼠,持续给药7d,胸腺、脾脏萎缩明显,成功建立了小鼠免疫抑模型。
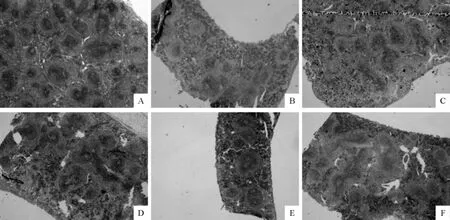
图4 小鼠脾脏组织学变化Fig.4The histological changes in spleen of mice
3.2.2 免疫器官指数与组织形态学影响 胸腺和脾脏是机体内重要的免疫器官。已有研究报道,免疫器官指数能较好的反应机体免疫器官的重量变化,并且能将个体差异的影响最小化。本试验结果表明,田七总皂苷能在一定程度上改善免疫抑制剂造成的胸腺和脾脏萎缩,但没有显著影响。可见PNS对胸腺指数和脾脏指数的恢复没有明显的促进作用。
观察动物免疫器官的变化常选胸腺、脾脏,并且着重观察胸腺皮质厚度,脾脏脾小结的大小。胸腺皮质增厚、脾小结增大、胸腺皮质淋巴细胞和脾淋巴细胞数量增多,提示机体免疫功能的提高[13]。用环磷酰胺造模的小鼠胸腺、脾脏萎缩非常明显,皮质、髓质分界模糊,脾小结缩小、胸腺皮质及脾淋巴细胞数量减少。本研究用田七总皂苷处理后,随着剂量的增加,能逐步改善受损胸腺和脾脏的组织结构,尤其是50mg/kg、75mg/kg两个剂量组,恢复胸腺和脾脏组织结构的效果更明显。结果提示PNS对机体的主要免疫器官胸腺、脾脏有较好改善和刺激作用,至少在一定程度上说明PNS能增强机体免疫功能。
3.2.3 细胞因子水平变化 Th1细胞主要分泌IL-2和IFN-γ等[14]。IL-2是 T 细胞增殖、分化必不可少的细胞因子。IL-2还能促进B细胞、巨噬细胞和NK细胞的功能,是最为重要的免疫调节因子之一。本试验中田七总皂苷处理组均能一定程度升高血清中IL-2水平,但差异不显著。IFN-γ又称Ⅱ型干扰素,主要来源于被激活的淋巴细胞。它能激活巨噬细胞,影响Th1/Th2平衡以及调节抗原呈递细胞,因此对固有免疫应答、适应性体液免疫应答和细胞免疫应答均有重要的影响。25mg/kg剂量组能显著升高血清中IFN-γ水平。肿瘤坏死因子是巨噬细胞被脂多糖(或干扰素)刺激后所产生的一种细胞因子,有α和β两种。低浓度下,TNF-α能增强ICAM-1等黏附分子的表达;高浓度时会造成宿主严重的病理损伤[14]。此外,肿瘤坏死因子还能作用于Th细胞,促进T细胞的活化与扩增。本试验结果提示,25mg/kg和50mg/kg剂量组能显著升高血清中TNF-α水平。总得来说,田七总皂苷处理组能不同程度地影响小鼠血清中IL-2、IFN-γ及TNF-α的水平,从而通过细胞因子水平的变化实现对机体免疫功能的调节。
综合免疫器官指数和组织形态影响以及血清中细胞因子的水平变化,说明田七总皂苷能在一定程度上增强小鼠机体的免疫功能,这与周小玲[15]、孙云[16]、赵鹏等[17]研究结果相一致。
[1]杨红玉.三七生长生理及栽培研究的现状与方向[J].中医药学报,2004,28(4):37-39.
[2]郑光植,杨崇仁 .三七生物学及其应用 [M].北京:科学出版社,1994:1-5.
[3]侯家玉.中药药理学[M].北京:中国中医药出版社,2002.
[4]梁利诚,黄宏光,张万叁.田七的药理作用及其在日化产品中的应用[J].牙膏工业,2001(3):24-27.
[5]马 珂,汤金士.三七皂甙的实验研究进展[J].浙江中西医结合杂志,2002,12(3):197-199.
[6]马逢升.三七在养生保健方面的作用[J].云南中医学院学报,2000,23(1):51-52.
[7]蔡燕玲,梨罕文,杨晓明.三七的药理研究进展[J].陕西中医学院学报,2001,24(5):57-58.
[8]国家药典委员会.中华人民共和国药典一部[S].北京:中国医药科技出版社,2010:11.
[9]秦 枫,刘 靖,陈玉勇,等.三七总皂苷含量测定方法及超声提取工艺研究[J].安徽农业科学,2008,36(8):3062-3063,3231.
[10]卢艳花.中药有效成分提取分离技术[M].北京:化学工业出版社,2008:167.
[11]史作清,施荣富 .吸附分离树脂在医药工业中的应用[M].北京:化学工业出版社,2008:113.
[12]Motoyoshi Y,Kaminoda K,Saitoh O,et al.Different mechanisms for anti-tumor effects of low-and high-dose cyclophosphamide[J].Oneology Report,2006,16(1):141-146.
[13]苗明三,孙艳红,史晶晶,等.熟地黄粗多糖对血虚模型小鼠胸腺和脾脏组织形态的影响[J].中华中医药杂志,2007,22(5):318-320.
[14]高晓明.免疫学教程[M].北京:高等教育出版社,2006:119-124.
[15]周小玲,李永伟,李逢春,等.三七总皂甙对大鼠免疫功能影响的实验研究[J].广西医科大学学报,2001,18(3):360-361.
[16]孙 云,邓阳梅,蔡元培,等.复方三七口服液对小鼠免疫功能和抗氧化功能的影响[J].江苏临床医学杂志,2002,6(6):518-519.
[17]赵 鹏,李 彬,何为涛,等.三七皂甙对小鼠免疫功能影响的实验研究[J].中国热带医学,2004,4(4):522-524.
