红芪替代复芪止汗颗粒中的黄芪对免疫抑制小鼠细胞免疫作用的差异研究
2012-05-26张李峰卫东锋赵春燕程卫东桂曼曼李雪嫣
张李峰, 卫东锋, 赵春燕, 程卫东,3*, 桂曼曼, 李雪嫣
(1.兰州大学基础医学院,甘肃兰州730000;2.兰州大学药学院,甘肃兰州730000;3.北京师范大学资源学院,北京 100009)
红芪替代复芪止汗颗粒中的黄芪对免疫抑制小鼠细胞免疫作用的差异研究
张李峰1, 卫东锋1, 赵春燕2, 程卫东1,3*, 桂曼曼1, 李雪嫣1
(1.兰州大学基础医学院,甘肃兰州730000;2.兰州大学药学院,甘肃兰州730000;3.北京师范大学资源学院,北京 100009)
目的 比较复芪止汗颗粒中用红芪与用黄芪对免疫抑制小鼠的细胞免疫调节作用。方法 小鼠腹腔注射环磷酰胺建立免疫抑制小鼠模型,以相同剂量的红芪替换复芪止汗颗粒中的黄芪后,分别灌胃,通过测定各组的巨噬细胞体外吞噬中性红能力、脾淋巴细胞杀伤活性、T淋巴细胞亚群百分比、血清IL-1β的质量浓度比较两者对环磷酰胺的拮抗作用。结果 环磷酰胺免疫抑制小鼠经复芪止汗颗粒和红芪替换黄芪后的复芪止汗颗粒作用后血清中IL-1β质量分数明显增加;含红芪和黄芪的复芪止汗颗粒通过不同程度地增加小鼠淋巴细胞增殖能力、杀伤活性、T淋巴细胞亚群百分比和腹腔巨噬细胞的吞噬功能发挥拮抗作用。含红芪的复芪止汗颗粒在提高环磷酰胺免疫抑制小鼠的T淋巴细胞增殖能力和血清IL-1β质量分数方面优于含黄芪的复芪止汗颗粒。结论 红芪与黄芪调节细胞免疫方面具有相似作用,且在恢复T淋巴细胞增殖能力方面略优于黄芪。
红芪;黄芪;复芪止汗颗粒;免疫抑制;细胞免疫
中药黄芪作为经典扶正补益中药,是许多复方和中成药的重要成分,故对其需求量很大,又由于当前中药黄芪道地产区的不断变换,来源品种较为复杂[1],种质存在退化现象,很难满足日益发展的中药材市场的需求[2],这就急需扩大药源,寻找一味与之功能相近的中药,以解决药源不足、不纯的现象。
红芪与黄芪均来源于豆科植物,但不同属,黄芪是豆科紫云英属植物,而红芪是岩黄芪属植物,为多序岩黄芪的根。两者均具有益气、补血等功效,均是扶正固本、补中益气的常用中药[3-4]。红芪的主要产地在甘肃省武都、岷县、宕县、舟曲等地,产量约占全国的95%以上,是甘肃优质道地药材之一[5],来源相对较纯,另外其生长对气候条件的要求不是很严格,适宜其生长的气候范围较广,在种植、产量等方面较黄芪具有一定的优势[5]。几千年来中医治病,自古就有以红芪替代黄芪入药的习俗,尤以我国西北地区更为普遍[6-7]。1977年版《中国药典》将红芪列为正品黄芪之一[8]。直至1982年中科院院士肖培根等人将红芪从黄芪中分出。1985年版《中国药典》将红芪作为一味常用补益药而单独分载[9]。
近年来随着对红芪研究以及红芪与黄芪的比较研究的增多,发现两者之间既有共同的成分,又在化学成分的含量和类型等方面存在明显差异,尤其在皂苷类的差异更大[10]。赵健雄等[11]利用高效液相色谱法对红芪和黄芪进行鉴别发现在指纹图谱中红芪有23个特征峰而黄芪有26个,且红芪中毛蕊异黄酮的含有量低于芒炳花素,黄芪则相反;红芪不含黄芪中的黄芪甲苷。Liu等[12]报道黄芪和红芪的黄酮类和皂苷类化合物在结构上存在不同。李瑜等[4]发现红芪染色体的数目为14条,而黄芪为16条[13],这为两者本质上的区分提供了有力的细胞学依据。
现代药理研究结果显示,红芪与黄芪均具有免疫调节作用。同时对两者的效用方面的比较研究结果显示也存在一定差异。胡燕等[14]比较了红芪和黄芪水提物对小鼠的免疫功能影响的差异,结果表明两者均能提高小鼠的免疫功能,而且红芪水提物在部分指标的提高作用上优于黄芪水提物。并且两者体外均能清除自由基,且红芪水提物的作用稍强[15]。余黎等[16]则报道黄芪水提物激活巨噬细胞的作用强于红芪水提物。Wang等[17]发现红芪多糖 (HPS)和黄芪多糖 (APS)均可明显增加腹腔巨噬细胞的数量和C3的沉积,而且注射5次后C3阳性巨噬细胞的比例明显比只注射1次多。毛小娟等[18-19]比较了红芪多糖和黄芪多糖的免疫调节作用,发现两者均能增强正常小鼠和免疫抑制小鼠的免疫功能,且红芪多糖的体液免疫调节作用比黄芪多糖强。Liu等[12]发现黄芪和红芪中的皂苷和黄酮类化合物在免疫效应方面同样存在着一定差异。
而中药复方是以君药为主要药物,通过君、臣、佐、使作用体现复方的整体功效[20],所以基于复方——比较红芪与黄芪的效用至关重要,而目前在复方水平比较红芪与黄芪的免疫调节作用的研究鲜见报道,故本研究以益气固表敛汗的经典复方复芪止汗颗粒为研究对象,在复方水平比较红芪或黄芪的免疫调节作用,为中药复方增强免疫功能寻找新的药对配伍和治疗靶点,同时可弥补红芪药理研究和药用理论的不足。
1 材料
1.1 动物和细胞 健康昆明种小鼠,体质量18~22 g,雌雄各半,购于兰州大学医学动物实验中心,许可证号:SCXK(甘)2009-0004。人髓系白血病细胞株K562由兰州大学实验中心提供。
1.2 药物 复芪止汗颗粒为上海雷允上药业有限公司产品 (国药准字Z31020475)。实验用饮片购于兰州市黄河药材市场,由甘肃农业大学蔺海明教授鉴定合格。参照2010年《中华人民共和国药典》[3]的剂量,并按照体表面积[21]换算为小鼠的剂量即27 g生药/(kg·d)。以相同剂量的红芪替换黄芪后与党参、白术、麻黄根、五味子、牡蛎配制成复芪止汗复方,加入适量水浸泡0.5~1 h,煎煮两次 (1.5 h,1 h),合并滤液,将药物浓缩至每毫升含生药1 g,4℃冷藏备用。环磷酰胺为山西普德药业有限公司产品。
1.3 主要试剂及仪器 改良型RPMI-1640培养液为美国Gibco公司生产;青霉素、链霉素为华北制药有限公司生产;胎牛血清为杭州四季青公司生产;胰蛋白酶为美国Gibco公司生产;台盼蓝为美国Sigma公司生产,小鼠乳酸脱氢酶 (LDH)酶联试剂盒为甘肃鹏程生物科技发展有限公司生产;小鼠IL-1β ELISA试剂盒和EZ-SepTMMOUSE 1X淋巴细胞分离液为深圳达科为生物技术有限公司生产;PE/Cy5-抗小鼠CD4、PE-抗小鼠CD8和FITC-抗小鼠CD3单克隆抗体为Biolegend产品;ConA、MTT为美国sigma公司产品;NP40为Fluka公司产品产;超净工作台为苏州安泰空气技术有限公司产品;二氧化碳培养箱为日本SANYO公司产品;倒置相差显微镜为德国Olympus公司产品;iMark全自动酶标仪为美国BOI-RAD公司产品流式细胞仪为美国贝克曼COULTER公司产品,型号Epics XL;AF2-0502-U型超纯水机为艾科浦公司产品;细胞培养板及血球计数板为西安科昊生物工程有限责任公司产品。
2 方法
2.1 免疫抑制小鼠模型的建立[22]每只小鼠腹腔注射环磷酰胺50 mg/(kg·d),连续7 d,建立免疫抑制小鼠模型。
2.2 分组及给药 取昆明种小鼠40只,随机分为四组:空白对照组、环磷酰胺模型组、复芪止汗颗粒+环磷酰胺模型组 (黄复组)和相同剂量红芪替换黄芪后的复芪止汗水提物+环磷酰胺模型组 (红复组),每组10只。空白对照组给予0.9%生理盐水,中药各组分别给予27 g生药/(kg·d),各组均按10 g/d给予0.2 mL,连续灌胃14 d。
2.3 脾脏淋巴细胞悬液的制备[23]实验第15天,称各组小鼠体质量,眼球摘除采血处死,无菌取脾脏完全按EZ-SepTMMOUSE1X淋巴细胞分离液的说明书进行操作,制备小鼠脾淋巴细胞悬液。
2.4 脾脏淋巴细胞增殖反应的测定[24]取2.3项所得的各组脾脏淋巴细胞悬液,调整细胞密度为1×106个/mL,各样本加6个孔,100 μL/孔,其中三孔加 ConA 100 μL(终质量浓度为 5 μg/mL),三孔不加ConA。37℃,5%CO2培养箱内培养72 h,实验结束前4 h,加MTT 20 μL/孔 (终质量浓度为5 mg/mL),培养结束后,加10%SDS 100 μL/孔,37℃过夜,酶标仪570 nm处测定吸光度A值。计算刺激指数。
刺激指数=实验孔A值/对照孔A值
2.5 脾脏淋巴细胞杀伤活性测定[25]
2.5.1 K562细胞培养及细胞悬液的制备 K562细胞培养于含10%灭活 (56℃,30 min)胎牛血清的1640培养液中,培养液含NaHCO32.0 g/L、青霉素100 U/mL、链霉素100 μg/mL。置于37℃、5%CO2培养箱内培养。细胞呈悬浮状态生长,约2~3 d传代1次。K562细胞活力测定:取传代培养后呈对数生长期的细胞,按常规方法制成单细胞悬液,用0.04%的台盼蓝与细胞悬液1∶1混匀,用WBC计数法计数活细胞数后计算细胞活力。取对数生长期细胞用含10%胎牛血清的1640培养液将细胞密度调整至1×105个/mL备用。
2.5.2 测定脾淋巴细胞杀伤活性 取K562靶细胞悬液 (1×105个/mL)和脾脏淋巴细胞悬液 (5×106个/mL)各100 μL,加入96孔细胞培养板中;同时设靶细胞自然释放孔即加靶细胞悬液和培养液各100 μL,靶细胞最大释放孔即加靶细胞悬液和1%NP-40各100 μL;各样本设三个复孔,37℃、5%CO2培养箱内孵育22 h后,取上清100 μL/孔,严格按乳酸脱氢酶酶联试剂盒说明书进行操作,结果经酶标仪450 nm波长测定各孔吸光度(A)值,按下式计算脾脏淋巴细胞的杀伤活性。计算公式如下:
杀伤活性 =(反应孔A值-自然释放孔 A值)/(最大释放孔 A值 -自然释放孔 A值)×100%
2.6 脾脏T淋巴细胞亚群的测定 取脾脏淋巴细胞悬液,调整细胞密度为1×107个/mL,取100 μL各组脾淋巴细胞悬液 (约含1×106个细胞),加 入 1 μL FITC-抗 小 鼠 CD3+、1.25 μL PE/Cy5-抗小鼠 CD4+和 1.25 μL PE- 抗小鼠CD8+,轻轻旋转混合,4℃避光孵育30 min,洗细胞,细胞沉淀中加入500 μL流式缓冲液,混匀,流式细胞仪检测,分析各组脾淋巴细胞亚群百分比含量。
2.7 腹腔巨噬细胞吞噬中性红功能测定[26]取各组小鼠腹腔液,离心洗涤,调整细胞密度为2×106个/mL。混匀后取细胞悬液100 μL,设3个复孔,37℃,5%CO2培养箱中孵育2 h后,去除培养液,加0.072%中性红溶液100 μL/孔。继续培养3 h后,用无血清的1640培养液洗细胞3次,加细胞裂解液 (无水乙醇-0.1 mol/L冰乙酸=1∶1)100 μL/孔,4℃过夜,酶标仪570 nm处测定吸光度A值。
2.8 血清IL-1β质量浓度的测定 取各小鼠血清,严格按照IL-1 βELISA试剂盒说明书进行操作,在酶标仪450 nm波长下测定各反应孔A值作为检测结果,通过标准品绘制出的标准曲线,计算各样本IL-1β质量浓度,单位为pg/mL。
2.9 数据处理 计量资料以均数±标准差表示,统计学分析采用SPSS17.0统计软件。对各组数据进行单因素方差分析,各组间两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
3 结果
3.1 对脾脏淋巴细胞增殖能力和杀伤活性的影响与空白对照组比较,环磷酰胺能明显降低脾脏淋巴细胞增殖能力 (P<0.01)。与环磷酰胺组比较,黄复组和红复组均能提高免疫抑制小鼠脾脏淋巴细胞增殖能力 (P<0.05,P<0.01),但红复组较黄复组作用显著 (P<0.05)。与空白对照组比较,环磷酰胺模型组脾脏淋巴细胞杀伤活性明显降低(P<0.01)。与环磷酰胺模型组比较,黄复组和红复组均能显著提高免疫抑制小鼠的脾脏淋巴细胞杀伤活性 (P<0.01),但二者比较差异无统计学意义 (P>0.05)。见表1。
表1 黄复组和红复组对淋巴细胞增殖和杀伤活性的影响(±s,n=10)Tab.1 Effect of Hedysari Radix and Astragali Radix alternative Fuqi Zhihan groups on proliferation and cytotoxic activity of lymphocytes(±s,n=10)
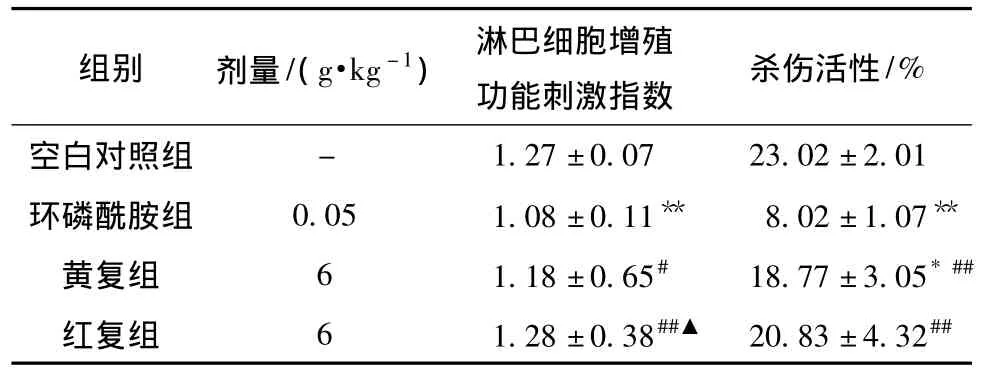
表1 黄复组和红复组对淋巴细胞增殖和杀伤活性的影响(±s,n=10)Tab.1 Effect of Hedysari Radix and Astragali Radix alternative Fuqi Zhihan groups on proliferation and cytotoxic activity of lymphocytes(±s,n=10)
注:与空白对照组比较,*P<0.05,**P<0.01;与环磷酰胺模型组比较,#P<0.05,##P<0.01;与黄复组比较,▲P<0.05。
组别 剂量/(g·kg-1) 淋巴细胞增殖功能刺激指数 杀伤活性/%空白对照组-1.27±0.07 23.02±2.01环磷酰胺组 0.05 1.08±0.11** 8.02±1.07**黄复组 6 1.18±0.65# 18.77±3.05*##红复组 6 1.28±0.38##▲ 20.83±4.32##
3.2 对脾脏T淋巴细胞亚群的影响 与空白对照组比较,环磷酰胺能明显降低小鼠脾淋巴细胞中CD3+、CD4+和 CD3+、CD8+T淋巴细胞亚群的含有量,且CD8+T淋巴细胞含有量降低较为明显,导致CD4+和CD8+T淋巴细胞的比值显著增加 (P<0.01)。与环磷酰胺模型组比较,黄复组和红复组可不同程度的增高免疫抑制小鼠脾淋巴细胞中 CD3+、CD4+和 CD3+、CD8+T淋巴细胞百分比,与环磷酰胺模型组比较差异有统计学意义 (P<0.05),但红复组与黄复组比较差异无统计学意义 (P>0.05)。结果见表2。
表2 黄复组和红复组对免疫抑制小鼠T淋巴细胞亚群的影响(±s,n=10)Tab.2 Effect of Hedysari Radix and Astragali Radix alternative Fuqi Zhihan groups on the T lymphocyte subgroup in immunosuppressed mice(±s,n=10)
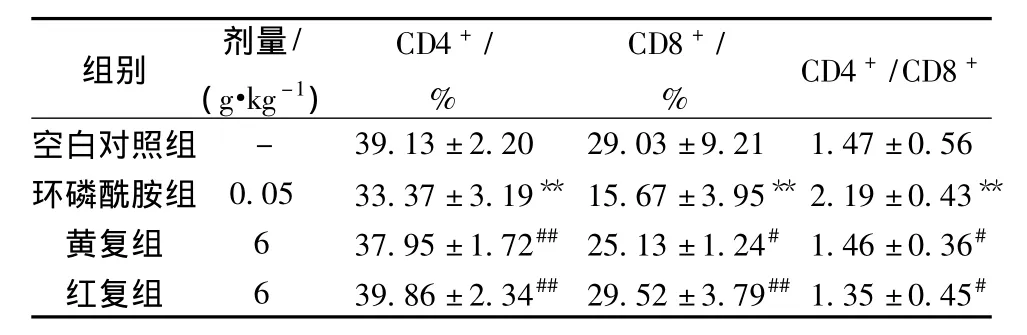
表2 黄复组和红复组对免疫抑制小鼠T淋巴细胞亚群的影响(±s,n=10)Tab.2 Effect of Hedysari Radix and Astragali Radix alternative Fuqi Zhihan groups on the T lymphocyte subgroup in immunosuppressed mice(±s,n=10)
注:与空白对照组比较,**P<0.01;与环磷酰胺模型组比较,#P <0.05,##P <0.01。
组别 剂量/(g·kg-1)CD4+/%CD8+/% CD4+/CD8+空白对照组- 39.13±2.20 29.03±9.21 1.47±0.56环磷酰胺组 0.05 33.37 ±3.19** 15.67±3.95** 2.19±0.43**黄复组 6 37.95±1.72## 25.13±1.24# 1.46±0.36#红复组 6 39.86±2.34## 29.52±3.79##1.35±0.45#
3.3 对小鼠腹腔巨噬细胞吞噬中性红能力的影响与空白对照组比较,环磷酰胺能明显降低小鼠腹腔巨噬细胞的吞噬能力 (P<0.01)。与环磷酰胺模型组比较,黄复组和红复组均能提高免疫抑制小鼠腹腔巨噬细胞体外吞噬中性红的能力 (P<0.05),红复组作用较强 (P<0.01),但仍低于空白对照组 (P<0.05),且红复组与黄复组比较差异无统计学意义 (P>0.05)。见表3。
表3 黄复组和含复组对小鼠腹腔巨噬细胞吞噬中性红能力的影响(±s,n=10)Tab.3 Effect of Hedysari Radix and Astragali Radix alternative Fuqi Zhihan groups on the phagocytosis of mouse peritoneal macrophages(±s,n=10)

表3 黄复组和含复组对小鼠腹腔巨噬细胞吞噬中性红能力的影响(±s,n=10)Tab.3 Effect of Hedysari Radix and Astragali Radix alternative Fuqi Zhihan groups on the phagocytosis of mouse peritoneal macrophages(±s,n=10)
注:与空白对照组比较,*P<0.05,**P<0.01;与空白对照组比较,#P<0.05,##P<0.01。
组别 剂量/(g·kg-1) 吞噬中性红 (A570nm )空白对照组-1.66±0.49环磷酰胺模型组 0.05 0.84±0.10**黄复组 6 1.23 ±0.13**#红复组 6 1.31±0.15*##
3.4 对血清IL-1β的影响 与空白对照组比较,环磷酰胺模型组血清IL-1β质量浓度明显降低 (P<0.01)。与环磷酰胺组比较,黄复组和红复组均能显著提高免疫抑制小鼠血清IL-1β的质量浓度(P<0.01)。与黄复组较相比,红复组作用较强,差异有统计学意义 (P<0.05)。见表4。
4 讨论
复芪止汗颗粒是益气固表敛汗的经典方剂,以黄芪为君药与党参、麻黄根、白术等配伍,具有一定的免疫调节作用。本实验以该方为研究对象,观察红芪与党参、麻黄根、白术、牡蛎、五味子配伍后与原方在免疫调节方面的差异。
表4 黄复组和红复组对巨噬细胞诱生IL-1β的影响 (±s,n=10)Tab.4 Effect of Radix Hedysari and Radix Astragali alternative Fuqi Zhihan groups on the mouse macrophage induced IL-1β production(±s,n=10)

表4 黄复组和红复组对巨噬细胞诱生IL-1β的影响 (±s,n=10)Tab.4 Effect of Radix Hedysari and Radix Astragali alternative Fuqi Zhihan groups on the mouse macrophage induced IL-1β production(±s,n=10)
注:与空白对照组比较,*P<0.05,**P<0.01,与环磷酰胺模型组比较,#P<0.05,##P<0.01,与黄复组比较,▲P<0.05。
组别 剂量/(g·kg-1) IL-1β/(pg·mL-1)空白对照组-129.69±14.5环磷酰胺模型组 0.05 78.73±7.86**黄复组 6 99.69±10.02**##红复组 6 113.77±15.99*##▲
本实验以环磷酰胺免疫抑制小鼠模型作为动物体内受试模型,观察以红芪和黄芪为君药的复芪止汗颗粒对免疫抑制小鼠的免疫功能的影响,首先观察到健康昆明种小鼠腹腔注射环磷酰胺后,小鼠的各项免疫指标均明显降低,表明免疫抑制模型已成功建立。这与免疫抑制剂环磷酰胺的作用位点有关系,环磷酰胺可通过干扰细胞核酸的合成,可能在细胞周期的任何时期均起作用[27],进一步观察可见含黄芪和含红芪的复芪止汗颗粒均可显著提高免疫抑制小鼠的各项免疫指标,表明红芪或黄芪与党参、麻黄根、白术、牡蛎、五味子配伍后均可以改善免疫抑制机体的免疫功能。
MTT法检测淋巴细胞体外增殖反应可以反映机体淋巴细胞增殖能力,T淋巴细胞增殖实验是一种反映细胞免疫功能的常用方法,具有一定的可靠性和简易性等特点[28],本实验结果显示含黄芪和含红芪的复芪止汗颗粒均可以不同程度地促进免疫抑制小鼠T淋巴细胞的增殖,且红复组较黄复组作用明显,能明显逆转环磷酰胺对T淋巴细胞增殖的抑制作用。当K562靶细胞的细胞膜受损后,胞质中的乳酸脱氢酶会释放出来,根据检测含乳酸脱氢酶量的多少可以判断脾淋巴细胞包括NK细胞的杀伤活性[29],本实验结果显示,含红芪和含黄芪的复芪止汗颗粒均能显著提高免疫抑制小鼠的脾脏淋巴细胞杀伤活性,且二者作用无明显差别。实验各组小鼠外周血液的淋巴细胞亚群分布测定结果显示环磷酰胺能明显减少CD4+和CD8+T淋巴细胞数量,给予含红芪或含黄芪的复芪止汗颗粒一段时间后,CD4+及CD8+T淋巴细胞数量均明显回升,并接近空白对照组水平,说明二者均能改善免疫抑制小鼠的T淋巴细胞亚群的失衡。
巨噬细胞是诱发细胞免疫应答的重要细胞,能够增强局部组织对环境污染物及细菌的防御能力[30],本实验结果表明黄复组和红复组均能显著提高环磷酰胺引起的腹腔巨噬吞噬能力的降低,促进免疫抑制小鼠对不利因素的免疫抵抗。IL-1β是一种多效应细胞因子,可以作用于巨噬细胞和Th细胞,在固有免疫应答和适用性免疫与应答中均发挥重要作用[31],本实验结果显示黄复组或红复组可使免疫抑制小鼠血清IL-1β的质量浓度明显增加,且红复组的作用较强,表明红芪和黄芪与党参、麻黄根、白术、牡蛎、五味子配伍后对促进巨噬细胞吞噬能力的作用相近;同时红复组脾T淋巴细胞增殖能力增加可能与血清中IL-1β质量分数增多有关系,具体作用机制还有待于在分子水平进一步深入探讨。
本研究通过比较含红芪与含黄芪的复芪止汗颗粒对免疫抑制小鼠的细胞免疫调节作用,结果表明二者在增强细胞免疫调节功能方面作用相近,同时红复组在恢复脾脏T淋巴细胞增殖方面优于黄复组。因此,红芪替换复方中的黄芪具有一定科学性,尤其在免疫调节方面。另外有关红芪和黄芪在其它复方中能否替代仍需进一步的深入研究。
[1]张 继,徐纪民,赵京春,等.黄芪的本草考证[J].中国药师,1999,2(4):211-213.
[2]赵 明,段金廒,黄文哲,等.中国黄芪属(AstragalusLinn.)药用植物资源现状及分析[J].中国野生植物资源,2000,19(6):5-9.
[3]国家药典委员会.中华人民共和国药典:2010版一部[S].北京:中国医药科技出版社,2010.
[4]李 瑜,蔺海明,程卫东,等.红芪染色体数目及核型分析[J].科技导报,2010,28(1):40-43.
[5]程卫东,王永炎,蔺海明,等.红芪生长和干物质规律及对施坡缕石和肥料的响应[J].中药材,2010,33(5):657-661.
[6]金智生,孙丹凤,汝亚琴,等.红芪多糖对实验糖尿病胰岛素抵抗大鼠脑组织SOD和MDA的影响[J].甘肃中医学院学报,2011,28(1):5-9.
[7]郑海金,王 勤,侯世勇,等.甘肃武都米仓山红芪研究-Ⅱ.红芪水提液对机体免疫功能的作用[J].兰州大学学报:自然科学版,1991,27(1):82-85.
[8]中华人民共和国卫生部药典委员会.中华人民共和国药典:1977版一部[S].北京:人民卫生出版社,1978.
[9]中华人民共和国卫生部药典委员会.中华人民共和国药典:1985版一部[S].北京:化学工业出版社,1985.
[10]Liu Y,Zhang X,Zhao Y,et al.Comparative chemical analysis ofRadix AstragaliandRadix Hedysariby HPLC[J].Nat Prod Res,2011,DOI:10.1080/14786419.2011.619188.
[11]赵健雄,封士兰,胡芳弟,等.中药材黄芪与红芪的色谱鉴别法[J].分析测试技术与仪器,2005,11(1):46-50.
[12]Liu J,Hu X,Yang Q,et al.Comparison of the immunoregulatory function of different constituents inRadix AstragaliandRadix Hedysari[J].J Biomed Biotechnol,2010,DOI:10.1155/2010.479426.
[13]吴松权,王立平,孙丽娜,等.黄芪染色体核型分析[J].湖北农业科学,2006,45(5):631-33.
[14]胡 燕,程卫东,刘 欣,等.红芪和黄芪水提物对小鼠免疫功能影响的差异[J].北京中医药大学学报,2011,34(9):623-626.
[15]杨小虎,郭延生,曲亚玲,等.红芪、黄芪水提液体外清除自由基作用的研究[J].甘肃农业大学学报.2010,45(4):42-45,50.
[16]余 黎,曹 宜,魏 筱,等.黄芪与红芪不同提取液免疫调节作用研究[J].安徽农业科学,2010,38(36):20623-20627.
[17]Wang J,Ito H,Shimura K.Enhancing effect of antitumor polysaccharide fromAstragalusorRadix Hedysarumon C3 cleavage production of macrophages in mice[J].Jpn J Pharmacol,1989,51(3):432-434.
[18]毛小娟,王军志,王凤连,等.红芪多糖和黄芪多糖的免疫调节作用[J].中国药理学通报,1989,5(6):367-372.
[19]毛小娟,王军志,王凤连,等.红芪多糖和黄芪多糖对小鼠体液免疫功能的影响[J].中国免疫学杂志,1988,4(3):158-164.
[20]陈冠林,许仕杰,周福生,等.基于“药性-功效知识元语义分析”探析中药复方的整体功效[J].辽宁中医杂志,2011,38(7):1260-1264.
[21]黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[22]张 蕾,郭红卫,吴 岷,等.建立小鼠免疫功能低下模型的研究[J].环境与职业医学,2003,20(2):95-98.
[23]张李峰,蒲建中,鲍英存,等.比较同一复方中用红芪与用黄芪对免疫抑制小鼠淋巴细胞和TH1TH2型细胞因子的影响[J].免疫学杂志,2012,28(3):212-216.
[24]薄华本,邵红伟,胡凌波,等.细胞活性检测方法优化[J].中国实用医药,2008,3(21):1-2.
[25]冯永辉,王庆辉,王美茹,等.黑大蒜提取物对小鼠细胞免疫应答影响的初步探讨[J].中国免疫学杂志,2010,26(11):982-9856.
[26]周 华,陈建南,刘 良,等.作用温和中药复方药效学评价的药理模型探讨[J].中药新药与临床药理,2000,11(6):377-379.
[27]包晶晶,林海霞,马 璟,等.CFSE示踪与流式细胞仪检测法研究环磷酰胺对T淋巴细胞增殖的影响[J].中国药理学通报,2010,26(6):828-831.
[28]Herold K C,Pescovitz M D,McGee P,et al.Increased T cell proliferative responses to islet antigens identify clinical responders to anti-CD20 monoclonal antibody(rituximab)therapy in type 1 diabetes[J].J Immunol,2011,187(4):1998-2005.
[29]Moodley K,Angel C E,Glass M,et al.Real-time profiling of NK cell killing of human astrocytes using xCELLigence technology[J].Neurosci Methods,2011,200(2):173-180.
[30]Kaczmarek M,Nowicka A,Kozłowska M,et al.Evaluation of the phenotype pattern of macrophages isolated from malignant and non-malignant pleural effusions[J].Tumour Biol,2011,32(6):1123-1132.
[31]Weber A,Wasiliew P,Kracht M,et al.Interleukin-1β (IL-1β)processing pathway[J].Sci Signal,2010,3(105):2.
Differences of Hedysari Radix and Astragali Radix alternative in Fuqi Zhihan Granules on immunity in immunosuppressed mice
ZHANG Li-feng1, WEI Dong-feng1, ZHAO Chun-yan2, CHENG Wei-dong1,3*, GUI Man-man1,LI Xue-yan1
(1.School of Basic Medical Sciences,Lanzhou University,Lanzhou 730000,China;2.School of Pharmacy,Lanzhou University,Lanzhou 730000,China;3.College of Resources Science&Technology,Beijing Normal University,Beijing 100009,China)
AIMTo comparatively study the differences of Fuqi Zhihan Granules on immunosuppressed mice in cellular immunity in the substitution of Hedysari Radix for Astragali Radix.METHODSMice injected intraperitoneally with cyclophosphamide were modeled into the immunosuppressed mouse and intragastrically administered with the same dose of Hedysari Radix replaced by Astragali Radix in Fuqi Zhihan Granules through the determination of macrophages in vitro macrophage phagocytic capacity,spleen lymphocyte killing activity,the percentage of T lymphocyte subsets,serum IL-1β level to compare both cyclophosphamide antagonism.RESULTSFuqi Zhihan Granules containing Hedysari Radix and Astragali Radix could significantly increase the level of IL-1β,and antagonize immunosuppressive effect caused by cyclophosphamide,concluding promoting T lymphocyte proliferation,cytotoxic activity of NK cell,quantity of T lymphocyte subgroup,and phagocytosis of the macrophage of varying degrees.Hedysari Radix was superb to Astragali Radix in Fuqi Zhihan Granules in raising T lymphocyte proliferation and IL-1β level.CONCLUSIONHedysari Radix has a similar role in cell immunity regulation with Astragali Radix,and Hedysari Radix has better effect in T cell proliferation.
Hedysari Radix;Astragali Radix;Fuqi Zhihan Granules;immunosuppression;cytoimmunity
R285.5
A
1001-1528(2012)08-1415-06
2011-11-04
中国博士后科学基金资助 (20090450017);中国博士后科学基金特别资助 (201003073);教育部高等学校博士点基金项目(200807330006)
张李峰 (1975—),女,博士生,研究方向:中药免疫学。Tel:13993126931,E-mail:zhanglf@lzu.edu.cn
*通信作者:程卫东 (1963—),男,博士,教授,博士生导师。Tel:(0931)-8915184,E-mail:chengweidong888@sina.com
