甘精胰岛素治疗的时间韵律
2012-05-26中南大学湘雅二医院代谢内分泌研究所戴如春胡世弟曾雅琳
中南大学湘雅二医院代谢内分泌研究所 戴如春 胡世弟 曾雅琳
最新的糖尿病流行病学调查结果显示[1],中国糖尿病患病率已达9.7%。强化血糖控制最好的方法是最大程度模拟生理性胰岛素的分泌模式,模拟餐时胰岛素分泌多用短效胰岛素或作用更快的速效胰岛素类似物,而模拟生理性基础胰岛素分泌则要求持续时间较长(如24h)、降糖作用平稳且不为其他因素影响。传统的基础胰岛素(如NPH胰岛素)因其具有吸收变异度大、作用时间短、作用峰值明显、低血糖发生率高,正在被日益广泛使用的长效胰岛素类似物所取代。甘精胰岛素作为第一个通过DNA重组技术生产的长效胰岛素类似物,美国食品和药品监督管理局(FDA)和欧洲药品产品评审委员会(EMEA)分别于2000年4月和6月,批准其用于治疗1型糖尿病(年龄>6岁)和2型糖尿病[2]。本文主要探讨甘精胰岛素的药代动力学特点及其临床疗效。
甘精胰岛素24h平稳降糖的特点
理想的基础胰岛素应具备以下特点:①药代动力学曲线平坦,无明显吸收高峰。②低血糖发生频率低。③作用持续时间能覆盖24h,满足1天1次使用。④变异度低,能较好地适应患者的生活习惯。⑤制剂为澄清溶液,注射前无须重新混合。甘精胰岛素作为一种新型的长效胰岛素类似物,通过分子结构的改变使其内部的稳定性增强,并在酸性环境(pH4.0)完全溶解,吸收过程延缓[3],降低血糖作用平稳而持久,1天1次注射,可维持24h作用,无明显峰值出现,模拟人体基础胰岛素分泌模式,并且低血糖发生率较低。
Lepore[4]等的研究首次提出甘精胰岛素的药效时间为22±4h,且无明显峰值效应,与持续皮下胰岛素输注的作用曲线类似。其后几乎所有在健康人、1型糖尿病和2型糖尿病患者进行的研究都表明,甘精胰岛素的时间-作用曲线平坦,无明显峰值。也有人对Lepore等的研究中对甘精胰岛素的时间-作用曲线平坦、无明显峰值这一描述提出质疑,提出用“消长变化”[5]或“轻微上升和下降”[6]来描述更贴切。一项单中心、随机、双盲剂量-作用研究表明[7]:单次皮下注射持续作用至少24h,随着剂量的变化(0、0.5、1.0、1.5和2.0IU/kg)时间-作用曲线仍然平坦,无明显峰值出现,这一点说明甘精胰岛素的作用受剂量的影响较小。
在作用持续时间方面,Heise和Pieber[6]等根据检索到的10个关于地特胰岛素与甘精胰岛素钳夹试验,进行综述分析表明,在0.35~0.8IU/kg的临床相关剂量范围内,地特胰岛素与甘精胰岛素的平均作用时间在1型糖尿病中接近24h,而在2型糖尿病中至少24h,研究同时也证明,甘精胰岛素单次注射时作用持续时间为22~24h,稳态条件下可达24~25.6h,这反映了甘精胰岛素在治疗初始阶段会在体内有轻度的蓄积。而这一推想与另一项由15名1型糖尿病患者参与的为期12天的试验结论相违背,该研究通过1天1次注射固定剂量甘精胰岛素,在给药的第1、4、11天,每小时测定患者游离血清胰岛素和血糖浓度,结果显示,这3天的游离血清胰岛素水平和其他药代动力学参数无明显变化,提示1天1次注射甘精胰岛素不会引起蓄积作用[8]。
此外,有研究表明甘精胰岛素不同部位(如:腹部、大腿、臀部等)注射对降糖效果影响不大[9]。一项由Peter[10]等进行的研究表明,30min的运动对1型糖尿病患者甘精胰岛素体内的吸收无影响。 在注射时间方面,有研究表明早餐前、晚餐前或睡觉前使用甘精胰岛素有着相同的疗效和安全性,因而使用较灵活[11]。甘精胰岛素不受注射部位、运动等的影响,且注射时间灵活,作用时间长达24h,且无明显峰值,夜间低血糖发生率低,1天1次注射更好地适合24h平稳降糖治疗。
三种基础胰岛素药代动力学及临床应用
1.三种基础胰岛素药代动力学特征
NPH胰岛素是将重组人胰岛素与锌和鱼精蛋白混合,从而延缓其作用时间,用前需要混匀。其经皮下注射后平均1.5h起效,4~12h达峰,作用持续18~24h。常用于睡前给药以控制夜间和清晨空腹血糖。NPH胰岛素的作用时间虽得到延长但仍不足24h,且存在明显峰效应,吸收不稳定,不利于血糖的平稳控制,与生理性基础胰岛素分泌模式有着不小的差距。与NPH胰岛素相比,甘精胰岛素具有以下特点:①皮下注射后甘精胰岛素的吸收类似于生理状态下的基础胰岛素分泌模式,为平稳无峰值或峰值较小的血药浓度/时间谱;②1天注射1次,有效作用时间可以维持24h以上;③不同注射部位吸收变异率小;④甘精胰岛素溶液不是混悬液,注射前不需要摇匀。
一项为期2周的随机、双盲、交叉研究中从药代动力学方面对甘精胰岛素与地特胰岛素进行比较,24名1型糖尿病患者,随机接受0.35IU/kg甘精胰岛素或地特胰岛素皮下注射,采用葡萄糖钳夹,将血糖钳夹在100mg/dl,持续24h。研究对两种基础胰岛素的作用时间进行了比较,结果显示,地特胰岛素作用结束时间为17.5h,甘精胰岛素的作用结束时间为24h;地特胰岛素的有效作用持续时间仅为15.5h,甘精胰岛素的有效作用持续时间为24h。这说明,甘精胰岛素的作用时间长达24h,显著长于地特胰岛素。而在葡萄糖输注率(GIR)方面,前12h内两者基本上相似,但在12~24h,地特胰岛素的GIR降低速率显著快于甘精胰岛素(P<0.001),甘精胰岛素的稳定性占优。同时甘精胰岛素24h血糖水平始终稳定于103±3.6mg/dl,并且全部受试者完成研究;而地特胰岛素在16h后,血糖水平逐渐升高,且仅33%的患者完成研究。研究还观察了两种基础胰岛素的胰岛素活性覆盖时间,结果显示,0~24h,甘精胰岛素的总体胰岛素活性显著高于地特胰岛素;深入分析0~12h、12~24h的胰岛素活性,结果显示:1~12h,二者的胰岛素活性相似;12~24h,甘精胰岛素活性显著高于地特胰岛素。这说明,甘精胰岛素活性足以覆盖24h,显著优于地特胰岛素[12]。另一项在1型糖尿病和2型糖尿病患者多项钳夹实验中甘精胰岛素或地特胰岛素的药效学曲线对比发现,甘精胰岛素作用峰值相对不明显,作用时间维持至少24h,与剂量无明显关系,注射16h后,仍保持较强的降糖作用。而地特胰岛素作用峰值相对较明显,作用时间与剂量呈一定关系,较大剂量时维持24h,较小剂量时不足24h,注射16h后不论何种剂量及糖尿病类型,降糖作用降低显著[6]。由Porcellati[7]等综合多项研究也表明,地特胰岛素作用持续时间与剂量明显相关,因此要达到24h平稳降糖,地特胰岛素可能需要1天2次或多次给药。
Lucidi[13]等采用随机、单盲、三组交叉实验,在2型糖尿病患者中观察地特胰岛素、甘精胰岛素、NPH胰岛素的药代动力学和药效学差异。18例2型糖尿病应用NPH胰岛素和口服降糖药的患者,为期2周的导入期,期间继续治疗,随机分成3组分别给予不同基础胰岛素治疗1周,然后进行正葡萄糖钳夹实验32h,3组交叉,再洗脱1周,洗脱期采用NPH胰岛素和口服降糖药治疗。研究显示,甘精胰岛素较地特胰岛素、NPH胰岛素有较高的葡萄糖输注率(GIR),甘精胰岛素32h GIR的曲线下面积(AUC)大于NPH胰岛素(高31%)和地特胰岛素(高42%)。有研究进一步证实,在不同体质指数(BMI)患者中,甘精胰岛素较地特胰岛素、NPH胰岛素均有较高的葡萄糖输注率。在作用持续时间方面,甘精胰岛素更长,且个体间变异度甘精胰岛素较低,上述结果均提示,甘精胰岛素较地特胰岛素、NPH胰岛素更好的维持全天血糖平稳。但三者在降HbA1c和空腹血糖方面无显著性差异。此外,甘精胰岛素在抑制胰高糖素内源性C肽、游离脂肪酸等方面的作用也强于地特胰岛素,但地特胰岛素在减少糖尿病患者体重增加方面较甘精胰岛素和NPH胰岛素具有独特的优势。
综上所述,在1型和2型糖尿病患者及健康受试者中,常规剂量以上的甘精胰岛素均可以较平稳地作用24h、且无明显峰值;地特胰岛素在1型糖尿病患者中作用持续时间约16h,而在2型糖尿病患者中仅较大剂量时可能作用24h,但较小剂量(<0.4IU/kg) 时不能维持24h,无论何种剂量、何种糖尿病,在注射16h后作用均明显下降。NPH胰岛素则变异性较大,相对不稳定。
2.三种基础胰岛素在临床中的应用
2.1 注射时间 甘精胰岛素注射时间更灵活。一项为期24周的多国、开放、随机研究,624例口服降糖药(OAD)控制不佳的2型糖尿病患者接受早间或睡前甘精胰岛素加格列美脲治疗,比较不同时间给药后患者夜间低血糖事件的发生率及注射时间对空腹血糖(FBG)控制的影响,结果表明:早餐前或睡前注射甘精胰岛素,空腹血糖(FBG)控制相似,血糖谱差异不明显,夜间低血糖事件的发生率也基本一致[14]。另一项为期20周的多中心、随机、开放、三组交叉、平行组试验在欧洲和美国的91个中心展开。主要研究终点在血糖控制不佳的2型糖尿病患者中比较地特胰岛素和1天2次NPH胰岛素加一种或多种口服降糖药的疗效和耐受性,以及评估不同时间注射地特胰岛素的疗效。结果显示,地特胰岛素早餐前注射,空腹血糖(FBG)控制弱于睡前注射[15]。
2.2 注射次数 甘精胰岛素注射次数更少。甘精胰岛素具有长效作用,可以1天1次固定时间皮下注射给药;地特胰岛素与口服降糖药联合使用时,推荐初始治疗方案为1天1次给药,而当地特胰岛素作为基础-餐时胰岛素给药时,根据患者情况1天1次或2次注射给药;NPH胰岛素作用时间较短,1天1次常常不能有效控制全天血糖,且夜间低血糖发生率高,需每天多次给药[9]。
2.3 注射剂量 甘精胰岛素注射剂量更少。一项RCT荟萃分析表明:在2型糖尿病患者中,达到相似血糖控制,甘精胰岛素(1天1次注射给药)与地特胰岛素(1天1次或2次注射给药)、NPH胰岛素(1天1次或2次注射给药)相比所需胰岛素剂量更少[16]。
2.4 血糖变异 平均血糖漂移幅度、空腹、晚餐前血糖变异系数无明显差异,在日内/日间血糖变异方面甘精胰岛素优于地特胰岛素。一项随机、交叉、开放、单中心研究,11例使用基础(NPH)-餐时治疗的糖尿病患者(6例1型糖尿病,5例2型糖尿病),将NPH胰岛素等剂量随机转换为甘精或地特胰岛素睡前注射,然后交叉期间胰岛素剂量及其它降糖治疗不变,72h血糖监测比较降糖效力及血糖变异度,结果显示:平均血糖水平,甘精胰岛素组明显低于地特胰岛素组(9.6±2.4 vs 10.4±2.8mmol/L,P=0.038),血糖控制差异主要发生于晚间;标准差(SD)与平均日间血糖差异(MODD)在甘精胰岛素组中最小,而平均血糖漂移幅度(MAGE)两组无明显差异,因此甘精胰岛素日内/日间血糖变异度更小[17]。一项随机、交叉、多中心研究,88例使用基础(甘精胰岛素)-餐时治疗的1型糖尿病患者,餐时胰岛素为谷赖胰岛素,先用甘精胰岛素、地特胰岛素分别给两组睡前注射16周,然后再等剂量转换交叉治疗16周,期间胰岛素剂量依据空腹、餐前、餐后1~2h及睡前血糖水平调整以每交叉期后8周内空腹血糖变异系数作为主要终点,晚餐前血糖(PDBG),平均血糖漂移幅度(MAGE)及平均日间血糖差异(MODD)为次要终点,结果显示:两组空腹血糖变异系数,晚餐前血糖(PDBG),平均血糖漂移幅度(MAGE)无明显差异[18]。另一项为期26周、多中心、开放、随机、平行研究,320例使用胰岛素治疗的1型糖尿病患者,随机分为基础(1天1次甘精胰岛素或1天2次地特胰岛素)-餐时(门冬胰岛素),依据空腹血糖调整甘精胰岛素剂量,依据空腹、晚餐前血糖调整地特剂量,餐时剂量经调整后不变,以HbA1c较基线变化及低血糖发生率为主要观察指标,同时观察9点血糖谱(三餐前后、睡前、凌晨2点、4点血糖)结果表明:两组个体内血糖变异系数相似[19]。
2.5 全天血糖谱 一项双盲、随机、交叉研究比较了1天1次(睡前注射)地特胰岛素和甘精胰岛素的疗效:在相似剂量下,地特胰岛素和甘精胰岛素具有相似24h血糖谱。日间血糖控制无明显差异,但晚餐前后至夜间血糖,甘精胰岛素优于地特胰岛素[20]。
2.6 HbA1c及低血糖风险 一项RCT研究对比甘精胰岛素与地特胰岛素的HbAlc及低血糖风险,结果显示在HbAlc控制和低血糖发生率方面两者差异不明显[21]。在一项头对头、随机、非劣效对照临床实验中,共入组了964名患者,年龄为40~75岁之间。2型糖尿病史为1年以上,且使用降糖药后的血糖控制效果不佳,患者被随机分为甘精胰岛素1天1次组(晚餐后或临睡前注射),或地特胰岛素1天2次组(早餐后和晚餐前注射),并同时服用固定剂量的二甲双胍,为达到主要研究终点(HbAlc低于7%,且无证实的低血糖),甘精胰岛素组患者使用的平均日剂量为43.5IU,而地特胰岛素组则为76.5IU,比甘精胰岛素组高76%(P<0.001)。尽管1天1次甘精胰岛素组的胰岛素剂量较低,却与1天2次地特胰岛素组具有相似的血糖(HbA1c)改善效果和相似的低血糖发生率(分别为27.5%和25.6%,P=0.52)。甘精胰岛素组患者的空腹血糖降低也显著优于地特胰岛素组(甘精胰岛素组为-63.1mg/dl,地特胰岛素组为-57.7mg/dl,P<0.001)。研究显示,对于初次使用胰岛素的2型糖尿病患者,1天1次甘精胰岛素与1天2次地特胰岛素相比 血糖控制效果相同、体重增加稍多、但需要的胰岛素剂量较低。在该研究中,1天1次甘精胰岛素组患者的治疗满意度明显高于地特胰岛素组,而且甘精胰岛素组患者的脱落率较地特胰岛素组低50%以上(4.6% vs 10.1%,P=0.001)。两组的总体低血糖和夜间低血糖发生率相似,但1天1次甘精胰岛素组日间低血糖发生率显著低于1天2次地特胰岛素组(分别为1.06次/患者年和1.64次/患者年,P=0.046)。地特胰岛素组的患者体重增加较少于甘精胰岛素组(分别增加0.6kg和14kg,差异为0.77kg,P<0.001)[22]。Rosenstock等在一项持续28周的多中心开放性研究中,将518例2型糖尿病患者随机分配入甘精组和NPH胰岛素组(1天1次或2次)。结果显示,甘精组和NPH胰岛素组HbA1c水平分别下降0.41%和0.59%(P>0.05),症状性低血糖发生率分别为61.4%和66.8%,但甘精胰岛素组夜间低血糖发生率(26.5%)明显低于NPH胰岛素组(35.5%),且甘精组较NPH组患者体重增加较少,分别为0.4kg和1.4kg(P<0.001)。表明对于2型糖尿病患者,每天睡前1次甘精胰岛素和1天1次或2次NPH胰岛素同样能改善并保持血糖控制,此外,甘精胰岛素治疗的患者夜间低血糖发生率更低,体重增加也较少[23]。
甘精胰岛素应用于不同治疗方案的临床疗效
1.甘精胰岛素联合口服降糖药治疗方案
胰岛素是糖尿病患者最有效的治疗药物之一,它能在不依赖正常胰岛B细胞存在的情况下发挥降糖疗效,适用于疾病的任何阶段。但是在降低血糖时使用的胰岛素剂量越大,体重增加的程度越明显,体重增加会加剧胰岛素抵抗,需要更多的外源性胰岛素补充,形成恶性循环,且能降低胰岛素对糖尿病的疗效。此外,几乎所有的口服降糖药物(OAD)即使在其最大剂量时也只能维持血糖达标一段时间,大部分糖尿病患者需在口服降糖药基础上加用胰岛素治疗[24]。胰岛素联合口服降糖药物方案,胰岛素注射次数、注射剂量较少,体重增加也较少,更适合2型糖尿病患者,因此,有必要将基础胰岛素与不同机制的降糖药物联合起来治疗糖尿病。
二甲双胍主要作用是抑制肝糖输出,主要降低的是空腹血糖和HbA1c水平,在一定程度上能减轻胰岛素抵抗。二甲双胍与基础胰岛素联合治疗能减轻单用基础胰岛素治疗时的体重增加程度,还可以减少胰岛素用量。一项包括了20个随机对照研究的系统评价显示:胰岛素联合口服降糖药治疗能使胰岛素剂量减少43%,且不会导致低血糖事件的增加[25]。噻唑烷二酮类药物通过激活过氧化物酶体增生物激活受体,介导胰岛素敏感相关基因的表达,增加脂肪、肌肉及肝脏等对胰岛素的敏感性,研究显示噻唑烷二酮类药物联用基础胰岛素治疗时,能减少胰岛素的用量,且降糖疗效优于单用基础胰岛素,噻唑烷二酮类药物联用基础胰岛素能起到协同保护胰岛B细胞功能和改善胰岛素抵抗的作用,从而延缓疾病进程,但噻唑烷二酮类药物与基础胰岛素联用时,体重增加程度及水钠潴留更明显。双胍类及噻唑烷二酮类药物作为胰岛素增敏剂主要用于控制空腹血糖,在空腹血糖水平较高的患者中与基础胰岛素联用具有较好的降糖效果。
磺脲类药物主要是通过结合胰岛B细胞上ATP敏感性钾通道,刺激胰岛素分泌来降低血糖水平,磺脲类药物联用基础胰岛素治疗,其降糖疗效优于单用基础胰岛素治疗,且联合治疗能减少胰岛素的用量,但是,磺脲类药物联合胰岛素治疗时,体重增加的程度及低血糖的风险更高。格列奈类药物(包括瑞格列奈和那格列奈)能有效改善胰岛素的一相分泌,与基础胰岛素联用能够起到全面控制血糖的作用,基础胰岛素联合格列奈类药物治疗能恢复进餐时胰岛素的一相分泌。那格列奈结合磺脲类受体快速而短暂,口服那格列奈30min时胰岛素分泌明显增加,1h达高峰,3h后恢复到基础胰岛素水平,因此引发低血糖的风险低,体重增加程度轻,且不会加速胰岛B细胞的凋亡。格列奈类药物的半衰期较短,因而给药次数多。控制空腹血糖的基础胰岛素联合能恢复胰岛素一相分泌进而降低餐后血糖的格列奈类药物,能模拟正常胰岛素分泌模式,因此基础胰岛素联用格列奈类药物是比较合理的方案。α-糖苷酶抑制剂主要通过抑制小肠黏膜上的葡萄糖苷酶,延缓碳水化合物的吸收速率,而摄入的碳水化合物量及其吸收的速率影响餐后血糖水平。阿卡波糖与基础胰岛素联用能同时控制餐后及空腹血糖,且糖苷酶抑制剂治疗不会导致体重增加和低血糖事件。因此,α-糖苷酶抑制剂联合基础胰岛素是一种能全面控制血糖的治疗方案。一项单中心、开放、随机、平行的研究对比了甘精胰岛素联合瑞格列奈与联合阿卡波糖的降糖特点,结果显示,空腹血糖(FBG)、餐后血糖(PPG)、HbA1c、家庭血糖监测水平(HBGM)几乎没有差别,但是阿卡波糖的低血糖发生率和体重增加较低。但此项研究没有对联合方案的药代动力学参数进行分析[26]。
二甲双胍及噻唑烷二酮类药物能改善胰岛素抵抗,增强胰岛素的疗效;磺脲类药物、格列奈类药物、DPP-4抑制剂能起到促进餐时胰岛素分泌的作用;α-糖苷酶抑制剂能减少葡萄糖的吸收。这些口服抗糖尿病药物与基础胰岛素联合应用,胰岛素注射次数、注射剂量减少,体重增加也减少,能起到全面控制血糖的作用,但目前关于基础胰岛素联合口服降糖药物的药代动力学研究较少,开展此类研究有助于临床医生更好的选择降糖方案。
2.甘精胰岛素基础-餐时治疗方案
正常生理胰岛素分泌模式,既有持续性基础胰岛素分泌以保持空腹状态下血糖水平正常,又有进餐后胰岛素分泌迅速增加以控制进餐后血糖水平。基础-餐时治疗方案具有更接近生理胰岛素分泌模式,有效全面降低血糖的作用特点。基于目前临床使用的胰岛素药代动力学性质以及健康人胰岛素分泌的生理特点,在使用胰岛素强化治疗时,通常考虑选择中/长效胰岛素模拟持续小剂量的胰岛素基础分泌模式以控制空腹状态的血糖水平,同时给予短/速效胰岛素模拟快速大剂量的胰岛素餐时追加分泌模式以降低餐后血糖浓度,这是临床经常使用的基础-餐时胰岛素强化治疗方案。糖尿病患者很多需要采用基础-餐时治疗方案进行胰岛素强化治疗,以更好地改善血糖控制,进而减少或延缓糖尿病并发症发生发展。基础-餐时胰岛素治疗方案的实施和调整较为简单。通常情况,基础-餐时治疗方案可通过1天4次注射来实现,即每日三餐前选择短/速效胰岛素、睡前联合1次中/长效胰岛素进行治疗。同时,一些不常用的特殊基础-餐时治疗方案参见表1[27]。
当前,临床使用的基础胰岛素主要包括中效NPH人胰岛素和两种长效胰岛素类似物—甘精胰岛素与地特胰岛素。钳夹研究证实,甘精胰岛素的药效学曲线平坦,并且作用持续时间长达24h,1天1次注射就可以达到良好的血糖控制,同时提供较为可靠、恒定的基础胰岛素浓度而适用于基础-餐时胰岛素治疗方案。以药代动力学为基础观察24h内,甘精胰岛素应用于不同基础-餐时治疗方案中的血药浓度,峰值及疗效方面的变化能够为我们提供临床合理、最佳治疗方案依据。
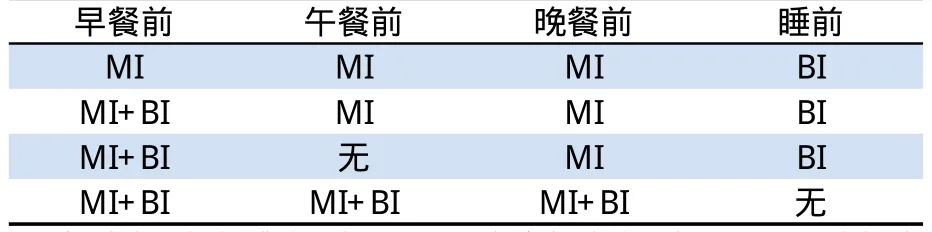
表1 可选择的基础-餐时胰岛素治疗方案
结 语
甘精胰岛素作为一种新型的长效胰岛素类似物,降低血糖作用平稳而持久,1天1次注射给药,可维持24h作用,无明显峰值出现,很好地模拟人体基础胰岛素分泌模式,并且低血糖发生率较低,具有24h平稳降糖的特点。甘精胰岛素与餐前速效胰岛素或口服降糖药联用,能更有效控制血糖,实现血糖达标,但对于甘精胰岛素联合口服降糖药及甘精胰岛素应用于基础-餐时治疗方案的药代动力学特点研究有待进一步开展和评价。
[1]Yang S H, Dou K F, Song W J.Prevalence of diabetes among men and women in China[J].N Engl J Med, 2010, 362(25): 2425-2426.
[2]Mckeage K, Goa K L.Insulin glargine: a review of its therapeutic use as a longacting agent for the management of type 1 and 2 diabetes mellitus[J].Drugs, 2001,61(11): 1599-1624.
[3]Bolli GB, Di Marchi RD, Park GD, et al.Insulin analogues and their potential in the management of diabetes mellitus[J].Diabetologia, 1999, 42(10): 1151-1167.
[4]Lepore M, Pampanelli S, Fanelli C, et al.Pharmacokinetics and pharmacodynamics of subcutaneous injection of long-acting human insulin analog glargine, NPH insulin, and ultralente human insulin and continuous subcutaneous infusion of insulin lispro[J].Diabetes, 2000, 49(12): 2142-2148.
[5]Devries J H.To: Scholtz HE, Pretorius SG, Wessels DH, Becker RHA (2005)Pharmacokinetic and glucodynamic variability: assessment of insulin glargine,NPH insulin and insulin ultralente in healthy volunteers using a euglycaemic clamp technique.Diabetologia 48:1988-1995[J].Diabetologia, 2006, 49(5): 1125-1126.
[6]Heise T, Pieber TR.Towards peakless, reproducible and long-acting insulins.An assessment of the basal analogues based on isoglycaemic clamp studies[J].Diabetes Obes Metab, 2007, 9(5): 648-659.
[7]Porcellati F, Bolli GB, Fanelli CG.Pharmacokinetics and pharmacodynamics of basal insulins[J].Diabetes Technol Ther, 2011, 13 Suppl 1: S15-S24.
[8]Biermann E.No evidence for accumulation of insulin glargine (LANTUS)[J].Diabet Med, 2003, 20(4): 333-335.
[9]Owens DR, Coates PA, Luzio SD, et al.Pharmacokinetics of 125I-labeled insulin glargine (HOE 901) in healthy men: comparison with NPH insulin and the infl uence of different subcutaneous injection sites[J].Diabetes Care, 2000, 23(6): 813-819.
[10]Peter R, Luzio SD, Dunseath G, et al.Effects of exercise on the absorption of insulin glargine in patients with type 1 diabetes[J].Diabetes Care, 2005, 28(3): 560-565.
[11]Grimaldi A, Vialettes B, Blayo A, et al.Comparison of dinner with bedtime administration of insulin glargine in type 1 diabetic patients treated with basalbolus regimen[J].Diabetes Metab, 2007, 33(2): 121-128.
[12]Porcellati F, Rossetti P, Busciantella NR, et al.Comparison of pharmacokinetics and dynamics of the long-acting insulin analogs glargine and detemir at steady state in type 1 diabetes: a double-blind, randomized, crossover study[J].Diabetes Care, 2007, 30(10): 2447-2452.
[13]Lucidi P, Porcellati F, Rossetti P, et al.Pharmacokinetics and pharmacodynamics of therapeutic doses of basal insulins NPH, glargine, and detemir after 1 week of daily administration at bedtime in type 2 diabetic subjects: a randomized crossover study[J].Diabetes Care, 2011, 34(6): 1312-1314.
[14]Standl E, Maxeiner S, Raptis S, et al.Good glycemic control with flexibility in timing of basal insulin supply: a 24-week comparison of insulin glargine given once daily in the morning or at bedtime in combination with morning glimepiride[J].Diabetes Care, 2005, 28(2): 419-420.
[15]Philis-Tsimikas A, Charpentier G, Clauson P, et al.Comparison of once-daily insulin detemir with NPH insulin added to a regimen of oral antidiabetic drugs in poorly controlled type 2 diabetes[J].Clin Ther, 2006, 28(10): 1569-1581.
[16]Swinnen SG, Simon AC, Holleman F, et al.Insulin detemir versus insulin glargine for type 2 diabetes mellitus[J].Cochrane Database Syst Rev, 2011(7): D6383.
[17]Abe S, Inoue G, Yamada S, et al.Two-way crossover comparison of insulin glargine and insulin detemir in basal-bolus therapy using continuous glucose monitoring[J].Diabetes Metab Syndr Obes, 2011, 4: 283-288.
[18]Renard E, Dubois-Laforgue D, Guerci B.Non-inferiority of insulin glargine versus insulin detemir on blood glucose variability in type 1 diabetes patients: a multicenter, randomized, crossover study[J].Diabetes Technol Ther, 2011, 13(12): 1213-1218.
[19]Pieber T R, Treichel H C, Hompesch B, et al.Comparison of insulin detemir and insulin glargine in subjects with Type 1 diabetes using intensive insulin therapy[J].Diabet Med, 2007, 24(6): 635-642.
[20]King AB.Once-daily insulin detemir is comparable to once-daily insulin glargine in providing glycaemic control over 24h in patients with type 2 diabetes: a doubleblind, randomized, crossover study[J].Diabetes Obes Metab, 2009, 11(1): 69-71.
[21]Hedrington MS, Pulliam L, Davis SN.Basal insulin treatment in type 2 diabetes[J].Diabetes Technol Ther, 2011, 13 Suppl 1: S33-S42.
[22]Swinnen S G, Snoek F J, Dain M P, et al.Rationale, design, and baseline data of the insulin glargine (Lantus) versus insulin detemir (Levemir) Treat-To-Target(L2T3) study: A multinational, randomized noninferiority trial of basal insulin initiation in type 2 diabetes[J].Diabetes Technol Ther, 2009, 11(11): 739-743.
[23]Rosenstock J, Schwartz S L, Clark C J, et al.Basal insulin therapy in type 2 diabetes: 28-week comparison of insulin glargine (HOE 901) and NPH insulin[J].Diabetes Care, 2001, 24(4): 631-636.
[24]Barnett A.Dosing of insulin glagine in the treatment of type 2 diabetes[J].Clin Ther, 2007, 29:987-999.
[25]Strowig SM, Aviles Santa ML, Raskin P.Comparison of insulin monotherapy and com bination therapy with in su1in and m etforru in or insulin and troglitazone in type 2 diabetes[J].Diabetes Care, 2002, 25: 1691-1698.
[26]Duran C, Tuncel E, Ersoy C, et al.The investigation of the effi cacy of insulin glargine on glycemic control when combined with either repaglinide or acarbose in obese Type 2 diabetic patients[J].Endocrinol Invest, 2009, 32: 69-73.
[27]潘长玉译.Joslin糖尿病学[M].北京:人民卫生出版社, 2007: 683-685.
