急性有氧运动对糖尿病大鼠肝脏和胰腺内质网应激蛋白和血糖的影响
2012-05-11徐国琴林文弢翁锡全陈晓彬
徐国琴 林文弢 翁锡全 陈晓彬
广州体育学院运动生化省重点实验室(广东 广州 510500)
内质网(ER)是真核细胞蛋白质翻译合成和细胞内钙离子的储存场所,当内质网的微环境发生改变时即产生内质网应激(ERS),并通过合成和释放内质网应激蛋白从而对细胞应激反应起调节作用,进而维持细胞内环境的稳定和功能。研究发现,ERS在2型糖尿病(T2DM)的胰岛β细胞功能受损及外周胰岛素抵抗中占据着重要地位[1,2],通过降低胰岛细胞过强的内质网应激反应,使受损伤的胰岛β细胞得以修复并恢复功能,并改善胰岛素抵抗,缓解病情发展[3]。本研究观察了不同强度急性运动后糖尿病大鼠血糖及肝与胰腺内质网应激蛋白GRP78和caspase-12的变化,探讨糖尿病大鼠急性运动时内质网应激蛋白作用机制,为运动治疗糖尿病提供参考。
1 材料与方法
1.1 实验对象
6周龄SPF级雄性SD大鼠55只,购自广东省医学实验动物中心,许可证号SCXK(粤)2003-0002,大鼠批号为粤监证字 2007A003,体重(150±15)g,分笼饲养,每笼5只,自由饮食,普通饲料适应性喂养1周进行实验。实验在广州体育学院运动生化省重点实验室完成,实验过程中,大鼠饲养环境室温为(23±2)℃,相对湿度 40~60%。
1.2 实验设计与方法
1.2.1 糖尿病动物模型的建立及动物分组
55只雄性SD大鼠普通饲料适应性喂养1周后,给予高脂饲料喂养,其饲料配方为:猪油10%,白糖20%,蛋黄粉5%,胆盐0.2%,维生素0.05%,矿物质0.2%,基础饲料64.55%。原料来自广东省医学实验动物中心并由其加工制作。饲养6周后所有大鼠禁食12小时,称量大鼠空腹体重,并按30 mg/kg体重的剂量,于左下腹腹腔注射20 mg/ml链脲佐菌素-柠檬酸缓冲液,3天后进行尿糖检测,连续3天为+++~++++,且第7天尾静脉全血血糖值在16.7 mmol/L以上者确定为糖尿病大鼠[4],并将造模成功的糖尿病大鼠随机分为安静组(DM,9只)、小强度运动组 (LIE-1,8只)、中等强度运动组 (MIE-1,8只)、大强度运动组(HIE-1,9 只)。
1.2.2 糖尿病大鼠运动训练模型的建立
所有运动大鼠均在动物跑台上进行有氧耐力运动,依据Bedford等[5]的研究并结合本实验糖尿病大鼠健康状况,分为大、中、小三个强度运动组,跑台速度分别为20 m/min、15 m/min和10 m/min,相当于70%VO2max、50%VO2max和 30%VO2max负荷强度。所有大鼠适应跑台运动后,各运动组按设定强度进行持续1 h的急性跑台运动。
1.3 样品处理与指标测试方法
大鼠运动后即刻称体重,经10%水合氯醛300 mg/kg体重腹腔注射麻醉后,腹主动脉取血,采用日本京都血糖仪检测空腹血糖(FBG),余血以3500 r/min离心10 min后分离血清,采用果糖胺法测试糖化血清蛋白(GSP),酶联免疫方法测试空腹胰岛素(FINS)。取大鼠肝中叶和胰腺尾部,迅速用滤纸吸干血液,OCT包埋剂包埋制备冰冻组织切片,采用免疫组织化学方法[6,7]测试肝脏和胰腺 GRP78、caspase-12含量,并用图像分析软件Image-Pro Plus 6分析阳性表达的光密度值(OD值)和累积光密度值(IOD值)。采用 Homa 公式[8,9]计算胰岛素抵抗指数(IRI)、胰岛素敏感指数(ISI)和 β 细胞功能指数(HBCI)。胰岛素抵抗指数=(FBG×FINS)/22.5;胰岛素敏感指数=ln [1/(FBG×FINS)];β 细 胞 功 能 指 数 =20×FINS/(FBG-3.5)。
1.4 统计学分析
所有数据均以 “平均数±标准差”表示,用SPSS12.0统计软件进行数据分析,各组之间均数比较用单因素方差分析。P<0.05,具有显著性差异;P<0.01,具有极显著性差异。
2 结果
2.1 空腹血糖、糖化血清蛋白
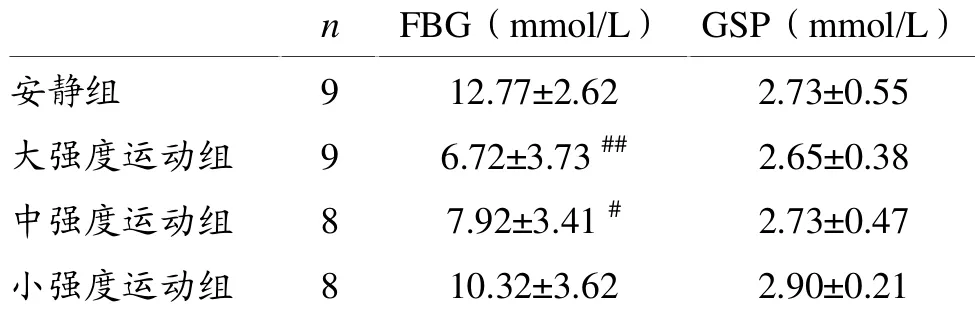
表1 各组大鼠空腹血糖、糖化血清蛋白的比较
由表1可知,糖尿病大鼠1 h急性运动后空腹血糖呈不同程度降低。与安静组相比,大、中强度运动组空腹血糖下降有统计学意义 (P<0.01,P<0.05),小强度运动组下降无统计学上意义(P>0.05),三组之间空腹血糖差异无统计学意义(P>0.05)。各组大鼠糖化血清蛋白相差不大(P>0.05)。
2.2 胰岛素抵抗指数及胰岛β细胞功能指数
与安静组相比,大、中、小运动组大鼠急性运动后血清空腹胰岛素均显著下降;胰岛素抵抗指数显著降低,胰岛素敏感指数显著升高 (P<0.01,P<0.01,P<0.05)。各运动组大鼠β细胞功能指数有所升高,但无统计学意义(P>0.05)。见表2。

表2 各组大鼠空腹胰岛素、胰岛素抵抗指数、胰岛素敏感指数及胰岛β细胞功能指数比较
2.3 肝脏和胰岛内质网应激蛋白GRP78、caspase-12表达
图1(免疫组化染色结果)显示,大鼠急性运动后肝组织GRP78及caspase-12阳性细胞主要在细胞核及核周围的胞浆表达。与安静大鼠相比,各运动组大鼠肝脏细胞GRP78及caspase-12阳性表达减少。
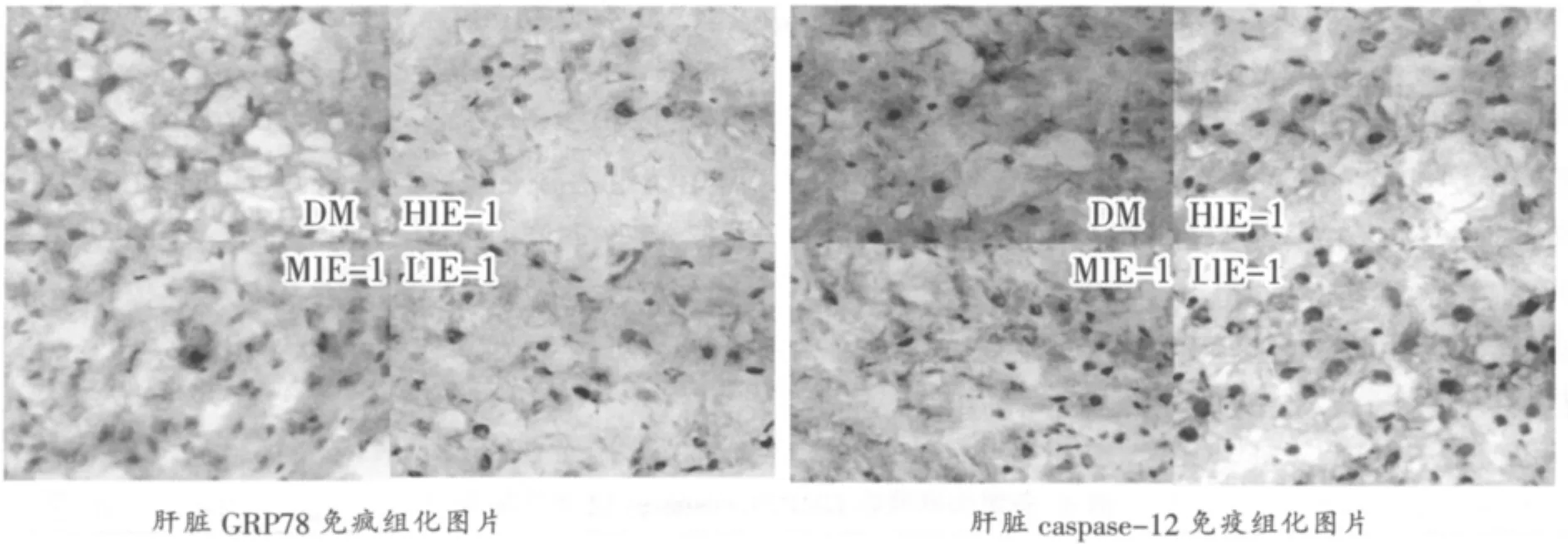
图1 各组大鼠肝脏GRP78、caspase-12表达免疫组化照片(×400)
由表3图像分析结果可见,与安静组比较,大、中、小强度运动组大鼠肝脏GRP78表达显著减少,差异有统计学意义(P<0.01,P<0.05,P<0.01);三种强度之间GRP78表达比较差异无统计学意义。与安静组比较,中等强度运动组大鼠肝脏caspase-12表达明显减少,差异有统计学意义(P<0.05);小强度运动组肝脏caspase-12表达减少,大强度运动组表达增多,但差异均无统计学意义(P>0.05);但中、小强度运动组与大强度运动组相比差异有统计学意义(P<0.01,P<0.05)。中等强度运动组大鼠 GRP78表达量与caspase-12表达量的比值较安静组变化不大(P>0.05),而大、小强度运动组显著减少(P<0.01,P<0.05);中等强度运动组显著高于大强度运动组和小强度运动组(P<0.01,P<0.05)。
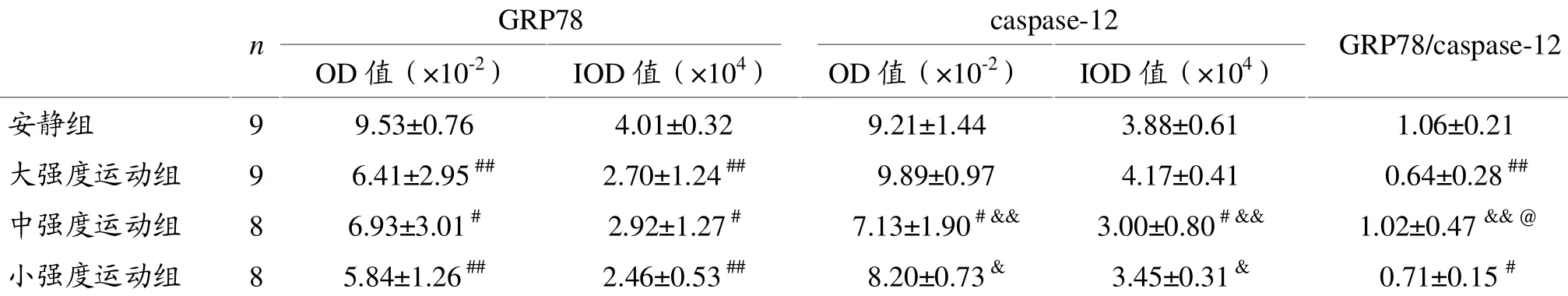
表3 各组大鼠肝脏内质网应激蛋白GRP78、caspase-12表达的变化
由图2(免疫组化染色结果)可见,急性运动后糖尿病大鼠胰腺GRP78及caspase-12阳性细胞主要在细胞核及胞核周围的胞浆表达,与安静组相比,各运动组大鼠胰腺GRP78及caspase-12阳性表达减少。
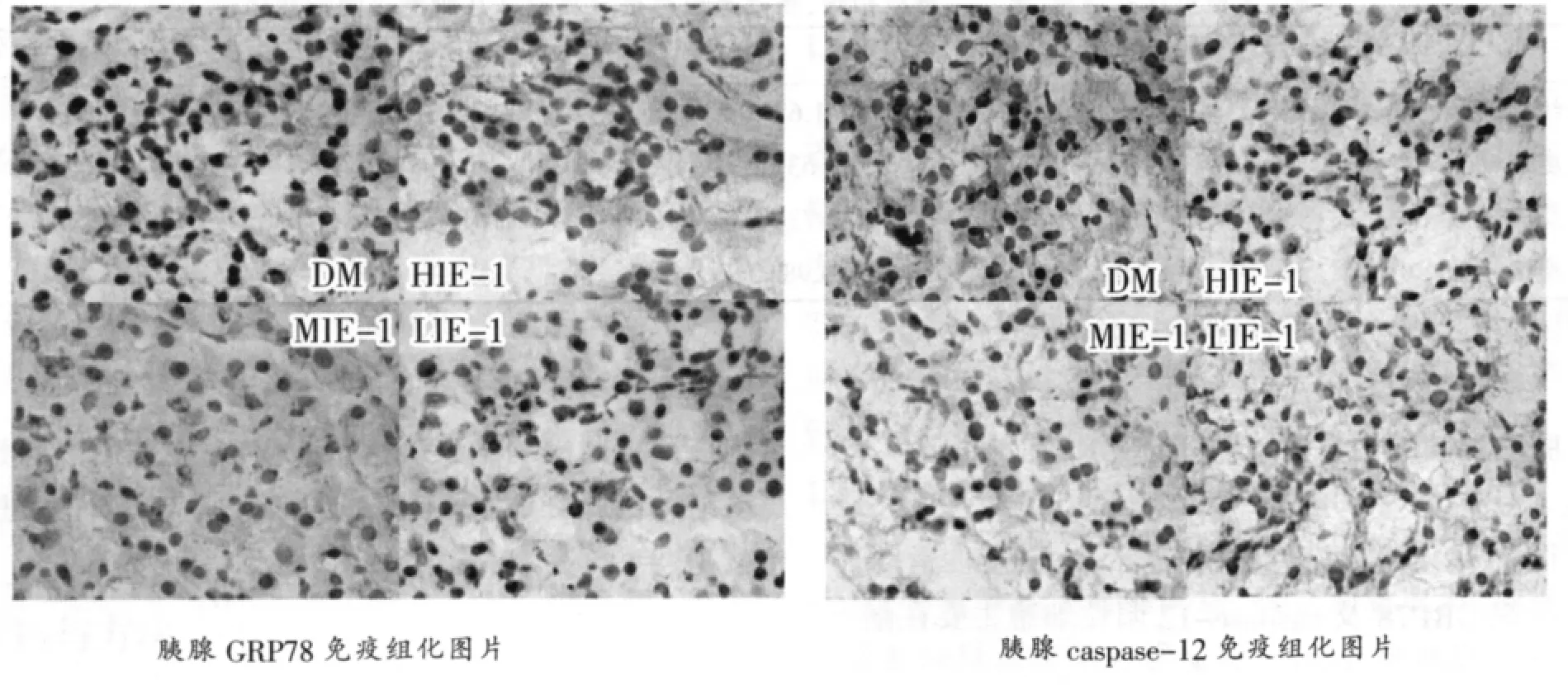
图2 各组大鼠胰腺GRP78、caspase-12表达免疫组化照片(×400)
由表4图像分析结果可见,与安静组比较,大强度运动组胰腺GRP78表达减少,但差异无统计学意义(P>0.05),中、小等强度运动组表达显著减少,差异均有统计学意义(P<0.01)。与安静组比较,中、小强度运动组胰腺caspase-12表达明显减少,且差异有统计学意义(P<0.01),而大强度运动组表达有所减小,但差异无统计学意义(P>0.05)。中、小强度运动组胰腺caspase-12表达与大强度运动组相比显著减小(P<0.01,P<0.05)。各运动组大鼠胰腺GRP78表达量与caspase-12表达量比值虽均较安静组有所升高,但差异无统计学意义(P>0.05)。
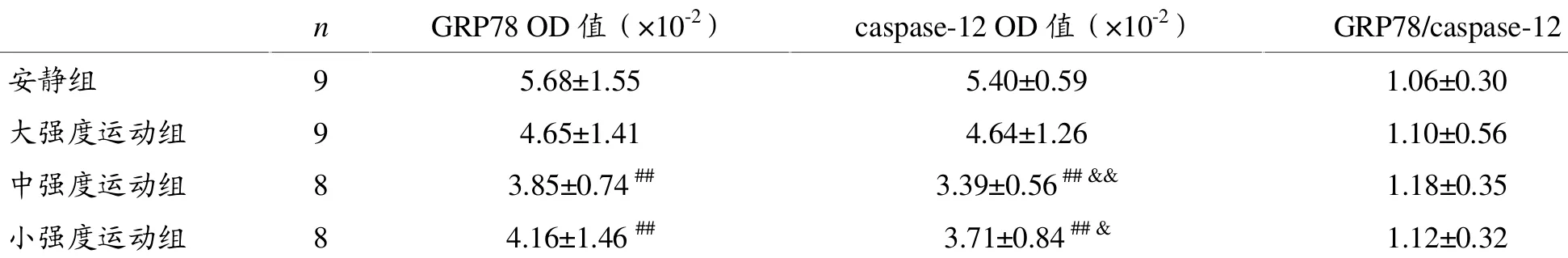
表4 各组大鼠胰腺GRP78、caspase-12表达的变化
3 讨论
3.1 不同强度急性运动对胰岛素敏感及胰岛素抵抗的影响
急性运动对胰岛素敏感性的影响效应与运动方式及运动强度有关。Bordenave等[10]研究发现,2型糖尿病患者以50%HRmax运动15 min后紧接着以85%HRmax运动5 min,运动后胰岛素敏感性提高了773%。刘鸥等[11]观察了急性游泳、步行、举哑铃及仰卧起坐等不同方式持续运动1小时对胰岛素抵抗的影响,发现有氧运动显著改善肥胖患者胰岛素抵抗,并在一定程度保护患者自身胰岛β细胞功能,而无氧运动效果较差。本研究发现,糖尿病大鼠进行大、中、小三种强度急性有氧运动后,胰岛素抵抗指数均显著降低,胰岛素敏感指数均显著升高,表明不同强度有氧耐力性运动均可增强糖尿病大鼠胰岛素敏感性,降低胰岛素抵抗。
3.2 不同强度急性运动对血糖的影响
运动可通过增加骨骼肌等外周组织对血糖的摄取和利用降低糖尿病患者血糖。研究表明,急性中等强度运动能降低糖尿病患者餐后血糖水平,且有效降低采用胰岛素注射治疗的2型糖尿病患者运动后24 h的高血糖水平[12]。即使摄入大量高脂饮食,餐后进行30 min轻微自行车运动也可阻止餐后血糖升高[13]。 Nguyen 等[14]研究发现,糖尿病患者每次急性运动时的毛细血管血糖水平呈进行性降低,而每次运动后血糖保持持续稳定,故认为运动能增强糖尿病患者血糖调节水平,改善糖尿病患者高血糖紊乱状态。
本研究发现,糖尿病大鼠急性运动后,空腹血糖均呈不同程度降低,尤其是大、中强度运动大鼠空腹血糖下降有统计学意义。这表明大、中强度急性运动明显降低糖尿病大鼠高血糖水平,小强度运动对降低高血糖水平也有一定作用,也表明糖尿病大鼠血糖下降有运动强度依赖性,有氧运动强度越大,消耗葡萄糖越多。糖化血清蛋白反映近两周的血糖平均水平。本研究中,各运动组糖尿病大鼠糖化血清蛋白之间相差不大,说明单次运动未改变糖尿病大鼠近两周的平均血糖水平。
3.3 不同强度急性运动对糖尿病大鼠肝脏和胰腺内质网应激蛋白GRP78、caspase-12表达及其比值的影响
GRP78存在于胞浆内质网膜上,是内质网应激的分子伴侣,可促进蛋白质的正确折叠,协助蛋白质跨内质网膜转运,是促进正常生长状态下细胞蛋白质成熟、维系细胞机能和生命的关键性调节物质。在内质网应激反应调节时,GRP78基因转录活性可提高10~25倍,表达量显著上升,进而维持内质网钙稳态及内环境的稳定[15],阻止细胞凋亡,故通常将GRP78升高作为内质网应激的标志分子之一,也是细胞的一种重要的防御机制[16]。caspase-12是ER膜上的促凋亡分子,是ERS介导的细胞凋亡特异性启动蛋白酶,其活化是凋亡的中心环节[17]。caspase-12凋亡途径经ERS激活后,与线粒体凋亡途径一起共同导致细胞凋亡[18]。内质网应激时,非折叠蛋白反应对细胞具有双重作用,短时间内质网应激可作为细胞的有益调节器,但长期应激时却是细胞功能紊乱和细胞凋亡的触发器[19,20,21]。 研究表明[22],STZ 诱导的糖尿病大鼠胰岛细胞产生内质网应激,内质网应激时GRP78表达有助于防止STZ及炎症细胞因子所诱导的胰岛细胞凋亡。本研究采用GRP78与caspase-12比值反映细胞存活程度。
糖尿病大鼠体内存在严重且持久的内质网应激反应,进而引起一系列内质网应答反应[17]。目前运动对糖尿病内质网应激影响的研究较少。研究发现[23],STZ诱导小鼠骨骼肌组织水肿,心脏淋巴细胞炎性浸润,运动可增加热休克蛋白表达,促进组织炎症恢复。通过对空腹状态下的2型糖尿病患者进行肌肉活检和蛋白质组分析,发现8个潜在的蛋白标记,有2个热休克蛋白上调,干扰了ATP再合成和线粒体代谢[24]。一次性力竭运动和长时间适应性运动训练后小鼠股四头肌组织内质网应激蛋白和mRNA表达均有所升高[25]。另有报道发现,一次急性运动后肝脏内质网应激蛋白 GRP78 等表达增加[26,27]。 da Luz等[28]对高脂喂养大鼠进行2个月的游泳训练后发现,大鼠肝脏组织和附睾脂肪内质网应激明显减轻,改善了胰岛素敏感性。本研究发现,糖尿病大鼠大、中、小三种强度急性运动后,肝脏细胞GRP78表达均减少,表明运动降低糖尿病大鼠肝脏过强的内质网应激。从肝脏caspase-12表达看,中等强度运动组大鼠caspase-12表达降低,说明中等强度有氧运动抑制大鼠肝脏内质网相关凋亡通路,有助于大鼠肝脏细胞的存活。从胰腺内质网应激蛋白变化看,中、小强度运动组大鼠胰腺GRP78和caspase-12表达均显著降低,说明运动尤其是中、小强度运动降低大鼠胰腺过强的内质网应激,降低内质网应激导致的胰腺内质网相关凋亡通路,有利于大鼠胰岛细胞存活和胰岛细胞功能的发挥。急性运动降低糖尿病大鼠内质网应激的原因可能是,急性运动中及运动后,组织器官对能源物质的消耗增加,使血糖降低,血脂消耗,改善组织细胞内环境,减轻内质网的内环境紊乱,有助于内质网功能的发挥而维持细胞和内质网的功能稳定。
在运动治疗糖尿病的过程中,运动强度太大和太小都不利于促进糖尿病患者康复。本研究发现,中、小强度急性运动后,糖尿病大鼠肝脏和胰腺caspase-12表达与大强度运动组相比,差异均有统计学意义,说明中、小强度运动比大强度运动更能降低糖尿病大鼠肝脏和胰腺内质网相关凋亡通路,有助于肝细胞和胰腺细胞存活和细胞功能的恢复。从肝脏内质网应激蛋白GRP78表达量与caspase-12表达量的比值看,中等强度运动组显著高于大强度运动组和小强度运动组,说明中等强度运动有利于稳定肝细胞内质网稳态和细胞内环境的稳定。这可能是前人研究[29,30]的急性运动通过增强胰岛素传导通路中各种酶活性,而不是通过增加酶蛋白总量而减轻胰岛素抵抗的原因。
4 总结
4.1 急性有氧耐力运动可降低糖尿病大鼠内质网应激蛋白GRP78和caspase-12水平,有利于大鼠内质网功能的维持,延缓内质网凋亡,且中等强度有氧运动效果较好。
4.2 急性有氧耐力运动可降低糖尿病大鼠血糖水平,增强胰岛素敏感性,其机制可能与内质网应激蛋白的调节有关。
[1]Ozcan U,Cao Q,Yilmaz E,et a1.Endoplasmic reticulum stress links obesity,insulin action and type 2 diabetes.Science,2004,306(5695):457-461.
[2]Eizirik DL,Cardozo AK,Cnop M.The role for endoplasmic reticulum stress in diabetes mellitus.Endocr Rev,2008,29(1):42-61.
[3]纪立农.“β细胞休息”概念及其在糖尿病防治中的应用.国外医学内分泌分册,2003,23(3):180-181.
[4]余臣祖,张朝宁.实验性2型糖尿病动物模型研究进展.医学综述,2006,12(1): 41-42.
[5]Bedford TG,Tipton CM,Wilson NC,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures.J Appl Physiol,1979,47 (6):1278-1283.
[6]韩冰,谢汝佳,张成俊,等.丹芍化纤胶囊对大鼠肺纤维化内质网应激相关蛋白GRP78及NF-κB表达的影响.中华中医药杂志,2011,26(11):2551-2554.
[7]甘桂香,胡瑞成,戴爱国,等.吸烟慢性阻塞性肺疾病大鼠肺组织内质网相关凋亡基因Caspase-12的表达.中国呼吸与危重监护杂志,2011,10(1):33-37.
[8]Matthews DR,Hosker JP,Rudenski AS,et al.Homeostasis model assessment:insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man.Diabetologia,1985,28:412-419.
[9]Haffner SM,Gonzaler C,Stern MP,et al.A prospective analysis of the HOMA model.The Mexicocity Diabetes Study.Dibetes Care,1996,109:1138-1141.
[10]Bordenave S,Brandou F,Manetta J,et al.Effects of acute exercise on insulin sensitivity,glucose effectiveness and disposition index in type 2 diabetic patients.Diabetes Metab,2008,34(3):250-257.
[11]刘鸥,肖正华,杨小波.不同运动方式对肥胖青少年人群胰岛素抵抗和胰岛β细胞功能的影响.中国体育科技,2008,44(5):134-137.
[12]Praet SF,Manders RJ,Lieverse AG,et al.Influence of acute exercise on hyperglycemia in insulin-treated type 2 diabetes.Med Sci Sports Exerc,2006,38 (12):2037-2044.
[13]Hostmark AT,Ekeland GS,Beckstrom AC,Meen HD.Postprandial light physical activity blunts the blood glucose increase.Prev Med,2006,42(5):369-371.
[14]Nguyen NH,Rahme E,Dasgupta K.Acute exercise-induced glucose change during an exercise program in type 2 diabetes.J Cardiopulm Rehabil Prev,2008,28(2):122-127.
[15]Yang GH,Li S,Pestka JJ.Down-regulation of the endoplasmic reticulum chaperone GRP78/Bip byvomitoxin(Deoxynivalenol).Toxicol Appl Pharmol,2000,16 (3):207-217.
[16]CaiB,Tomida A,MikamiK,et al.Down-regulation of epidermal growth factor receptor signaling pathway by binging of GRP78/Bip to the receptor under glucose starved stress conditions.Cell Physiol,1998,177(2):282-288.
[17]Morishima N,Nakanishi K,Takenouchi H,et al.An endoplasmic reticulum stress specific caspase cascade in apoptosis.Cytochrome c-independent activation of caspase-9 by caspase-12.J Biol Chem,2002,277 (37): 34287-34294.
[18]Liu H.Baliga R.Endoplasmic reticulum stress-associated caspase 12 mediates cisplatin-induced LLC-PK1 cell apoptosis.J Am Soc Nephrol,2005,16(7):1985-1992.
[19]Eizirik DL,Cardozo AK,Cnop M.The role for endoplasmic reticulum stress in diabetes mellitus.Endocr Rev,2008,29(1):42-61.
[20]Morishima N,Nakanishi K,Tsuchiya K,et al.Translocation of Bim to the endoplasmic reticulum mediates ER stress signaling for activation of caspase-12 during ER stress-induced apoptosis.J Biol Chem,2004,279 (48):50375-50381.
[21]MarchettiP,Bugliani M,Lupi R,et al.The endoplasmic reticulum in pancreatic beta cells of type 2 diabetes patients.Diabetologia,2007,50(12):2486-2494.
[22]Wang M,Zhao XR,Wang P,et al.Glucose regulated proteins 78 protects insulinoma cells (NIT-1) from death induced by streptozotocin,cytokines or cytotoxic T lymphocytes.Int J Biochem Cell Biol,2007,39(11):2076-2082.
[23]Sen CK,Atalay M,Oksala NK.Exercise training modulates heatshock protein response in diabetic rats.J Appl Physiol,2004,97(2):605-611.
[24]Hojlund K,Wrzesinski K,Larsen PM,et al.Proteome analysis reveals phosphorylation of ATP synthase β-subunit in human skeletal muscle and proteins with potential roles in type 2 diabetes.J Biol Chem,2003,278 (12):10436-10442.
[25]Wu J,Ruas JL,Estall JL,et al.The unfolded pro-tein re-sponse mediates adaptation to exercise in skeletal muscle through a PGC-1alpha/ATF6alpha complex.Cell Metab,2011,13(2):160-169.
[26]Gonzalez B,Manso R.Induction,modification and accumulation of HSP70s in the rat liver after acute exercise:early and late responses.J Physiol,2004,556(Pt 2):369-385.
[27]温悦萌,张天欧,谢岚,等.一次性力竭运动对小鼠肝脏和骨骼肌内质网应激的影响.中国运动医学杂志,2012,31(2):140-145.
[28]da Luz G,Frederico MJ,da Silva S,et al.Endurance exercise training ameliorates insulin resistance and reticulum stress in adipose and hepatic tissue in obese rats.Eur J Appl Physiol,2011,111(9):2015-23.
[29]Eduardo R,Jose R,Patricia O,et al.Reversal of diet-induced insulin resistance with a single bout of exercise in the rat:the role of PTP1B and IRS-1 serine phosphorylation.J Physiol,2006,577(3):997-1007.
[30]杜晓平,符谦.运动对胰岛素抵抗大鼠骨骼肌PI3K活性与表达的影响.沈阳体育学院学报,2008,27(3):44-46.
