拟柱胞藻检测技术改进
2012-05-10莆田市环境监测站傅昶宁
莆田市环境监测站 傅昶宁
拟柱胞藻检测技术改进
莆田市环境监测站 傅昶宁
近年来,在我国各地陆续发现拟柱胞藻水华,由于其具有一定的毒性,而且发生水华时肉眼不易发现,同时爆发时,藻密度通常能达到每升上亿个细胞。该文根据与其它藻类不同的特性,提出了拟柱胞藻检测方法,通过对传统检测方法的改进,证明了其实用性、准确性和简洁性。
拟柱胞藻 检测 鉴定 改进
1 概述
拟柱胞藻(Cylindrospermopsis raciborskii),又名拉氏拟柱胞藻,为蓝藻类原核生物念珠藻目念珠藻科柱胞藻属。由于其在不同的环境下,形态变化较大,因此,在我国有中华尖头藻和拉氏拟鱼腥藻等多个名称[1]。拟柱胞藻能够产生Cylindrospermopsin(CYN)、麻痹性贝毒、类毒素-A等。其中CYN能导致肝肾损害,也有可能致癌,麻痹性贝毒和类毒素-A均为神经毒素。据报道,在澳大利亚棕榈岛,有149人出现了肝肠炎症状,这与被拟柱孢藻所产生毒素污染的饮用水有较大相关性。拟柱孢藻在温带和热带地区的浅水水域(如湖泊、水库等)生长良好,一旦形成水华,数目巨大,如美国印第安纳州发现拟柱胞藻的19个湖泊中,藻密度均达到每升上亿个细胞[2]。近年来,在我国山东、湖北、广东和云南等地陆续发现了拟柱胞藻及其水华。
由于拟柱胞藻通常不在水体表面形成明显的浮膜,根据近几年对莆田市东圳水库拉氏拟柱胞藻的上百次日常检定发现,若待到发现水体颜色变为较为明显的黄绿色,则藻密度至少在2×108个细胞/升以上。一旦水华爆发,其藻类数量将占藻类总数的98%以上。因此,拟柱胞藻的检测方法,在对水库、湖泊水质的预警和水质评价中具有十分重要的意义。
2 拟柱胞藻检测现状
由于拟柱胞藻是发现能产生毒素的最新蓝藻种类,在国内各项标准中均未见对拟柱胞藻的毒素或藻密度做出相关规定。在我国,福建、山东、湖北和云南等地发现了拟柱胞藻及其水华。本文在深入理解《水和废水监测分析方法》(第四版增补版)中关于藻类检测方法的基础上进行了技术试验,总结出鉴定拟柱胞藻并改进的快速检测方法[3]。下面主要以莆田市东圳水库的拟柱胞藻检测为例进行说明。
3 拟柱胞藻检测方法及改进介绍
3.1 仪器及试剂
奥林巴斯AX31显微镜,设备包括带指示方框的10×目镜,10×、20×、40×物镜;
有机玻璃采水器;
分液漏斗;
0.1mL微量移液器;
50mL棕色标本瓶;
计数框:面积为20×20mm、容量为0.1mL,其内划分横直各10行格,共100个小方格。
22mm×22mm盖玻片;
鲁哥氏液(Lugols solution):称取4g碘及6g碘化钾,溶于100mL纯水中,避光保存。
福尔马林固定液:将4mL福尔马林(40%)甲醛和10mL甘油溶于86mL纯水中。
3.2 水样的采集及固定
用有机玻璃采水器采集100~2000mL水样(视水中藻密度大小适当增减采水量),采样后及时加入1%体积的鲁哥氏液固定。如需长期保存,再加入几毫升福尔马林固定液,密封保存。
3.3 沉淀和浓缩
由于拟柱胞藻细胞个体小,且一旦形成水华,数目巨大,故根据藻密度,对固定后的水样进行不同的处理。
当藻密度较低,即每升浓度低于10万个细胞时,将水样充分摇匀后,取1000mL在分液漏斗中沉淀,沉淀时间须满48小时。在计数时,取沉淀物约30毫升,定容至50毫升。
当拟柱胞藻每升浓度处于10万~30万个细胞时,无需沉淀和浓缩,可直接进行鉴定。
当藻密度大于每升30万个细胞时,根据实际需要进行稀释,并补充适量的鲁哥氏液进行染色固定。
3.4 拟柱胞藻的鉴定和计数
由于拟柱胞藻藻丝不易断裂,将计数样品充分摇匀后,迅速吸取0.1mL样品到计数框中,盖上盖玻片。计数框中应无气泡,也无样品溢出。标本制成后,静置几分钟,使藻体沉至框底,再进行镜检。
3.5 拟柱胞藻的鉴定
拟柱胞藻整条藻丝粗细均匀,藻丝通常宽2~3微米,长度变化较大,从10~120微米的都有。形态上,大部分为直线形,在某些地区会发现有卷曲形的[2],有时可见异形胞。在其生长旺盛期,可见丰富的气泡。拟柱胞藻的单个细胞长度范围为3~10微米,由于其很少出现细胞收缩,故单个细胞往往很难区分。

图1 直线型拟柱胞藻

图2 卷曲形拟柱胞藻
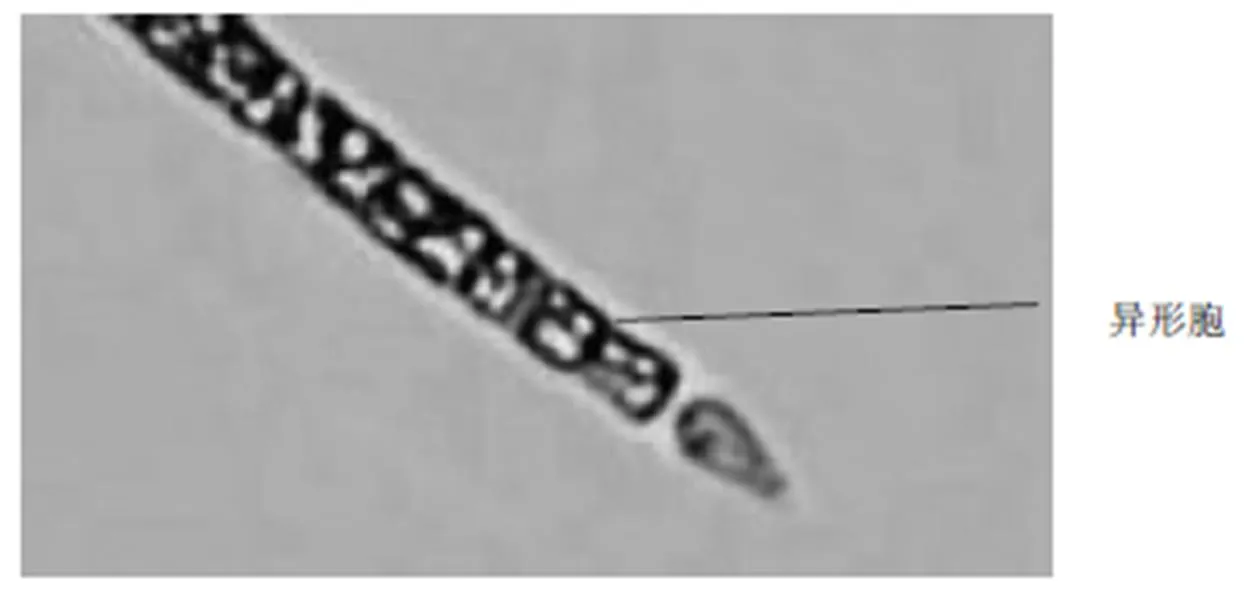
图3 直线型拟柱胞藻的异形胞
3.6 拟柱胞藻的计数
在东圳水库,拟柱胞藻爆发期的藻密度通常在每升两亿个细胞以上,为了减少工作量,对传统的计数方法进行了改进。
首先,根据拟柱胞藻的个体长度与细胞特性,计数时,显微镜目镜使用10倍,物镜使用20倍,依照目镜行格法,间隔选取四个“半行格”(见图4),先对藻丝的个体数进行统计。一个“半行格”内的个体数目一般不少于100个。图4所示方法有以下三个好处:第一,在10×20倍放大倍数下,每个视野的直径刚好等于1mm,即等于面积为20×20mm划分成100方格后,每个方格边长的一半,单次横向的十格次视野,刚好是1/2行格,较之10×20倍放大倍数,一次横向检测所计视野面积大了一倍,大大减少了工作量,加快检测速度;第二,拟柱胞藻的藻丝长度在该放大倍数下,较为清楚,同时,由于拟柱胞藻含有丰富的伪空泡,沉淀时间不足的情况下,藻丝常会悬浮在水中,常常出现分层现象,故需要在镜检计数过程中,需要不断调整焦距,比起使用10×40倍的放大倍数,减小了调整幅度,使计数更为轻松快捷,减缓视力疲劳;第三,取不同行格的上下位置计数,能够较为均衡准确地统计总数,使统计结果更具代表性和准确性。
统计完个体数后,转换使用40倍物镜,随机选取若干个不重复视野,统计各视野内全部藻丝个体的细胞数和个体数,再进行换算。一般所参与此处统计的个体数不得少于30条。
由于拟柱胞藻很少出现细胞收缩,若按照传统检测方法,对细胞总数直接进行统计,工作量巨大,极大地影响了技术效率。每个样品,各取样和计数两次,两次结果与平均数之差应不大于±15%,否则须继续取样计数。

图4 计数板上四个“半行格”的计数方法
3.7 计算结果
每升水样中拟柱胞藻的数量按下式计算:
N=A/Ac×Vs/Va·n (1)



根据以上计数方法,一个计数框共含10行格,实计数2行格,在拟柱胞藻密度较高时,未进行稀释的情况下,则(1)~(2)式可简化为:
N=5×104·n (4)
依(3)和(4)式计算出水样中的拟柱胞藻含量,并根据(3)式所得的个体平均细胞数对水库水质未来几日发展趋势进行简单的判定。
3.8 改进方法要点
第一,样品中拟柱胞藻密度较低时,浓缩沉淀时间必须满48小时。由于新鲜的拟柱胞藻富含伪空泡,固定时间不足的情况下,会有较多的细胞无法沉淀,从而导致浓缩后检测结果偏小。
第二,在计数过程中,以计数框的四个“半行格”进行统计,不但不需要计算视野面积,无需配置台尺和目尺,而且在充分体现了抽样大小和代表性的情况下,通过实测两行格的统计方式,大大减少了工作量,提升了工作效率。
第三,在日常藻类鉴定过程中,大多使用40倍物镜进行计数统计,本文根据拟柱胞藻的个体长度及其在水华爆发时期会导致物种的多样性和丰富性明显下降[2]的特性,选择使用20倍物镜,不但可以清晰地看出拟柱胞藻的个体,同时还能在相同工作量下,增大计数面积,增加了统计结果的准确性和代表性。
第四,在计数方法上,不使用常规的按细胞计数,而是按照个体计数,再用个体总数乘以个体上的平均细胞数,来获得统计数值。这样做,既减少了由于藻细胞分隔不明显,需要统计大量数值而容易出现的误差和视觉疲劳,同时也极大加快了计数速度,及时有效地提供应急监测数据。而且,通过对个体上的藻体平均细胞数长期总结比较,根据拟柱胞藻的生长周期,可以在一定程度上对其未来几日内的发展趋势进行预报,为水质富营养化的预警提供了可能。
4 结语
经典藻类检测方法在用于拟柱胞藻的检测时,非常费时,常常滞后于生产和研究,特别是在爆发期,极大地影响了对富营养化问题的分析决策。本方法经过多次实验后,证明了其实用、准确、简洁等优点,测试结果可较为迅速地得出,作为对拟柱胞藻富营养化的水体进行的检测是高效、可行的。
[1] 查广才,杨东娟,邹海鹰.拟柱胞藻的营养成分与培养[J]. 广东农业科学,2010,37(8):6-8.
[2] William W. Jones,Sarah Sauter. Distribution and Abundance of Cylindrospermopsis raciborskii in Indiana Lakes and Reservoirs[R]. SPEA-Indiana University,2005,4/5:1-41.
[3] 国家环境保护总局.水和废水监测分析方法(第四版增补版)[M].北京:中国环境科学出版社,2002.
