乙醇预处理对水稻秸秆物质迁移和酶解的影响
2012-05-10元英进李炳志艾瑞婷
元英进,秦 磊,李炳志,艾瑞婷
(1. 天津大学化工学院系统生物工程教育部重点实验室,天津 300072;2. 中国生物技术发展中心,北京 100036)
用秸秆等农业废弃物生产纤维素乙醇以取代化石能源的使用,一方面可以减少二氧化碳的排放,另一方面可以减少石油等化石能源的消耗.如何提高从农业废弃物到乙醇的转化效率并且降低成本,是制约纤维素乙醇产业化的关键因素[1-4].纤维素乙醇上游工艺包括原料预处理、酶解糖化和发酵等环节.预处理过程在纤维素乙醇生产的上游过程中占大部分成本,并且对乙醇产率有至关重要的作用[5].预处理使木质纤维素在常温或高温下与催化剂反应,使纤维素、半纤维素与木质素等木质纤维素原料的复杂结构能够得到分解,使纤维素酶更容易与纤维素接触.预处理方法主要包括稀酸预处理、氨水预处理、氢氧化钙预处理、高压热水预处理、氨爆破预处理、蒸汽爆破预处理和有机溶剂预处理等[1-3,6-12].有机溶剂预处理是一种针对木质素含量较高的木本类原料的有效预处理方法,采用的有机溶剂有甲醇、乙醇、甲酸、乙酸、过乙酸和丙酮等,有机溶剂预处理的优点是可以有效去除木质纤维素中的木质素,并且有机溶剂可以通过减压蒸馏等方法回收.在有机溶剂中加入硫酸、磷酸等催化剂可以提高木质素的去除率[10-12].在酸碱催化的预处理过程中,木质纤维素原料由于过度水解会产生大量的副产物,其中,五碳糖和六碳糖降解产生呋喃类和羧酸类化合物,木质素降解成芳香类化合物[13-14].预处理方法的优劣不仅要通过酶解效率来评价,还要考虑产生的抑制物对酶解和发酵的影响.利用高效液相色谱和质谱等方法全面准确地测定降解产物的种类和含量已经是评价预处理的重要指标[15-18].
常用预处理方法往往需要较高的温度(160~220,℃)有效地破坏木质纤维素的结构,这就要求高成本的设备和较高的能量进行反应,并且产生的抑制物明显增加.如何通过中低温度下的预处理达到较高的酶解效率是需要解决的问题.
水稻是我国的主要粮食作物,产生的水稻秸秆数量巨大.笔者以水稻秸秆为原料,研究了乙醇预处理中酸浓度和乙醇溶剂对纤维素酶解的影响.另外,利用气质联用技术对不同条件下的木质纤维素降解产物进行了半定量分析和比较.
1 实验材料和方法
1.1 材 料
水稻秸秆取自天津市北辰区,自然风干后粉碎过筛,取 20~80目的部分.材料的成分按美国可再生能源实验室(NREL)的实验分析规范(LAP)[19]操作.原料的成分分析结果见表1.

表1 水稻秸秆成分Tab.1 Composition of rice straw %
1.2 预处理和酶解
原料的预处理和酶解流程见图1.
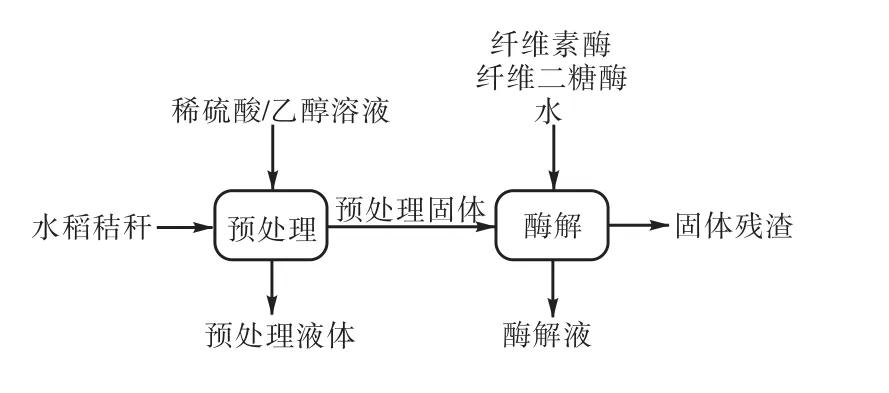
图1 水稻秸秆预处理和酶解流程Fig.1 Pretreatment and enzymatic hydrolysis process of rice straw
预处理是将反应体系装入 1,L带密封盖的玻璃容器中,放入立式压力蒸汽灭菌锅中进行反应.表 2列出了预处理实验设计中不同组别的酸浓度和乙醇浓度,其他固定反应条件为固液比 1∶10(质量比),反应温度120,℃,反应时间60,min.
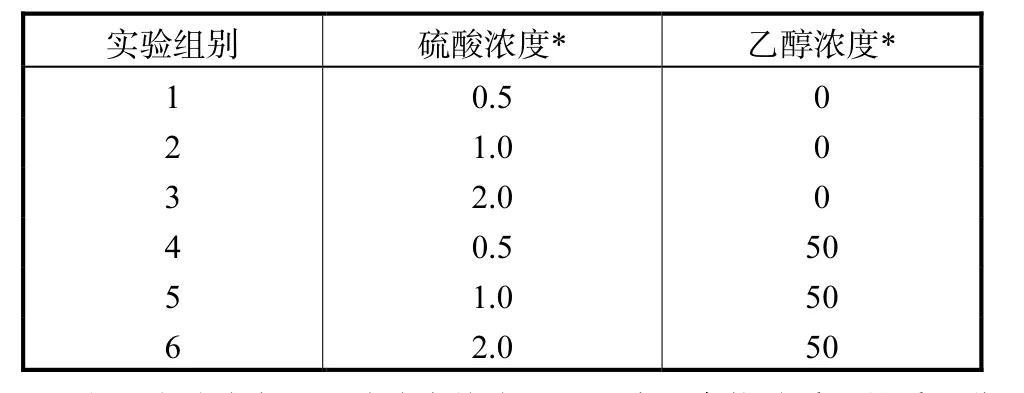
表2 预处理反应条件Tab.2 Pretreatment condition %
预处理后的固液混合物用纱布过滤,并用约2.5,L蒸馏水冲洗固体,至洗液呈中性.固体在 55,℃下烘干,干燥后按LAP方法分析成分,用于酶解.
预处理得到的液体部分用Ca(OH)2中和至pH=6.0,11,000,r/min离心15,min,收集上清液.含有乙醇的上清液在 45,℃、5,kPa下蒸干,再加水定容至100,mL.经上述处理得到的溶液用 0.22,μm 滤膜过滤,用 Aminex HPX-87H(Bio-Rad)色谱柱耦合示差检测器(Waters 2414)测量葡萄糖和木糖浓度,流动相为 5,mmol H2SO4,流速 0.6,mL/min,柱温 60,℃.
酶解在 500,mL锥形瓶中进行,反应体积为125,mL,葡聚糖负荷为 6%.葡聚糖负荷定义为葡聚糖的质量在总固液混合物体积中的百分数(认为水稻秸秆的密度是 1,g/mL),使用相同的葡聚糖负荷即控制相同的底物浓度.纤维素酶Spezyme CP(Genecor,酶活为 33,FPU/mL)和纤维二糖酶 Novozyme 188(Sigma,酶活为 870,CBU/mL)分别按终浓度为15,FPU/g葡聚糖和 30,CBU/g葡聚糖加入酶解体系中.分别加入盐酸四环素、柠檬酸钠缓冲液和蒸馏水,使盐酸四环素和柠檬酸钠的最终浓度分别为40,mg/L和 50,mmol/L.酶解条件为 50,℃、250,r/min.反应 72,h后,固液混合物在 11,000,r/min下离心15,min,测量酶解液的体积和糖浓度.用蒸馏水洗涤固体残渣并离心,测量洗液的体积和糖浓度,这一过程用来计算葡萄糖和木糖的转化率,即
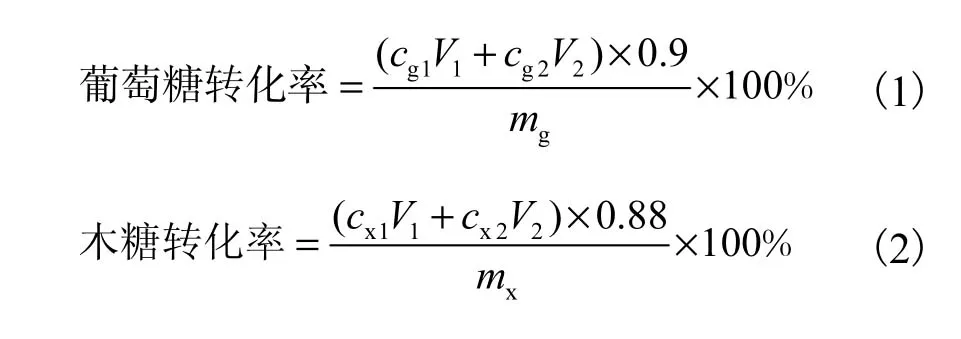
式中:V1和 V2分别为酶解液和洗液的体积,mL;cg1、cx1、cg2、cx2分别为酶解液中葡萄糖质量浓度、木糖质量浓度、洗液中葡萄糖质量浓度、木糖质量浓度,g/mL;mg和 mx分别为酶解初始条件下葡聚糖和木聚糖质量,g.
1.3 预处理液体部分中降解产物的测定
预处理液体样品经 0.22,μm滤膜过滤后,用浓硫酸将 pH调节至 1.0~2.0.取 3,mL样品放入 10,mL离心管中,加入 1,mL内标溶液(0.04,mg/mL氘标记琥珀酸,溶剂为甲醇)并混合均匀.加入 2,mL 甲基叔丁基醚(MTBE)进行萃取,在摇床混合 30,min后4,500,r/min离心 3,min,取上层萃取液.每个样品萃取 3次.收集 3次的萃取液并在 55,℃下吹干,加入1,mL MTBE将固体溶解,用 0.22,μm 有机相滤膜过滤,作为待测溶液.
气质联用(GC-MS)测量降解产物:GC-MS系统包括自动进样器(Agilent 7683),气相色谱(Agilent 6869),TOF质谱(Waters)和色谱柱(30,m×0.25,mm,DB-5MS).1,µL 样品由自动进样器进入气相色谱,进样口段温度为 280,℃,高纯氦气作为载气,载气压力恒定在 91,kPa.柱箱的温度程序设为:进样后炉温在 50,℃保持 2,min,以 8,℃/min的速度升温到 290,℃,保持 3,min,再降温到 50,℃.流出色谱柱的物质进入温度为250,℃的离子源,离子化方式为 EI+,离子束电压为 70,eV,离子电流为 40,µA,在荷质比50~800范围扫描,分流比为3∶1.
1.4 数据分析
使用Masslynx软件对 GC-MS测定的降解产物结果进行定性和定量分析.
使用MATLAB软件对降解产物的定量结果进行主成分分析,在第1主成分和第2主成分上绘制成得分图和载荷图.在主成分分析的过程中,样品的 3个平行实验都作为原始数据进行分析,而不是取均值代之.
2 实验结果和讨论
2.1 不同预处理条件对预处理固体部分和液体部分的影响
图 2为不同预处理条件下预处理固体部分的回收率以及葡聚糖、木聚糖和木质素的回收率,回收率定义为预处理后的质量占预处理前的质量分数. 在1~3组实验中不加乙醇,即为常规稀酸预处理,在4~6组实验中加入乙醇,即乙醇预处理,因此乙醇预处理可看作是对稀酸预处理的一种改进.其中,预处理固体部分的回收率随酸浓度的升高而降低.固体中葡聚糖的回收率受乙醇和酸浓度的影响非常小,随酸浓度的升高略有下降.木聚糖回收率受酸浓度的影响显著,随酸浓度的升高明显降低.固体中木质素的回收率在稀酸预处理中基本不受酸浓度影响,而在乙醇预处理中木质素回收率受酸浓度升高而明显降低.可以看出,木质素的去除需要 2方面的条件:一方面木质素需要通过酸的催化发生化合键的断裂,这一反应与氢离子浓度呈正相关;另一方面,在稀酸预处理后,木质素会经过高温在纤维素表面重新排列形成颗粒状沉积物[20],而乙醇的加入可以有效地溶解木质素片段.

图2 预处理固体部分以及固体中葡聚糖、木聚糖和木质素的回收率Fig.2 Recovery of solid fraction,glucan,xylan and lignin in pretreatment
图 3为稀酸预处理和乙醇预处理中木糖守恒随酸浓度的变化情况.由于葡聚糖在固体和液体部分的回收率相加基本为 100%(图中没有显示),说明在预处理中葡萄糖基本没有发生降解.而木聚糖在固体部分和液体部分的回收率相加不到 100%.在稀酸预处理中,降解的木糖占总量的 10%左右,基本不随酸浓度的变化改变;在乙醇预处理中,降解的木糖比例随酸浓度升高而升高,分别为 30.8%、59.7%和64.7%.在预处理后固体中木聚糖降解为木糖,溶液中的木糖又降解为其他小分子物质,这2步降解在乙醇预处理中均随酸浓度升高而加剧.
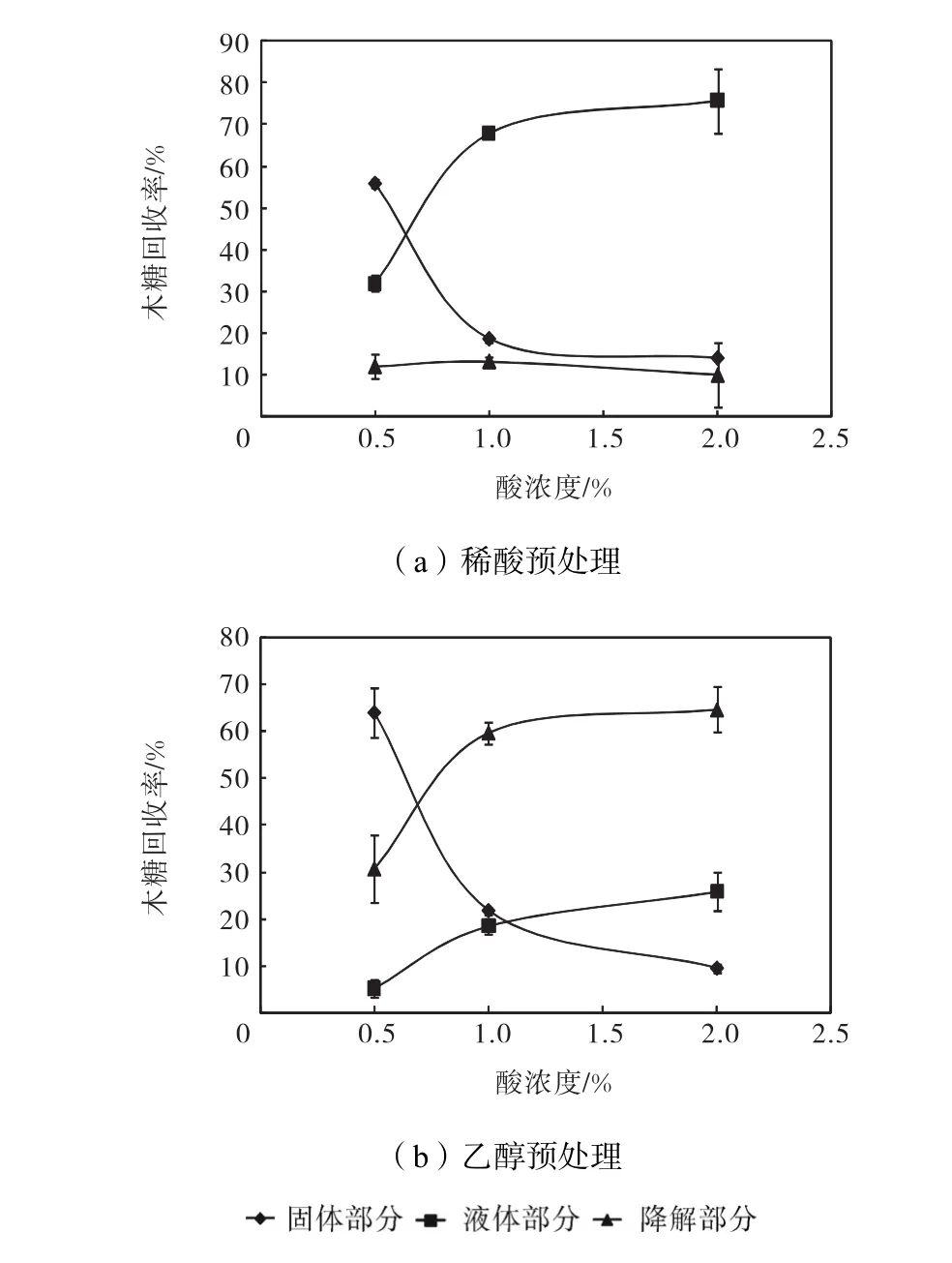
图3 预处理中木糖守恒随酸浓度的变化Fig.3 Xylose balance variations in pretreatments with different acid concentrations
2.2 不同预处理条件对酶解的影响
在葡聚糖负荷 6%、纤维素酶和纤维二糖酶量分别为15,FPU/g葡聚糖和30,CBU/g葡聚糖的条件下,预处理后的固体部分酶解反应72,h,得到酶解液中葡萄糖和木糖的浓度和转化率见图 4.葡萄糖浓度和转化率在不同酸浓度的稀酸预处理中差别不明显,木糖的浓度有一定差别,这与酶解前固体中木聚糖负荷有关.在乙醇预处理中,葡萄糖浓度及转化率随酸浓度的升高而明显提高.2%酸浓度的乙醇预处理葡萄糖浓度和转化率分别为 53.9,g/L和 71.5%,比 2%酸浓度的稀酸预处理分别提高了12.0,g/L和17.0%.
表3列出了酶解初始条件下木聚糖、木质素和其他成分(灰分、蛋白质和萃取物等)的负荷,这 3个因素分别与 72,h酶解后葡萄糖转化率无确定的关系.但木聚糖、木质素和其他成分的负荷总和与葡萄糖转化率呈负相关线性关系(图 5,R2=0.929).因此,影响酶解转化率的不是单一成分的因素,在相同葡聚糖负荷和酶用量下,葡聚糖以外成分的负荷的增加都会抑制酶解的转化率.这提供了一种简便的预测酶解转化率的方法.
2.3 预处理液体部分中降解产物的分析
表 4列出了利用气质联用技术测定预处理液体中降解产物的名称和保留时间,不同预处理条件下的降解产物在种类上没有差别,共鉴别出 33种物质,分为 3类:呋喃类 4种,羧酸类 3种,芳香类 26种.另外有未知物7种.由于气相质谱的检测范围偏向于大分子物质,因此可能存在的甲酸、乙酸等小分子物质无法检测到.
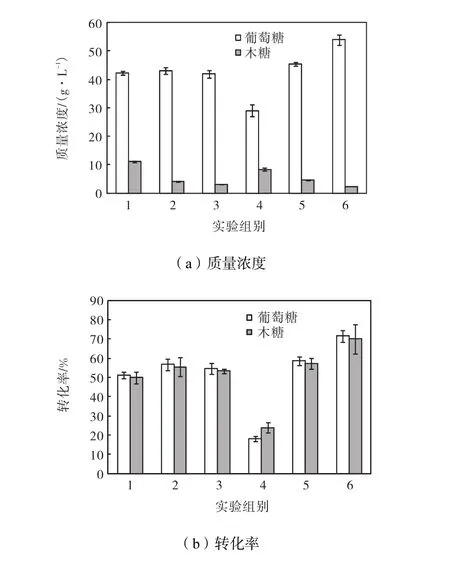
图4 预处理固体酶解后糖浓度和糖转化率Fig.4 Concentration and yield of glucose and xylose in enzymatic hydrolysis

表3 酶解初始条件下木聚糖、木质素与其他成分的负荷与72 h酶解后葡萄糖转化率Tab.3 Loadings of xylan,lignin and others at initial enzymatic condition and glucose conversion after 72 h enzymatic hydrolysis %
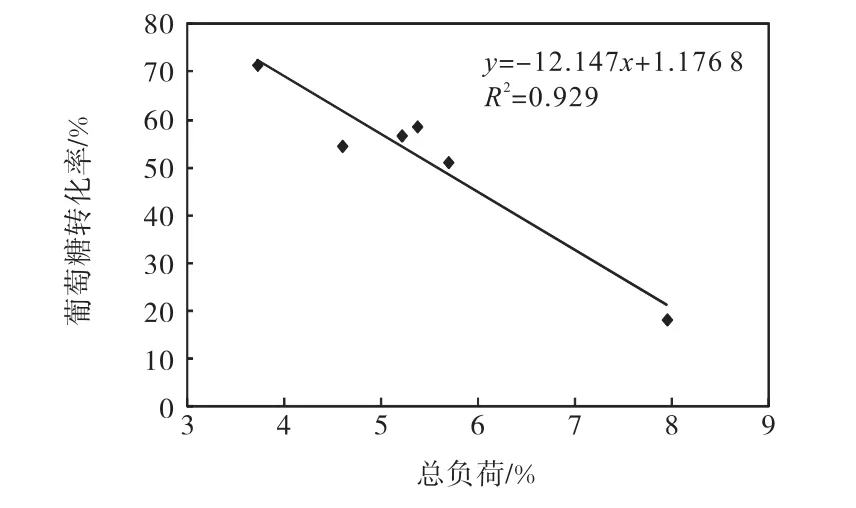
图5 酶解初始条件下木聚糖、木质素与其他成分的总负荷与72 h酶解后葡萄糖转化率的关系Fig.5 Relationship between the loadings of xylan,lignin and others at initial enzymatic hydrolysis and glucose conversion after 72 h enzymatic hydrolysis

表4 气质联用测定预处理液体中的降解产物Tab.4 Degradation products determined by GC-MS in liquid from pretreatment
通过 Masslynx软件对测定的物质进行定量,可得到40种物质在6种条件下的相对含量.利用主成分分析这一数学方法可判断 6种条件下样品中降解产物含量的整体差别(聚类得分图见图 6)和 40种降解产物在不同条件下的差别(载荷图见图7).
主成分分析的聚类得分图(图 6)中每点代表一个样品,各点的距离表示每个样品中所有成分的量的整体差别,距离越近表示整体差别越小,可以归为一类.组1和组4成分含量相近,组2和组3成分含量相近,组5和组6成分含量相近,说明在0.5%酸浓度下,乙醇对木质素等物质的降解影响很小;而在 1%和2%酸浓度下乙醇是木质素降解的主要影响因素.

图6 不同预处理液体部分中降解产物的主成分分析得分图Fig.6 Score plot of principle component analysis of degradation products in liquids from pretreatment
主成分分析的载荷图(图 7)中每点代表一种物质,每点距中心原点的距离可以判断每点在各样品间的差别.各点距原点的距离越远,表示此成分的含量在各组间的差别越大,即可认为这种物质为表征组间差别的标志物,图 7中的标志物可归纳为:糠醛、对甲基苯甲醛、羟甲基糠醛、对乙烯基愈创木酚、香草醛、高香草酸甲酯、对香豆酸、阿魏酸.其中,糠醛、羟甲基糠醛和高香草酸甲酯3种物质在1~3组中含量较高,其他 5种物质在乙醇预处理液中浓度较高.由于乙醇预处理的液体经过减压蒸馏去除乙醇,同时也去除了易挥发的糠醛和羟甲基糠醛,因此这两种物质在4~6组中含量很低.其他6种物质均为木质素降解产生的芳香类化合物,是区别预处理条件的标志物.
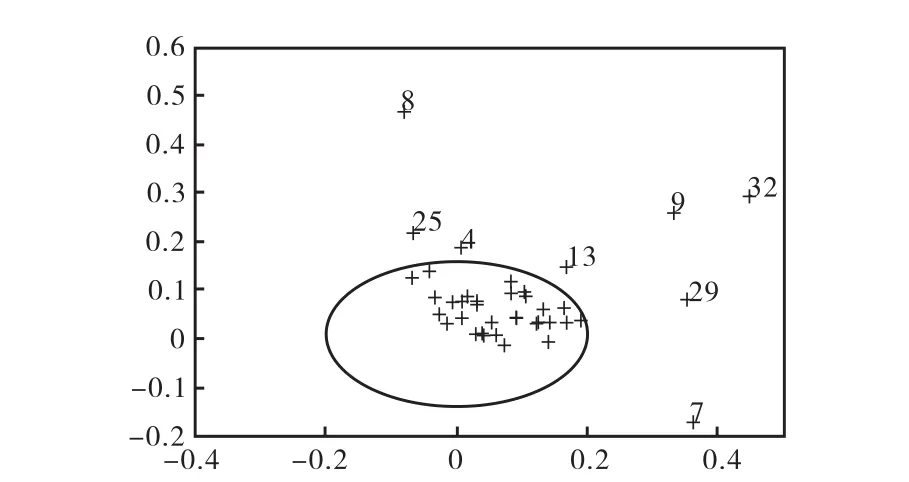
图7 不同预处理液体部分中降解产物的主成分分析载荷图Fig.7 Loading plot of principle component analysis of degradation products in liquids from pretreatment
3 结 论
(1) 硫酸浓度 2%、乙醇浓度 50%、120,℃、60,min预处理条件是稻草秸秆的最优预处理条件;在葡聚糖负荷 6%、纤维素酶和纤维二糖酶用量分别为 15,FPU/g葡聚糖和 30,CBU/g葡聚糖、酶解 72,h的条件下,固体酶解液中葡萄糖浓度和转化率分别可达53.9,g/L和71.5%,明显高于其他预处理条件.
(2) 酶解液葡萄糖转化率与酶解初始条件下木聚糖、木质素和其他成分的总负荷呈近似线性关系,这一点可以帮助预测酶解转化率.
(3) 通过主成分分析对预处理条件进行归类,并得到区别这些预处理条件的6种主要标志物.
[1] Galbe M,Zacchi G. A review of the production of ethanol from softwood[J].Applied Microbiol Biotechnology,2002,59(6):618-628.
[2] Mosier N,Wyman C E,Dale B E,et al. Features of promising technologies for pretreatment of lignocellulosic biomass[J].Bioresource Technology,2005,96(6):673-686.
[3] Wyman C E,Dale B E,Elander R T,et al. Coordinated development of leading biomass pretreatment technologies[J].Bioresource Technology,2005,96(18):1959-1966.
[4] Zhong C,Cao Y X,Li B Z,et al. Biofuels in China:Past,present and future[J].Biofuels Bioproducts and Biorefining,2010,4:326-342.
[5] Yang B,Wyman C. Pretreatment:The key to unlocking low-cost cellulosic ethanol[J].Biofuels Bioproducts and Biorefining,2008,2:26-40.
[6] Li B Z,Balan V,Yuan Y J,et al. Process optimization to convert forage and sweet sorghum bagasse to ethanol based on ammonia fiber expansion(AFEX)pretreatment[J].Bioresource Technology,2010,101(4):1285-1292.
[7] Yang B,Wyman C. Effect of xylan and lignin removal by batch and flowthrough pretreatment on the enzymatic digestibility of corn stover cellulose[J].Biotechnology and Bioengineering,2004,86(1):88-95.
[8] Kahar P,Taku K,Tanaka S. Enzymatic digestion of corncobs pretreated with low strength of sulfuric acid for bioethanol production[J].Journal of Bioscience and Bioengineering,2010,110(4):453-458.
[9] Sun Ye,Cheng J J. Dilute acid pretreatment of rye straw and bermudagrass for ethanol production[J].Bioresource Technology,2005,96(14):1599-1606.
[10] Zhao X B,Cheng K K,Liu D H. Organosolv pretreatment of lignocellulosic biomass for enzymatic hydrolysis[J].Applied Microbiol Biotechnology,2009,82(5):815-827.
[11] Pan X J,Gilkes N,Kadla J,et al. Bioconversion of hybrid poplar to ethanol and co-products using an organosolv fractionation process:Optimization of process yields[J].Biotechnology and Bioengineering,2006,94(5):851-861.
[12] Pan X J,Xie D,Yu R W,et al. Pretreatment of lodgepole pine killed by mountain pine beetle using the ethanol organosolv process:Fractionation and process optimization[J].IndustrialandEngineeringChemistry Research,2007,46(8):2609-2617.
[13] Palmqvist E,Hahn-Hagerdal B. Fermentation of lignocellulosic hydrolysates(Ⅱ):Inhibitors and mechanisms of inhibition[J].Bioresource Technology,2000,74(1):25-33.
[14] Klinke H B,Thomsen A B,Ahring B K. Inhibition of ethanol-producing yeast and bacteria by degradation products produced during pre-treatment of biomass[J].Applied Microbiol Biotechnology,2004,66(1):10-26.
[15] Klinke H B,Ahring B K,Schmidt A S,et al. Characterization of degradation products from alkalin wet oxidation of wheat straw[J].Bioresource Technology,2002,82(1):15-26.
[16] Balan V,Leonardo da Costa Sousa,Chundawat S P S,et al. Enzymatic digestibility and pretreatment degradation products of AFEX-treated hardwoods(Populus nigra)[J].Biotechnology Progress,2009,25(2):365-375.
[17] Chundawat S P S,Vismeh R,Sharma L N,et al. Multifaceted characterization of cell wall decomposition products formed during ammonia fiber expansion(AFEX)and dilute acid based pretreatments[J].Bioresource Technology,2010,101(21):8429-8438.
[18] Chen S F,Mowery R A,Castleberry V A,et al. Highperformance liquid chromatography method for simultaneous determination of aliphatic acid,aromatic acid and neutral degradation products in biomass pretreatment hydrolysates[J].Journal of Chromatography A,2006,1104(1/2):54-61.
[19] National Renewable Energy Laboratory. TP-510-48087 Summative Mass Closure:Laboratory Analytical Procedure Review and Integration[S]. 2010.
[20] Kristensen J B,Thygesen L G,Felby C,et al. Cellwall structural changes in wheat straw pretreated for bioethanol production[J].Biotechnology for Biofuels,2008,1(1):5.
