通过RNAi技术抑制杨树c3h基因表达提高糖转化效率
2012-05-08杨少宗柳新红赵树堂王敏杰卢孟柱
杨少宗,柳新红,赵树堂,王敏杰,卢孟柱*
(1 中国林业科学研究院林业研究所 国家林业局林木培育重点实验室,北京 100091;2 浙江省林业科学研究院,杭州 310023)
通过RNAi技术抑制杨树c3h基因表达提高糖转化效率
杨少宗1,2,柳新红2,赵树堂1,王敏杰1,卢孟柱1*
(1 中国林业科学研究院林业研究所 国家林业局林木培育重点实验室,北京 100091;2 浙江省林业科学研究院,杭州 310023)
利用克隆得到的毛白杨c3h1基因构建其RNAi抑制表达载体,通过根癌农杆菌介导的叶盘法转化银腺杨无性系84 K,Realtime PCR检测表明其转基因株系323、325和322中c3h1基因表达量较野生型植株分别下调89.04%、82.22%和68.38%;茎横切片组化染色和显微结构观察表明转基因植株木质部发育和木质素沉积方式发生了改变;木质素、纤维素含量测定及苯酚—硫酸法总糖含量与HPLC法可溶性总糖和单糖含量检测结果表明:转基因植株木质素含量平均降低23.00%,最高可达39.71%;酸前处理效率最高提高了41.39%;未经酸处理直接酶解的糖化效率是对照植株的2.34 ~ 2.72倍,322株系和323株系比对照植株经酸前处理后再酶解的糖化效率高出81.18%和375.53%。
RNA干扰;杨树;c3h;木质素;糖转化效率
随着人们对环境质量和生活品质的关注以及保障能源安全的需求,生物质能源越来越受到公众和科学界的重视[1~3]。生物乙醇是全球最广泛利用的生物燃料[4~7],但由于目前生产生物乙醇的原料主要来自于谷物等粮食作物[8],在保证粮食安全的前提下解决能源危机问题,必然聚焦于林木生物质能源[9~10]。作为木本模式植物的杨树由于其分布广、实用性强、无性繁殖能力强,加之其速生丰产、遗传背景清楚等优势,无可争议地成为林木生物质能源研究的首选[11~13]。林木生物质能源发展面临的最大技术难题是木质纤维素的水解[14~19],由于木质素与纤维素的紧密结合和对其保护作用是导致纤维素资源利用的主要障碍[9,20~22]。降低木质素含量或改变其结构,将有利于纤维素的解聚和糖转化效率的提高[23~24]。
C3H属细胞色素P450类酶,是木质素生物合成途径中苯丙烷途径的限速酶[25~28],决定木质素单体的碳源流向。已报道的C3H分子量约为58 kDa,随不同来源稍有差异[29~30]。Coleman等[31]利用RNAi技术抑制杨树中C3H的表达,结果木质素总含量显著下降,且伴随着S/G比值改变。本研究通过RNAi技术抑制杨树C3H基因表达,获得低木质素含量、高糖转化效率的转基因植株,为生物质能源杨树的分子遗传育种和更高效地开发利用林木生物质能源提供理论依据和技术支持。
1 材料与方法
1.1 材料
1.1.1 植物材料 毛白杨、84K杨无菌苗均为中国林科院林业所生物技术实验室保存并繁殖;大肠杆菌DH5α、农杆菌GV3101菌种及pBIRNAi质粒均由本实验室保存。
1.1.2 试剂 限制性内切酶及DNA连接酶购自NEB公司;DNA凝胶回收试剂盒、质粒提取试剂盒购自Axygen公司;pGEMâ-T Easy Vector System购自Promega公司;Taq DNA聚合酶购自TaKaRa公司;纤维素酶Celluclast 1.5 L和纤维素二糖酶Novozyme 188购自Sigma公司;其它试剂购自国内有关厂家;PCR引物合成及测序由Introvigen公司完成。
1.2 方法
1.2.1 毛白杨总RNA的提取 取毛白杨形成层材料,按Qiagen RNA提取试剂盒步骤操作提取总RNA。
1.2.2 RT-PCR合成毛白杨cDNA第一链 cDNA第一链合成按SuperScriptTM III First-Strand Synthesis System for RT-PCR操作步骤进行
1.2.3 毛白杨c3h1基因全长cDNA的克隆 以紫花苜蓿(Medicago sativa cv. regen)木质素合成关键酶C3H(香豆酰莽草酸3-羟化酶)基因为信息探针,根据电子克隆的序列拼接结果设计PCR特异引物,以合成的毛白杨cDNA第一链为模板进行PCR扩增反应,PCR扩增的条件为:94℃4 min预变性,(94℃30 s,55℃30 s,72℃90 s)共30个循环,72℃延伸7 min。PCR产物胶回收按Axygen AxyPrep DNAgel Extraction Kit 操作说明,回收纯化的c3h1基因PCR产物亚克隆于pGEM-T Easy载体,质粒提取按Axygen AxyPrep Plasmid miniprep Kit操作流程进行。
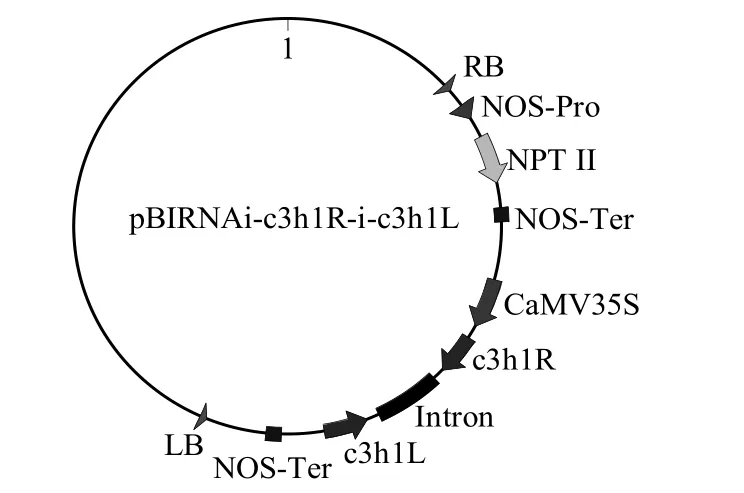
图1 c3h1基因的RNAi抑制表达载体pBIRNAi-c3h1R-i-c3h1L示意图Figure 1 Scheme of pBIRNAi-c3h1R-i-c3h1L vector
1.2.4 c3h1基因RNAi抑制表达载体的构建及转化 根据已获得的毛白杨c3h1基因序列和其他物种之间同源基因的多重比对分析,选取经检索比对后的354 bp保守序列作为目的片段,扩增带有双酶切位点(BamH I/Pac I和Sac I/Age I)的正、反向片段分别连至pBIRNAi表达载体,在含有50 mg/L卡那霉素的LB固体平板上筛选抗性质粒,经PCR和双酶切鉴定得到c3h1基因的RNAi抑制表达载体,命名为pBIRNAi-c3h1 R-i-c3h1L(图1)。
将该质粒用电击法导入农杆菌GV3101菌株的感受态细胞,经PCR鉴定筛选出转化子。通过根癌农杆菌介导的RNAi抑制表达载体pBIRNAi-c3h1R-i-c3h1L叶盘法转化银腺杨无性系84K,经农杆菌的培养、侵染、共培养、选择培养、继代选择培养和生根培养,同时以转化pBIRNAi空载体和未做侵染的叶片外植体作为对照,获得卡那霉素抗性植株移栽温室。
1.2.5 转基因植株的PCR筛选 采用CTAB法提取转基因植株和对照植株扦插繁殖新萌枝条叶片基因组DNA,以NPT-II基因及正、反向插入片段基因特异引物PCR检测。PCR反应程序为:94 ºC预变性4 min;(94ºC变性30 s,60ºC退火30 s,72ºC延伸30 s)共30个循环;72ºC延伸5 min。
1.2.6 Realtime PCR检测c3h1基因的转录表达量变化 取扦插后转基因植株和对照植株新萌枝条叶间隔期指数PI = 3 ~ 5间的茎段,以泛素蛋白基因ubiquitin作内对照,定量PCR反应按照SYBR® Premix Ex TaqTM(TaKaRa)试剂盒提供的方法进行。
1.2.7 转基因植株与对照植株茎横切片组化染色 取PI = 3 ~ 5间茎段,冰冻切片法观察转基因植株与对照植株经Wiesner组化染色的茎横切显微结构。
1.2.8 转基因植株与对照植株木质素、纤维素、半纤维素含量测定 意大利VELP公司FIWE6纤维素测定仪,利用重量法通过计算得到样品中纤维素、半纤维素和木质素的含量。
1.2.9 苯酚-硫酸法测定转基因植株与对照植株的可溶性总糖及糖转化效率 样品具体处理方法(图2)中B、C、D、E处理组。其中,酶水解所用的酶为纤维素酶Celluclast 1.5 L和纤维素二糖酶Novozyme 188。
1.2.10 HPLC法测定转基因植株与对照植株中的单糖含量 样品具体处理方法(图2)中A、C、D、E处理组。色谱分析条件为Waterson Super D糖柱 250 mm×4.6 mm 10 μL;流动相为乙腈:水 = 70:30(超声波脱气,并经0.45 μm滤膜过滤);流速1.00 mL/min;进样量20 μL;柱温35 ºC。
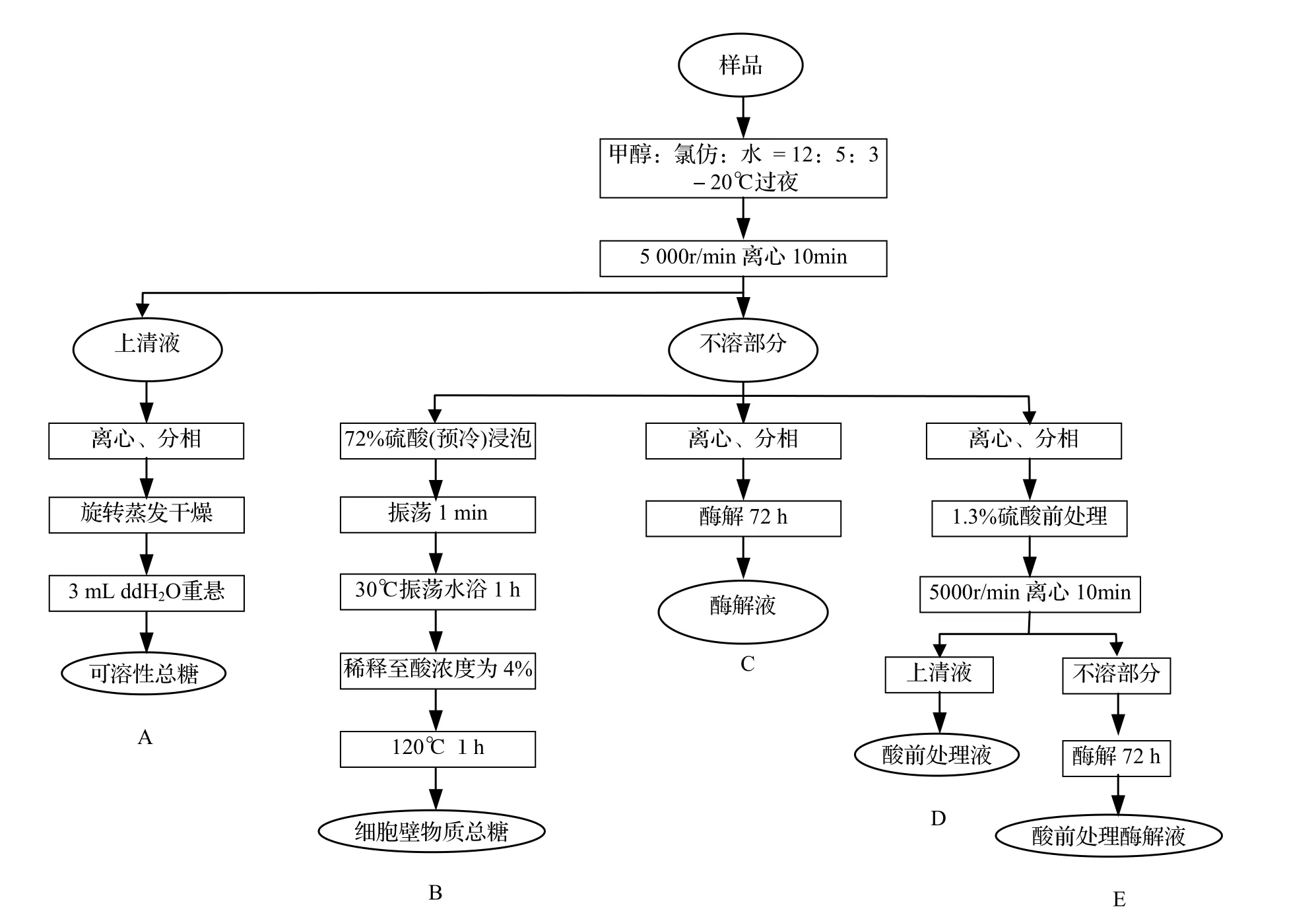
图2 不同测定组的样品处理方法Figure 2 Different treatments for five groups of samples
2 结果与分析
2.1 毛白杨c3h1基因cDNA克隆与分析
根据电子克隆,通过RT-PCR的方法获得毛白杨c3h1基因的cDNA克隆,其完整的开放读码框(ORF)1 527 bp共编码508个氨基酸。
2.2 c3h1基因RNAi抑制表达载体pBIRNAi-c3h1R-i-c3h1L的构建和鉴定
重组质粒pGEM-T-c3h1(连有c3h1 cDNA的T载体)、pGEM-T-c3h1R(连有c3h1正向片段的T载体)、pGEM-T-c3h1L(连有c3h1反向片段的T载体)、pBIRNAi-c3h1R-I(连有c3h1正向片段的pBIRNAi载体)和pBIRNAi-c3h1R-i-c3h1L(含c3h1目标片段发夹结构的表达载体)的PCR、双酶切鉴定和测序结果表明,携带毛白杨c3h1基因目标片段发夹结构的RNAi抑制表达载体构建成功(图3)。
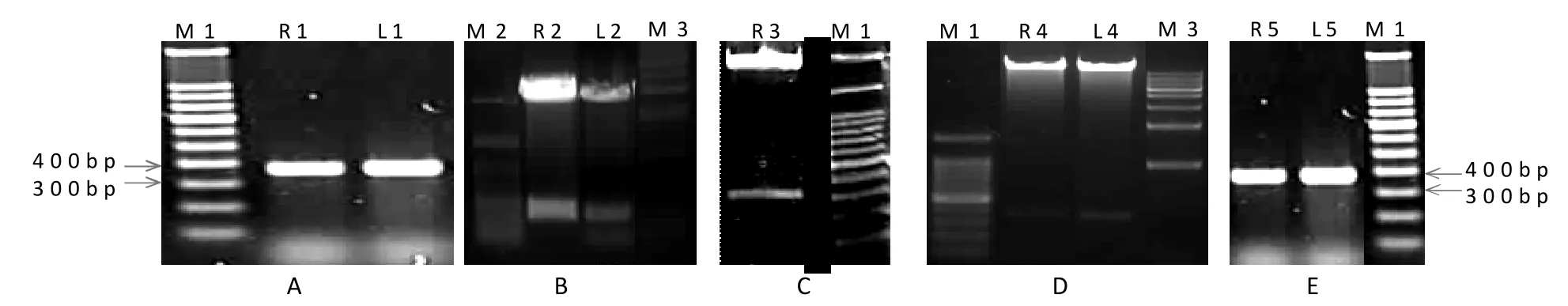
图3 pBIRNAi-c3h1R-i-c3h1L载体构建过程中PCR产物及双酶切结果电泳图Figure 3 Electrophoresis of PCR products and recombinant plasmid DNA digested by BamH I/Pac I and Sac I/Age I during the construction of pBIRNAi-c3h1R-i-c3h1L
2.3 c3h1基因RNAi抑制表达载体pBIRNAi-c3h1R-i-c3hL遗传转化
根癌农杆菌介导的c3h1基因RNAi抑制表达载体pBIRNAi-c3h1R-i-c3hL遗传转化银腺杨无性系84 K,转基因植株和对照植株移栽温室后经低温诱导扦插繁殖,共得到8个转基因株系25个单株。

图4 杨树叶盘法遗传转化及温室栽培Figure 4 Poplar genetic transformation via leaf disc method and propagation in greenhouse
2.4 转基因植株的NPT-II基因及目的基因片段PCR分析
8株转基因阳性植株和pBIRNAi-c3h1R-i-c3h1L质粒均扩增出一条750 bp的特征条带,而野生型84K杨植株呈PCR阴性反应。以pBIRNAi载体上内含子序列intron down和c3h1基因特异序列为c3h1 FP引物对扩增正向目的片段,intron up和c3h1 RP为引物对扩增反向目的片段,转基因阳性植株均扩增出一条400 bp的特征条带,而野生型和转空载对照植株呈PCR阴性反应(图5)。
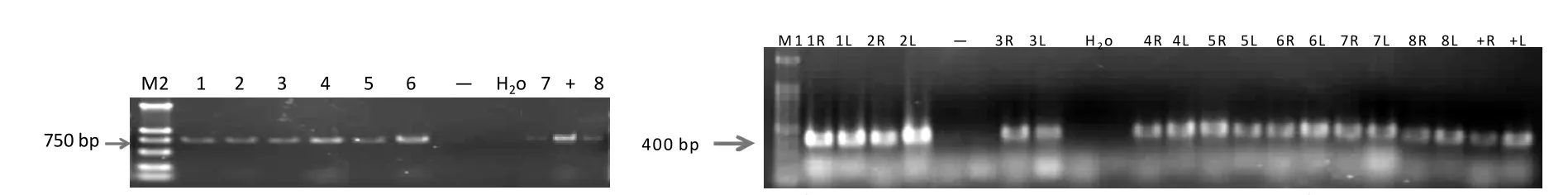
图5 转c3h1基因植株NPT-II基因和c3h1基因特异引物PCR检测结果电泳图Figure 5 c3h1 transgenic plants screened by PCR with NPT-II and c3h1 gene-specific primers
2.5 转基因植株基因表达量
转基因株系中c3h1基因表达量下调由高到低顺序为323(0.1096)>325(0.1778)>322(0.3162),较野生型ck植株分别下调了89.04%、82.22%和68.38%。
2.6 茎横切冰冻切片显微结构观察

图6 茎横切片(20×)显微结构Figure 6 Microscopic structure of stem cross-section
与野生型对照组相比,转基因植株的木质部细胞层数增多,但细胞相对较小,导管发育过程中出现管壁塌陷现象,而对照植株则较为规则;野生型植株韧皮部发育正常,韧皮纤维细胞数量较多,形状规则,染色较均一,而转基因植株的韧皮部较野生型少,韧皮纤维细胞数量少,染色区域不规则;转基因植株木质部细胞次生壁出现不规则加厚现象,而对照植株次生壁的木质素沉积则较为均匀(图6)。
2.7 转基因植株木质素、纤维素、半纤维素含量
各株系酸性木质素含量为323(10.31 mg/g) < 325 (11.74 mg/g) < ck(17.10 mg/g) < 322(17.45 mg/g),323和325株系较野生型分别降低了39.71%和31.35%;转基因株系纤维素含量均高于野生型对照组(图7)。
2.8 转基因植株总糖及糖转化效率
以72%硫酸处理后再稀酸高温水解得到的糖作为细胞壁物质总糖,分析不同处理条件下各株系的糖转化效率。结果表明:经酸前处理的糖转化效率325 (13.46%)>323(9.70%)>ck(9.52%)>322(7.18%);酸处理后再经纤维素复合酶水解,各株系糖转化效率为325(25.76%)>ck(23.38%)>322(11.32%)>323(3.80%);未经酸处理直接酶解的糖转化效率均明显高于对照植株:322(20.51%)>323(18.07%)>325(17.59%)>ck(7.53%),322和323株系比经酸处理后再酶解的相应株系糖化效率高出81.18%和375.53%(图8)。
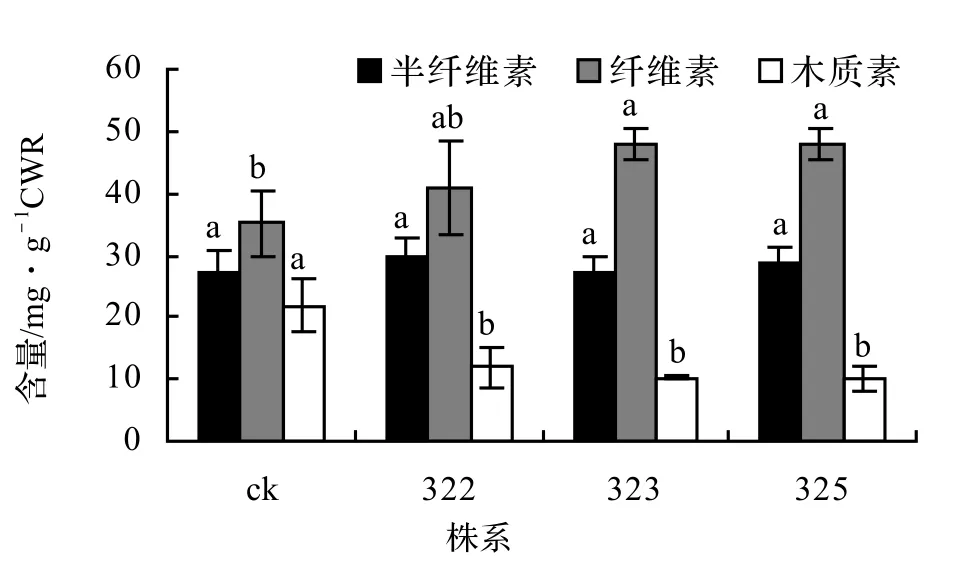
图7 不同株系木质素、纤维素和半纤维素含量分析Figure 7 Content of lignin, hemicellulose and cellulose in different lines
2.9 转基因植株HPLC法可溶性总糖及单糖含量
4组不同方法处理的样品经HPLC测定,可溶性总糖含量为:322(12.18 mg/g)>ck(11.01 mg/g)>323 (10.86 mg/g)>325(10.08 mg/g);经酸前处理的单糖含量为325(138.26 mg/g)>323(135.02 mg/g)>322 (108.16 mg/g)>ck(89.54 mg/g);酸处理后再酶水解的单糖仅有葡萄糖322(43.99 mg/g)>325(43.71 mg/g)>323(38.59 mg/g)>ck(37.77 mg/g);未经酸处理直接酶解得到的单糖均高于对照植株:323(87.77 mg/g)>322(80.11 mg/g)>325(57.09 mg/g)>ck(51.96 mg/g)。未经酸前处理直接酶解的323和322株系葡萄糖的得率与对照植株ck相比,分别提高了57.42%和47.91%,比经酸处理后再酶解的相应株系高出73.70%和43.17%,而对照植株则无显著变化(图9)。
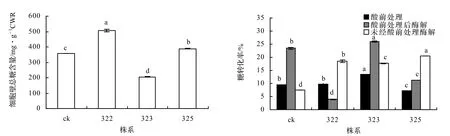
图8 不同株系糖化效率Figure 8 Histogram of saccharification efficiency of c3h1 transgenic lines
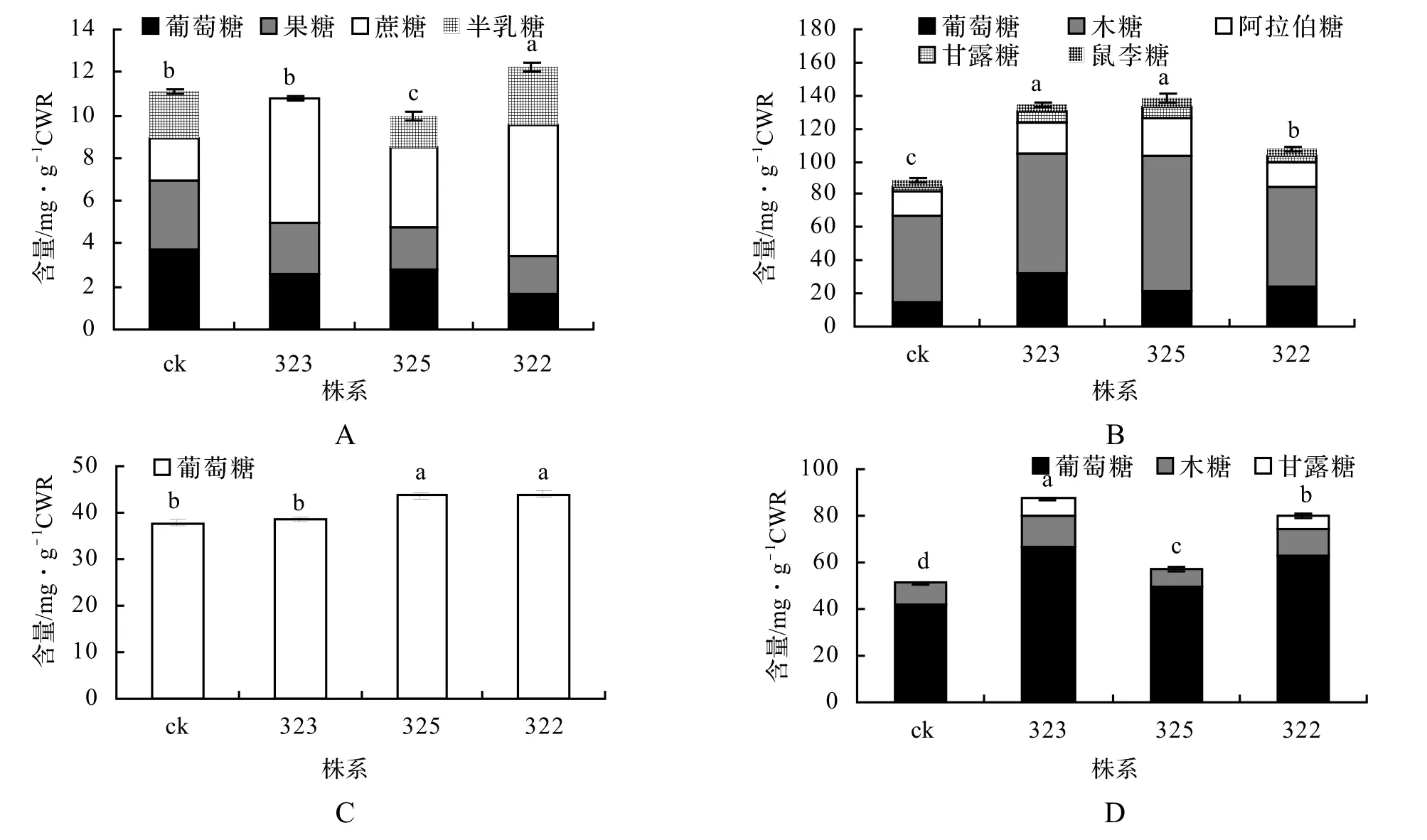
图9 各株系不同处理组可溶性总糖和单糖含量测定Figure 9 Soluable sugar and monomeric sugar in c3h1 transgenic lines by the phenol-sulfuric acid assay and HPLC
3 讨论
(1)对扦插繁殖后的转基因植株323、325和322三个株系和对照植株的Realtime PCR定量检测和茎横切组化染色及显微结构观察结果表明,c3h1基因受抑制的转基因植株次生木质部细胞层数增多,暗示其可能的早期生长加速,但由于细胞较小,故外部形态未见明显变化;导管壁的塌陷和次生壁的区域性加厚显示转基因植株木质素沉积方式发生了改变[32]。
(2)木质素、纤维素和半纤维素含量的测定结果表明,转基因植株木质素含量的降低与c3h1基因的转录表达量大体一致,木质素降低的转基因植株均表现为纤维素含量较高,而半纤维素含量无明显变化。抑制其他基因如PAL、C4H、C3’H等基因表达多表现为木质素含量的降低和组成成分比例的改变[29,31~35],反义抑制烟草omt基因木质素降低了62%,但在杨树中木质素含量未发生改变,杨树中木质素含量下调最高约45%的为转4cl基因反义抑制结构。323株系下调了39.71%,与抑制其他木质素合成关键酶基因相比效果较好,故RNAi抑制C3H1基因表达可有效降低杨树木质素含量。
(3)总糖含量及糖转化效率的分析表明,木质素含量的降低与纤维素的糖转化效率的提高紧密相关。酸前处理水解的底物主要为半纤维素,经酸前处理去除大部分半纤维素,残留物再经酶水解的水解效率代表了纤维素的糖转化效率。酸前处理解除了半纤维素与纤维素的结合,纤维素晶状结构发生解聚,增加了酶与纤维素的可及度,酶解效率增高。未经酸前处理直接酶解的转基因植株糖化效率明显高于对照植株,甚至高于经酸前处理后再酶处理的糖化效率,说明木质素含量的降低使得酶与纤维素的接触几率更大,酶解效率更高。
(4)可溶性总糖和单糖含量HPLC检测结果表明,木质素含量的降低导致细胞可溶性糖含量的增加及纤维素糖转化效率的提高。细胞壁物质经酸处理后酶解得到的葡萄糖来自于纤维素的酶水解,其含量多少代表了纤维素的糖化效率高低。未经酸前处理直接酶解的转基因株系葡萄糖得率比对照植株高,323株系比经酸处理后再酶解的相应株系高出73.70%,说明了木质素含量的降低可能引发细胞中可溶性糖和纤维素的代偿性增加,由于木质素含量降低,减轻了对纤维素的束缚作用,游离的纤维素增多,酶的可及度增大,使得酶解糖化效率显著提高。木质素含量最低的转基因323株系,表现为基因表达量下调最多,细胞壁总糖、可溶性总糖及纤维素的糖化效率最高。
本研究结果表明,通过基因调控降低木质素含量,将有可能在一定程度上打破细胞壁物质的糖化作用障碍,使得转基因植株的可溶性糖含量升高,纤维素的酶解糖化效率增强。转基因株系323的优良表现,尤其是其不经酸前处理直接酶解即可达到经酸前处理后再酶解所能达到的水解效率,为更好地利用木质纤维素生物质能源提供了一个有积极意义的信息。
[1] Pedersen J F,Vogel K P,Funnell D L. Impact of reduced lignin on plant fitness[J]. Crop Sci,2005,45(3):812-819.
[2] Yuan J S,Tiller K H,Al-Ahmad H,et al. Plants to power: bioenergy to fuel the future[J]. Trends Plant Sci,2008,13(8):421-429.
[3] Ruane J,Sonnino A,Agostini A. Bioenergy and the potential contribution of agricultural biotechnologies in developing countries[J]. Biom Bioener,2010,34(10):1 427-1 439.
[4] Nagle N,Ibsen K,Jennings E. A process economic approach to develop a dilute-acid cellulose hydrolysis process to produce ethanol from biomass[J]. App Biochem Biotech,1999,79(1 ~ 3):595-607.
[5] Petersson A,Thomsen M,Hauggaard-Nielsen H,et al. Potential bioethanol and biogas production using lignocellulosic biomass from winter rye, oilseed rape and faba bean[J]. Biom Bioener,2007,31(11 ~ 12):812-819.
[6] Sassner P,Martensson C G,Galbe M,et al. Steam pretreatment of H2SO4-impregnated Salix for the production of bioethanol[J]. Biores Tech, 2008,99(1):137-145.
[7] Sticklen M. Plant genetic engineering for biofuel production: towards affordable cellulosic ethanol[J]. Nature Reviews Genetics,2008(9):433 -443.
[8] Pimentel D,Patzek T. Ethanol Production Using Corn, Switchgrass, and Wood; Biodiesel Production Using Soybean and Sunflower[J]. Natural Resour Res,2005(14):65-76.
[9] Rubin E. Genomics of cellulosic biofuels[J]. Nature,2008(454):841-845.
[10] 何蒲明. 基于粮食安全的林业生物质能发展[J]. 林业经济问题,2008,28(4):314-318.
[11] 魏建华,宋艳茹. 木质素生物合成途径及调控的研究进展[J]. 植物学报(英文版),2001,43(8):771-779.
[12] Lin Z,Xu Y. Lignin biosynthesis and its molecular regulation[J]. Progress in Natural Science,2003,13(5):321-328.
[13] 赵华燕,魏建华,路静,等. 利用反义CCoAOMT基因培育低木质素含量毛白杨的研究[J]. 自然科学进展,2004,14(9):1 067-1 071.
[14] Wyman C E. Ethanol from lignocellulosic biomass: Technology, economics, and opportunities[J]. Bioresour Tech,1994,50(1):3-15.
[15] Zhang M,Franden M A,Newman M,et al. Promising ethanologens for xylose fermentation: Scientific note[J]. App Bioch Biotech, 1995, 52 (1):527-536.
[16] Dale B E,Leong C K,Pham T K,et al. Hydrolysis of lignocellulosics at low enzyme levels: Application of the AFEX process[J]. Bioresour Tech,1996,56(1):111-116.
[17] Gregg D J,Saddler J N. Factors affecting cellulose hydrolysis and the potential of enzyme recycle to enhance the efficiency of an integratedwood to ethanol process[J]. Biotech Bioeng,1996,51(4):375-383.
[18] Lee J. Biological conversion of lignocellulosic biomass to ethanol[J]. J Biotech,1997,56(1):1-24.
[19] Virkajarvi I,Niemel M,Hasanen A,et al. Cellulosic ethanal via biochemical processing poses a challenge for developers and implementers[J]. BioResources,2009,4(4):1 718-1 735.
[20] Elander R T,Hsu T. Processing and economic impacts of biomass delignification for ethanol production[J]. App Biochem Biotech, 1995, 52 (1):463-478.
[21] Iconomou L,Psarianos C,Koutinas A. Ethanol fermentation promoted by delignified cellulosic material[J]. J Fermen Bioeng, 1995,79(3):294-296.
[22] 宋东亮,沈君辉,李来庚. 高等植物细胞壁中纤维素的合成[J]. 植物生理学通讯,2008,44(4):791-796.
[23] Chen F,Dixon R. Lignin modification improves fermentable sugar yields for biofuel production[J]. Nat Biotech,2007,25(7):759-761.
[24] Li X,Weng J,Chapple C. Improvement of biomass through lignin modification[J]. Plant J,2008,54(4):569-581.
[25] Whetten R,Sederoff R. Lignin Biosynthesis[J]. Plant Cell,1995,7(7):1 001-1 013.
[26] Schoch G,Goepfert S,Morant M,et al. CYP98A3 from Arabidopsis thaliana is a 3’-hydroxylase of phenolic esters, a missing link in the phenylpropanoid pathway[J]. J Biol Chem,2001,276(39):36 566-36 574.
[27] Boerjan W,Ralph J,Baucher M. Lignin Biosythesis[J]. Ann Rev Plant Biol,2003(54):519-546.
[28] 李金花,张绮纹,牛正田,等. 木质素生物合成及其基因调控的研究进展[J]. 世界林业研究,2007,20(1):29-37.
[29] Franke R,Humphreys J,Hemm M,et al. The Arabidopsis REF8 gene encodes the 3-hydroxylase of phenylpropanoid metabolism[J]. Plant J, 2002,30(1):33-45.
[30] Abdulrazzak N,Pollet B,Ehlting J,et al. A coumaroyl-ester-3-hydroxylase insertion mutant reveals the existence of nonredundant meta-hydroxylation pathways and essential roles for phenolic precursors in cell expansion and plant growth[J]. Plant Physiol, 2006,140(1):30-48.
[31] Coleman H,Park J,Nair R,et al. RNAi-mediated suppression of p-coumaroyl-CoA 3'-hydroxylase in hybrid poplar impacts lignin deposition and soluble secondary metabolism[J]. Proceed Nati Acad Sci,2008,105(11):4 501-4 506.
[32] Gullo M,Salleo S,Piaceri E,et al. Relations between vulnerability to xylem embolism and xylem conduit dimensions in young trees of Quercus corris[J]. Plant, Cell & Environ,1995,18(6):661-669.
[33] Elkind Y,Edwards R,Mavandad M,et al. Abnormal plant development and down-regulation of phenylpropanoid biosynthesis in transgenic tobacco containing a heterologous phenylalanine ammonia-lyase gene[J]. Proceed Nat Acad Sci USA,1990,87(22):9057-9061.
[34] Sewalt VJH,Ni W,Blount JW,et al. Reduced lignin content and altered lignin composition in transgenic tobacco down-regulated in expression of L-phenylalanine ammonia-lyase or cinnamate 4-hydroxylase[J]. Plant Physiol,1997,115(1):41-50.
[35] Blount JW,Korth KL,Masoud SA,et al. Altering expression of cinnamic acid 4-hydroxylase in transgenic plants provides evidence for a feedback loop at the entry point into the phenylpropanoid pathway[J]. Plant Physiol,2000,122(1):107-116.
Downregulation of Coumaroyl Shikimate 3-hydroxylase in Poplar by RNAi Technique
YANG Shao-zong1,2,LIU Xin-hong2,ZHAO Shu-tang1,WANG Min-jie1,LU Meng-zhu1*
(1. Research Institute of Forestry, Chinese Academy of Forestry, Key Laboratory of Tree Breeding and Cultivation, State Forestry Administration, Beijing 100091, China; 2. Zhejiang Forestry Academy, Hangzhou 310023, China)
Efficient hydrolysis of lignocellulose is the biggest technical challenges on forest bioenergy development due to lignin hindrance to bioconversion from lignocellulose to ethanol in poplar. Experiments were conducted to genetically modify poplar to decrease lignin content in order to enhance fermentable sugars which can be converted to ethanol. c3h1 gene in Populus tomentosa was cloned and its RNAi vector expressing ds-RNA was constructed. 8 transgenic lines harboring the RNAi constructs were obtained via the leaf-disc method and propagated by cutting for each lines in the greenhouse. The transcription level of c3h1 in RNAi inhibition transgenic lines analyzed by real-time PCR decreased 89.04%, 82.22% and 68.38% in the RNAi inhibition line 323, 325 and 322 compared with the control. Stem cross-section staining and microstructure observations showed that the xylem development and lignin deposition pattern in transgenic plant changed. Transgenic plants with lowest lignin content generally matched with the highest content of cellulose and soluble total sugars and the highest sacchrification efficiency. The results indicated that lignin is probably the major factor in recalcitrance of cell walls to saccharification. Moreover, it demonstrated that genetic reduction of lignin content effectively overcame cell wall recalcitrance to bioconversion.
RNAi; poplar; c3h; lignin; sacchrification
S718.4
A
1001-3776(2012)03-0001-08
2011-12-20;
2012-03-10
863项目“高产优质多抗杨树分子与细胞高效育种技术及品种创制”(2006AA100109-1),863项目“特色植物高效转化技术的建立”(2007AA10Z182),863项目“杨树木材发育的基因调控研究”(2006AA10Z122)
杨少宗(1974-),男,安徽阜阳人,助理研究员,从事林木遗传育种研究;*通讯作者。
