轻、中度疼痛对第一、第二躯体感觉皮质激活的功能磁共振成像研究①
2012-05-08公维义薛蕴菁宋施委张良成苏建生范崇玖
公维义,薛蕴菁,宋施委,张良成,苏建生,范崇玖
轻、中度疼痛对第一、第二躯体感觉皮质激活的功能磁共振成像研究①
公维义1a,薛蕴菁1b,宋施委1c,张良成1a,苏建生1a,范崇玖1a
目的研究轻、中度疼痛电刺激对第一躯体感觉皮质(SⅠ)和第二躯体感觉皮质(SⅡ)的激活规律。方法对7名右利手健康志愿者右足测定痛觉阈值后,给予痛觉阈值和2倍痛觉阈值刺激,进行视觉模拟评分(VAS)和疼痛分级,行功能磁共振成像。结果痛觉阈值和2倍痛觉阈值刺激分别引起志愿者轻度疼痛和中度疼痛;两种刺激均可激活SⅠ和SⅡ,并以左侧为主。其中,轻度疼痛主要激活左侧SⅠ,对两侧SⅡ激活区域小;中度疼痛明显激活左侧SⅠ和双侧SⅡ。结论SⅠ对轻、中度疼痛电刺激反应一致,但SⅡ对中度疼痛电刺激的反应更为明显。
疼痛;电刺激;躯体感觉皮质;功能磁共振成像
[本文著录格式]公维义,薛蕴菁,宋施委,等.轻、中度疼痛对第一、第二躯体感觉皮质激活的功能磁共振成像研究[J].中国康复理论与实践,2012,18(5):423-425.
国际疼痛研究协会将疼痛定义为组织损伤或潜在组织损伤引起的不愉快的感觉和情感体验[1]。因疼痛是一种主观感受,受环境、记忆、情感和认知等多因素影响,对疼痛的研究极为复杂。功能磁共振成像(functionalmagnetic resonance imaging,fMRI)具有较高的空间分辨率,是在较宽时间窗上整体激活的反应,现已广泛用于疼痛的研究[2-4]。本课题应用fMRI研究轻、中度疼痛对第一躯体感觉皮质(primary somatosensory cortex,SⅠ)和第二躯体感觉皮质(secondary somatosensory cortex,SⅡ)的影响。
1 资料与方法
1.1 一般资料 经福建医科大学道德伦理委员会批准,招募健康志愿者。入选标准:①年龄20~39岁;②右利手(根据爱丁堡手偏利量表[5]);③高中以上文化程度,可明确理解并配合试验流程;④既往无明显疼痛经历、无神经和精神疾病和相关试验经历。排除试验过程中不能耐受或要求退出试验者。试验前对试验内容、目的和过程进行培训,并获得知情同意书。
共7名志愿者入选,其中男性4名,女性3名,年龄(28±5)岁,身高(168±11)cm,体质量(56±7)kg。
1.2 痛觉阈值测定及疼痛分级 志愿者入MRI室,平卧于检查床,右足拇指磨砂膏去除死皮,涂导电膏,将盘式刺激电极自粘胶固定,两电极间距1 cm。安静10m in后,将DAQ816E型Epoch XP神经系统工作站(美国AXOH SYSTEMS公司)连接刺激电流放大器和盘式刺激电极,实施经皮直流电刺激。刺激形式:串刺激;波形:方波;刺激时程:200μs,任务时相3 s,静息时相27 s。
刺激强度从0开始,每次增加0.5m A,直至志愿者示意出现针扎和/或疼痛感觉;然后降低,直至志愿者示意针扎和/或疼痛感觉消失。若出现和消失值相同,记录该数值,定为“痛觉阈值”,重复测量3次,取平均值。
采用视觉模拟评分(VAS)进行疼痛分级:0分为无痛,30分以下为轻度疼痛,30~60分为中度疼痛,60~90分为重度疼痛;90分及以上为难以忍受的疼痛。
1.3 fMRI 痛觉阈值测定后1周,志愿者入MRI室,平卧于检查床,带眼罩和耳塞,枕部及双颞部垫海绵垫,并要求受试者保持头部不动。右足拇指磨砂膏去除死皮,涂导电膏,将盘式刺激电极自粘胶固定,两电极间距为1 cm。安静休息10m in,随机给予阈值和2倍阈值电刺激,在每次给予刺激6 s后行fMRI扫描,扫描静息间隔时间10m in。刺激均采用block设计,即刺激—静息—刺激循环模式,每个刺激态和静息态均为30 s,直至fMRI扫描结束。
应用MAGNETOM Verio型3.0 T磁共振成像系统(德国SIEMENS公司)采集数据,标准头部线圈。常规SE序列横轴位T1W I作为解剖背景图像,扫描参数:TR 580 ms,TE 18 ms,层厚3 mm,层间距0.75 mm,FOV:256×192 mm,矩阵:256×192,Flip:56 deg,Averages:2,从枕大孔到头顶共36层。在T1W I相同层面上,血氧水平依赖(blood oxygenation level dependent,BOLD)fMRI成像扫描采用EPI序列,扫描参数:TR 3000ms,TE 30ms,层厚3mm,间隔0.75mm,FOV:192×192mm,矩阵64×64。定位与解剖像一致,从枕大孔到头顶共36层。扫描时间6 m in。数据分析采用统计参数图(SPM 2)处理,弃除功能扫描前6个采样点,依次进行时间校正、头动校正、空间标准化空间平滑,与标准模型进行匹配。处理过程采用t检验,显著性水平α=0.001,10个体素为有效激活体素。在统计参数图中选定SⅠ和SⅡ进行感兴趣区分析。
2 结果
与阈值刺激比较,2倍阈值刺激平均电流强度和VAS评分提高(P<0.05)。阈值刺激产生轻度疼痛,2倍阈值刺激产生中度疼痛。见表1。

表1 阈值刺激和2倍阈值刺激比较
轻、中度疼痛均可激活SⅠ和SⅡ,并以左侧为主。其中,轻度疼痛明显主要激活左侧SⅠ,双侧SⅡ也有激活。中度疼痛激活左侧SⅠ和双侧SⅡ,SⅡ激活以左侧为主,激活总面积大于轻度疼痛(图1、图2)。
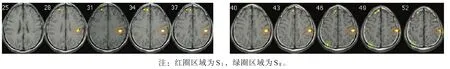
图1 轻度疼痛刺激

图2 中度疼痛刺激
3 讨论
BOLD-fMRI利用氧合血红蛋白和去氧血红蛋白对磁性效应的差异,测量局部脑血流状态。当神经元活动增强时,脑功能区的血流量显著增加,T2信号增强,在各种神经功能研究中具有重要的应用价值[6]。虽然疼痛是一种主观感受,但人体受到疼痛刺激时,相关功能区的局部脑血流增加,为利用BOLD-fMRI对疼痛进行研究提供了可能。
本研究以严格的标准选择志愿者,试验前进行了相关培训,通过配戴耳塞和眼罩避免外界声光干扰。为了避免对疼痛刺激的预期效应和痛觉习惯化的形成,在进行痛觉评分和磁共振检查时随机给予轻或中度疼痛刺激;刺激间隔10m in,以消除前次刺激对后面刺激的影响。由于在神经激活和BOLD-fMRI检测之间时间延迟6~9 s[7],因此,设计在给予刺激6 s后进行磁共振扫描,以避免神经激活与BOLD之间产生的时间延迟,获得良好的空间效应。
人体对疼痛的感知在大脑皮质有多重代表区,包括疼痛感觉区、情感认知评估区及疼痛调节相关区等[8]。SⅠ和SⅡ为疼痛感觉区,急性疼痛激活的核心网络也包括SⅠ和SⅡ,镇痛药物亦对这些区域具有明显作用[9-14]。
SⅠ位于中央后回和旁中央小叶后部,相当于3、1和2区,特点是左右交叉,上下倒置,与躯体有明确的定位关系,是浅、深躯体感觉中枢。本研究显示,轻、中度疼痛均可激活对侧SⅠ区,与其功能一致,即SⅠ区可确切感知对侧不同强度的疼痛刺激。
SⅡ位于顶上小叶,相当于5区和7区,在功能上与第一躯体感觉区相似。但SⅡ双侧代表,以对侧为主,对来自皮肤、肌腱、关节和内感受器的刺激进行高级的分析综合。SⅡ不但处理躯体感觉[15],还与感觉运动整合[16]、触觉注意和学习[17]有关,并与其他皮质协调整合身体双侧感觉信息[18]。因此,SⅡ具有更为复杂的功能。
本研究中,虽然轻、中度疼痛均可激活SⅡ区,但轻度疼痛对SⅡ区激活面积小;而中度疼痛刺激明显激活双侧SⅡ,提示人体对中度疼痛产生明确的分析整合,并可能引起情感认知和疼痛调节等生理反应。
综上所述,轻、中度疼痛刺激均可激活对侧SⅠ,中度疼痛对双侧SⅡ激活大于轻度疼痛,显示SⅠ和SⅡ对轻、中度疼痛具有不同的功能特征。
[1]M erksey H,Bogduk N.Classification of Chronic Pain[M].Seattle:IASPPress,1994.
[2]Talbot JD,Marrett S,Evans AC,et al.Multiple representations of pain in human cerebral cortex[J].Science,1991,251(4999): 1355-1358.
[3]Sawamoto N,Honda M,Okada T,etal.Expectation of pain enhances responses to nonpainful somatosensory stimulation in the anterior cingulate cortex and parietal operculum/posterior insula:an event-related functionalmagnetic resonance imaging study[J].JNeurosci,2000,20(19):7438-7445.
[4]Ploghaus A,Tracey I,Gati JS,et al.Dissociating pain from its anticipation in the human brain[J].Science,1999,284(5422): 1979-1981.
[5]Oldfield RC.The assessment and analysis of handedness:the Edinburgh inventory[J].Neuropsychologia,1971,9:97-113.
[6]Buonocore MH,Hecht ST.Functionalmagnetic resonance imaging depicts the brain in action[J].Nat Med,1995,1(4): 379-381.
[7]Tracey I.Imaging pain[J].Br JAnaesth,2008,101(1):32-39.
[8]Talbot JD,Marrett S,Evans AC,et al.Multiple representations of pain in human cerebral cortex[J].Science,1991,251(4999): 1355-1358.
[9]Casey KL,Svensson P,Morrow TJ,etal.Selective opiatemodulation of nociceptive processing in the human brain[J].JNeurophysiol,2000,84(1):525-533.
[10]Geha PY,Baliki MN,Chialvo DR,et al.Brain activity for spontaneous pain of postherpetic neuralgiaand its modulation by lidocaine patch therapy[J].Pain,2007,128(1-2):88-100.
[11]Rogers R,W ise RG,Painter DJ,etal.An investigationto dissociate the analgesic and anesthetic properties of ketam ine using functional magnetic resonance imaging[J].Anesthesiology, 2004,100(2):292-301.
[12]Schweinhardt P,Bountra C,Tracey I.Pharmacological fMRI in the development of new analgesic compounds[J].NMR Biomed,2006,19(6):702-711.
[13]Wagner KJ,Sprenger T,Kochs EF,etal.Imaging human cerebral pain modulation by dose dependent opioid analgesia:a positron em ission tomography activation study using rem ifentanil[J].Anesthesiology,2007,106(3):548-556.
[14]W ise RG,Rogers R,Painter D,et al.Combining fMRIwith apharmacokinetic model to determ ine which brain areas activated by painful stimulation are specifically modulated by rem ifentanil[J].Neuroimage,2002,16(4):999-1014.
[15]Burton H,Sinclair RJ.Second somatosensory cortical area in macaquemonkeys.II.Neuronal responses to punctate vibrotactile stimulationof glabrous skin on the hand[J].Brain Res, 1991,538(1):127-135.
[16]Huttunen J,W ikstrom H,Korvenoja A,et al.Significance of the second somatosensory cortex insensorimotor integration: enhancement of sensory responses during fingermovements[J].Neuroreport,1996,7(5):1009-1012.
[17]M ima T,Nagam ine T,Nakamura K,etal.A ttentionmodulates both primary and second somatosensory cortical activities in humans:amagnetoencephalographic study[J].JNeurophysiol, 1998,80(4):2215-2221.
[18]Iwamura Y,Iriki A,Tanaka M.Bilateral hand representation in the post central somatosensory cortex[J].Nature,1994,369 (6481):554-556.
Prim ary and Secondary Som atosensory Cortex Activation Induced by M ild and M oderate Pain:A Functional M agnetic Resonance Im aging Study
GONG Wei-yi,XUE Yun-jing,SONG Shi-wei,et al.Department of Anesthesiology,Union Hospital of Fujian Medicine University,Fuzhou 350001,Fujian,China
Ob jectiveTo explore the activation of the primary somatosensory cortex(SⅠ)and secondary somatosensory cortex(SⅡ)underm ild and moderate pain.M ethods7 healthy right-handed volunteers accepted electrostimulation of 1 and 2 times pain threshold respectively.The severity of pain was determ ined with the Visual Analogue Score(VAS),and they received functionalmagnetic resonance imaging(fMRI)simultaneously.Resu lts1 and 2 times pain threshold electrical stimulation caused m ild and moderate pain respectively.Both m ild and moderate pain activated contralateral SⅠsim ilarly,and bilateral SⅡwith pain intensity.ConclusionSⅠand SⅡrespond to them ild andmoderate pain in differentways.
pain;electrostimulation;somatosensory cortex;functionalmagnetic resonance imaging
R441.1
A
1006-9771(2012)05-0423-03
2011-11-16)
福建省卫生厅青年基金资助项目(2008-1-23)。
1.福建医科大学附属协和医院,a.麻醉科;b.核磁共振室;c.神经外科,福建福州市350001。作者简介:公维义(1973-),男,吉林延边人,博士,副主任医师,主要研究方向:急慢性疼痛的诊疗。
10.3969/j.issn.1006-9771.2012.05.008
