血管内栓塞大脑中动脉制作非人灵长类卒中慢性期模型的研究①
2012-05-08王强张通赵春禹徐建民温枚裴志胜
王强,张通,赵春禹,徐建民,温枚,裴志胜
·专题·
血管内栓塞大脑中动脉制作非人灵长类卒中慢性期模型的研究①
王强1,2a,张通1,2a,赵春禹1,2a,徐建民1,2b,温枚1,2c,裴志胜1,2c
目的建立非人灵长类脑梗死慢性期动物模型。方法雄性成年恒河猴10只,血管内介入栓塞动物利手对侧大脑中动脉。依栓塞节段不同,分为M 1段栓塞组(n=3)、上干栓塞组(n=5)和下干栓塞组(n=2)。通过标准神经量表和小槽食丸取回任务评定运动功能。结果M 1段栓塞组均在急性期死亡。上干栓塞组均存活,MRI可见梗死灶,急性期一侧肢体瘫痪,其中4只功能障碍在慢性期持续存在,另外1只运动功能恢复。下干栓塞组急性期一侧肢体瘫痪,运动缺陷恢复迅速且完全。结论大脑中动脉上干栓塞动物模型存活率高,慢性期存在运动功能障碍,适合于慢性期研究。
脑梗死;慢性期;非人灵长类;动物模型;血管内栓塞
[本文著录格式]王强,张通,赵春禹,等.血管内栓塞大脑中动脉制作非人灵长类卒中慢性期模型的研究[J].中国康复理论与实践,2012,18(5):401-405.
脑卒中是目前成人致残的主要原因[1]。现有的方法在脑卒中慢性期(平台期)治疗效果一直不明显。尽管细胞移植[2]、脑刺激[3]及强制诱导运动治疗[4]等有望提高疗效,但其疗效及促进运动功能恢复的潜在机制尚待研究。而理想的脑卒中慢性期动物模型是进行实验研究的基础[5]。
虽然啮齿类已被广泛用来制备脑缺血模型[6],但是非人灵长类的神经环路、脑血管系统、灰/白质比与人类更加相似[7],而且可像人类一样使用手臂完成复杂的运动任务。因此在研究神经生理和神经解剖机制方面,非人灵长类模型越来越受重视。
目前灵长类动物卒中模型多为急性期脑缺血模型[8-9]。成功的卒中慢性期模型只有颅骨切开后直接电凝切除大脑中动脉法。然而这种方法手术难度高,对动物创伤大,不宜推广[10-11]。
血管内介入栓塞法是一种微创技术,可避免开颅、局部脑组织损伤等问题,近年来已被用于非人灵长类脑缺血/再灌注模型的制备[12-14]。此法主要用于急性期病理生理改变和治疗效果的研究,而急性期后动物的功能缺陷是否长期存在、闭塞大脑中动脉(m iddle cerebral artery,MCA)哪个节段或分支最理想尚需深入研究。
1 材料和方法
1.1 实验动物 健康清洁级成年雄性恒河猴10只,平均年龄(9.3±0.4)岁,体质量(9.5±0.3)kg,由中国人民解放军军事医学科学院实验动物中心提供,经北京市园林绿化局野生动物保护站批准使用。所有动物体格健康,术前1个月引入,头颅MRI检查无异常。
1.2 模型的制备 所有动物术前禁食24 h,肌注氯氨酮15mg/kg诱导麻醉,氯氨酮100mg、地西泮10mg加入生理盐水中缓慢静点维持动物处于稳定的麻醉状态,硫酸阿托品0.2mg肌注减少唾液分泌,肝素钠500 U加入生理盐水500m l静点使全身肝素化,尼莫地平10mg/h持续静脉泵入预防术中脑血管痉挛。监测心率、呼吸、血压及血氧饱和度。
动物仰卧于手术台上,以Seldinger法[14]穿刺右侧股动脉,经股动脉置入4F动脉鞘及指引导管(Cordis Neurovascular公司),将指引导管送至利手对侧颈内动脉颈2水平,造影(TOSHIBA数字减影血管造影X线机,KXD-1250A;日本东芝公司)获得路径图,导管与导丝在路径图下互相配合,超选至MCAM 1段,二维或三维血管造影获得工作角度,通过造影证实供血范围,释放弹簧圈(Cordis Neurovascular公司);或导丝继续超选至M 1段末端上干入口处,或下干入口处,通过造影证实供血范围后,选择1 cm手术缝线,在导丝导引下缓慢释放线段,使其进入上干或者下干,重复释放4~5条。造影确认栓塞血管供血区不显影,撤管至颈内动脉再次造影,除栓塞的血管外其余动脉显影良好(图1)。撤管,压迫止血后加压包扎。

图1 MCA上干栓塞前后数字减影血管造影影像
1.3 术后护理 监护室保持安静,室温保持在25℃~30℃。术后5 d密切观察意识、精神状态、瞳孔、生命体征、出血量,每12小时行头颅MRI扫描以观察病灶进展及脑水肿情况。根据脑水肿情况,每次给予甘露醇0.5 g/kg缓慢静注。静滴青霉素以预防感染。禁食,经静脉补液提供能量。5 d后予流食及软食,逐步过渡到固体饲料。之后动物的活动逐渐增多,送回大笼饲养。
1.4 神经功能评定 采用标准神经量表[15]评价,内容包括运动功能、行为警觉水平和颅神经缺陷,总分100分。评定由2名观察者独立完成,每次评定于30 m in内完成。分别于术后1 h、3 h、6 h、12 h、24 h、2 d、3 d、5 d、7 d、14 d、1个月、2个月、3个月、4个月进行。从术后第3周起进入自然恢复期,每天至少观察动物患侧肢体的自然使用情况30m in,每周进行小槽食丸取回任务评价1次,至少观察到20周。
1.5 MRI 术前,术后1 d、3 d、7 d、14 d、4周、20周分别行头颅MRI扫描。1.5 T,层厚5mm。
1.6 运动功能测试 应用小槽食丸取回任务进行前肢运动功能评价并确定利手[16]。自制食槽:根据恒河猴手指直径在矩形的树脂玻璃板凿刻5个盛放食物丸的小槽,1号~5号小槽的直径依次是14 mm、16 mm、18 mm、24 mm、30 mm,深度依次是12 mm、13 mm、14mm、16mm、18mm,两槽间隔1 cm;猴笼与食槽间放置带矩形孔的有机透明玻璃板,玻璃板分3种,孔分别位于中间及两侧,孔的大小足以使猴伸出一侧前肢;食槽放置在笼外正对孔的位置。动物一侧上肢必须通过孔才能从笼外的小槽中取回食物。通过使用一侧带孔的玻璃板可单独评价该侧手的灵活性,通过使用中间带孔的玻璃板可确定利手。食物丸为圆形颗粒,直径6mm,质量约30mg,由中国人民解放军军事医学科学院实验动物中心提供,随机发放(10次/槽),测试参数包括从小槽取回食物丸所需的平均时间、取回食物丸的成功率。
1.7统计学分析 使用SPSS 13.0软件进行统计学分析,数据用(±s)表示,两组间比较采用t检验,显著性水平α=0.05。
2 结果
2.1 一般情况 依据栓塞节段不同分为3组:上干栓塞组(n=5)、M 1段栓塞组(n=3)和下干栓塞组(n=2)。M 1段栓塞组3只动物均于术后38~62 h死亡,通过影像和解剖分析,死因为脑水肿、脑疝。上干栓塞组的5只动物和下干栓塞组的2只动物均存活。
2.2 影像学改变 MRI扫描证实脑缺血灶存在。术后24 h,上干栓塞组动物MRI显示一侧额顶叶皮质包括小部分白质在内的长T1、长T2、高弥散信号病灶;M 1段栓塞组动物MRI显示一侧额颞顶叶包括基底节在内的大面积长T1、长T2、高弥散信号病灶;下干栓塞组动物MRI显示一侧颞叶的长T1、长T2、高弥散信号病灶。随着时间延长,上、下干栓塞组弥散信号逐渐减弱,病灶面积逐渐缩小,20周时,上干栓塞组显示右侧额顶叶皮质较小面积的长T1、长T2信号病灶。(图2)。
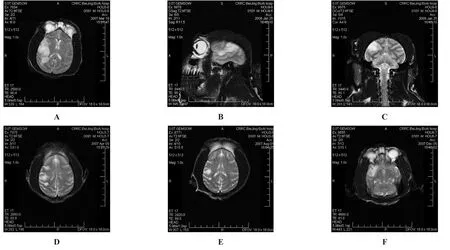
图2 栓塞后MRI影像
2.3 神经功能变化 上干栓塞组:术后1~3 h处于昏睡或嗜睡状态,捏足指后能引起退缩反应;3~6 h,意识较前清醒,能注视检查者,坐位保持困难,需要倚靠,患侧上肢松弛、瘫痪;6~24 h,逃避反应较前灵敏,坐位保持较前好转,精神状态较差,活动少;1~2 d,警觉性增强,主动攻击增多,动作较迅速,可坐位转圈,但不能爬行;2~3 d,患侧上臂能摆动,肘能屈伸,但手仍完全瘫痪,爬行易向患侧跌倒;3~5 d,能四肢爬行,患侧上肢活动较前灵活,能抗重力抬起,患手感觉迟钝,手掌可屈曲但手指不能屈曲;用患手取食时,上臂可伸出,但是手笨拙不能抓握,感觉不灵敏,食物会跌落;5~7 d,四肢爬行基本正常,体力逐渐恢复,患手出现抓握,能配合健手捧水果,但笨拙,患手单独取食失败;7~14 d,大部分动作(如爬、攀援等)基本恢复,但患手对指不能,抓握球形物体困难,感觉仍迟钝,用患侧手拿食物时掉落,其中1只在14 d内患侧手可独自熟练地取食,运动功能恢复正常。其余4只动物运动缺陷持续存在。
M 1段栓塞组:动物在术后前24 h内表现同上干栓塞组,但24 h后精神状态及对外界刺激反应越来越差,于38~62 h死亡。
下干栓塞组:动物术后恢复良好迅速,术后7 d所有功能都恢复正常,患侧肢体同前一样是利手。
急性期神经功能评分:M 1段栓塞组术后神经功能评分迅速降低,动物于3 d内死亡;上干栓塞组脑栓塞后评分逐渐增高,14 d左右神经功能达到稳定状态;下干栓塞组栓塞后评分迅速增高,7 d神经功能完全恢复。见表1。

表1 动物栓塞前后神经功能评分变化
2.4 恢复期和慢性期运动功能的评价 4个月后,如果动物患侧的运动功能连续2周不显示进步,则说明进入慢性期(平台期)[17]。
栓塞前,动物的利手均能从小槽中迅速成功地取食。术后第14天,上干栓塞组中4只动物患手对指不能,感觉迟钝,动作笨拙等功能缺陷持续存在,一直到20周动物都不能使用患侧手完成小槽食丸取回任务,取食完全依靠健手,利手发生转换。下干栓塞组所有动物和上干栓塞组1只动物从第14天起均可熟练地使用患手取食,取食速度及成功率与术前无显著性差异(P>0.05)。
3 讨论
非人灵长类局限性脑缺血模型制备研究已经有40年的历史,制备方法包括经眶手术法[18-21]、开颅手术法[10-11,22]、自体血凝块栓塞法[23-26]、内皮素-1诱导法[27]和线栓法[28]。但由于动物个体间变异大,模型一致性和可重复性差;而且这些模型都主要用来研究急性期神经保护剂的效果以及再灌注引起的神经功能改变,多以栓塞后10 d内[8,29]甚至24 h[30]为研究终点。
血管内介入法由于微创,成为近几年兴起的制备非人灵长类脑卒中模型方法。选择闭塞MCA是因为这个区域的脑卒中比较常见,而且,动物的上肢运动感觉功能代表区就在该动脉供血区域。实验中,M 1段栓塞组术后产生大面积脑梗死,范围与手术切断M 1的模型一致[11],也与人类MCA完全闭塞的影像学表现一致。动物因广泛脑水肿和脑疝于术后38~62 h死亡。下干栓塞组术后初期都有运动感觉缺失,但恢复迅速,7 d后无运动障碍存在,与其他文献报道一致[14],这可能因为感觉运动功能代表区不在下干供血区域,早期功能障碍可能与脑水肿有关。上干栓塞组动物均存活,经过量表评定及运动任务测试,4/5的动物患侧上肢长期存在运动感觉障碍,1/5急性期后没有运动缺陷,这可能因为动物个体间的侧支循环、颅内血管的分布存在较大变异。这种变异在急性期模型研究中也被发现[31]。
上干栓塞组梗死灶都位于外侧裂周围的额顶叶皮质和部分白质,早期病灶的体积有一定差异,与侧支循环建立的丰富程度有关,这也是急性期模型一致性差的主要原因[31]。但慢性期的病灶体积缩小,大小、位置非常相近,且大多数动物慢性期都存在运动功能缺陷,这种运动缺陷的表现和程度一致,即手的动作笨拙、抓握不灵活、不能完成对指动作、感觉迟钝以及喜欢用健侧上肢代替患侧上肢完成任务。这显示慢性期模型从影像和临床表现两方面来看一致性都非常高,可用于评价慢性期各种治疗措施的效果以及用于神经可塑性研究。
由于购买和维持费用高,而且卒中样脑损害在急性期死亡风险高,因此非人灵长类卒中慢性期的模型非常珍贵。动物能否安全度过急性期是关键。实验复制了人类重症监护室密切监测和治疗动物,通过精心手术和术后的严密监护,使MCA上干栓塞模型制备成功率高,没有意外事件发生。
实验证实,MCA上干闭塞制作的卒中模型,动物存活率高,急性期有明显瘫痪,慢性期长期存在上肢功能障碍,模型重复性和一致性好,适合应用于卒中慢性期各种治疗措施效果及病理机制的研究。同时,实验也发现MCA的M 1段栓塞模型,由于梗死面积较大,急性期脑肿胀明显,动物死亡率很高;MCA下干栓塞模型在术后7 d自然且完全恢复运动功能。这两种模型不能应用于慢性期研究。
致谢
衷心感谢北京天坛医院姜卫剑、杜彬、高峰在动物模型制备方面给予的指导与帮助;感谢北京博爱医院影像科王明礼,神经康复中心公维军、孙新亭、胡雪艳在项目中给予的协助。
[1]WHO.World Health Report 2003[M].Geneva:World Health Organization,2003.
[2]Bliss TM,Andres RH,Steinberg GK.Optim izing the success of cell transplantation therapy for stroke[J].Neurobiol Dis, 2010,37(2):275-283.
[3]A lonso-A lonso M,Fregni F,Pascual-Leone A.Brain stimulation in poststroke rehabilitation[J].Cerebrovasc Dis,2007,24 (Suppl1):157-166.
[4]Tarkka IM,Kononen M,Pitkanen K,et al.A lterations in cortical excitability in chronic stroke after constraint-inducedmovement therapy[J].Neurol Res,2008,30(5):504-510.
[5]Hossmann KA.Experimentalmodels for the investigation ofbrain ischem ia[J].Cardiovasc Res,1998,39(1):106-120.
[6]Jones TA,Chu CJ,Grande LA,et al.Motor skills training enhances lesion-induced structural plasticity in the motor cortex of adult rats[J].JNeurosci,1999,19(22):10153-10163.
[7]Zhang K,Sejnow ski TJ.A universal scaling law between gray matter and whitematter of cerebral cortex[J].Proc Natl Acad SciUSA,2000,97(10):5621-5626.
[8]Ducruet AF,Mocco J,M ack W J,et al.Pre-clinical evaluation of an sLex-glycosylated complement inhibitory protein in a non-human primatemodel of reperfused stroke[J].JM ed Primatol,2007,36(6):375-380.
[9]Barbay S,Zoubina EV,Dancause N,et al.A single injection of D-amphetam ine facilitates improvements in motor training follow ing a focal cortical infarct in squirrelmonkeys[J].Neurorehabil Neural Repair,2006,20(4):455-458.
[10]Marshall JWB,Ridley RM.Assessment of functional impairment follow ing permanentm iddle cerebral artery occlusion in a non-human primate species[J].Neurodegeneration,1996,5 (3):275-286.
[11]Marshall JWB,Cross AJ,Jackson DM,et al.Clomethiazole protects against hem ineglect in a primate model of stroke[J]. Brain Res Bull,2000,52(1):21-29.
[12]Hamberg LM,Hunter GJ,Maynard KI,et al.Functional CT perfusion imaging in predicting the extent of cerebral infarction from a 3-hour m iddle cerebral arterial occlusion in a primate stroke model[J].Am J Neuroradiol,2002,23(6): 1013-1021.
[13]de Crespigny AJ,D'A rceuil HE,Maynard KI,et al.Acute studies of a new primatemodelof reversiblem iddle cerebralartery occlusion[J].J Stroke Cerebrovasc Dis,2005,14(2): 80-87.
[14]Yang J,Guo J,Zheng HB,et al.Establishment of a rhesus monkey model ofm iddle cerebral artery ischem ia and reperfusion using am icrocatheter embolizationmethod[J].Neural Regen Res,2010,5(15):1161-1165.
[15]Spetzler RF,Selman WR,Weinstein P,et al.Chronic reversible cerebral ischem ia:evaluation of a new baboon model[J]. Neurosurgery,1980,7(3):257-261.
[16]Xerri C,Merzenich MM,Jenkins W,et al.Representational plasticity in cortical area 3b paralleling tactual-motor skill acquisition in adult monkeys[J].Cerebral Cortex,1999,9(3): 264-276.
[17]Symon LD,Dorsch NWC,Crockard HA.The production and clinical features of a chronic strokemodel in experimental primates[J].Stroke,1975,6(5):476-481.
[18]HudginsWR,Garcia JH.Transorbital approach to them iddle cerebral artery of the squirrelmonkey:a technique for experimental cerebral infarction applicable to ultrastructural studies[J].Stroke,1970,1(2):107-111.
[19]Crow ell RM,M arcoux FW,DeGirolam i U.Variability and reversibility of focal cerebral ischem ia in monkeys[J].Neurology,1981,31(10):1295-1302.
[20]Huang J,Mocco J,Choudhri TF,etal.A modified transorbital baboon model of reperfused stroke editorial comment[J]. Stroke,2000,31(12):3054-3063.
[21]A lexanderW,Kiarash JG,K ristian PD,et al.A new model of cortical stroke in the rhesusmacaque[J].JCereb Blood Flow Metab,2009,29(6):1175-1186.
[22]Ben R,Naimath K,Eray T,et al.Chronic ischem ic stroke model in cynomolgusmonkeys:behavioral,neuroimaging and anatom ical study[J].Neurol Res,2003,25(1):68-78.
[23]Kito G,Nishimura A,Susumu T,etal.Experimental thromboembolic stroke in cynomolgus monkey[J].J Neurosci Methods,2001,105(1):45-53.
[24]Ringer AJ,Guterman LR,Hopkins LN.Site-specific thromboembolism:A novel animalmodel for stroke[J].Am JNeuroradiol,2004,25(2):329-332.
[25]Susumu T,Yoshikawa T,Akiyoshi Y,et al.Effects of intra-arterial urokinase on a non-human primate thromboembolic strokemodel[J].JPharmacol Sci,2006,100(4):278-284.
[26]Qureshi AI,Suri MFK,Zulfiqar A li,et al.Intraarterial reteplase and intravenous abciximab for treatment of acute ischem ic stroke:a prelim inary feasibility and safety study in a non-human primate model[J].Neuroradiology,2005,47(11): 845-854.
[27]Virley D,Hadingham SJ,Roberts JC,et al.A new primate model of focal stroke:endothelin-1-inducedm iddle cerebral artery occlusion and reperfusion in the common marmoset[J].J Cereb Blood Flow Metab,2004,24(1):24-41.
[28]Freret T,Bouet V,Toutain J,et al.Intralum inal thread model of focal stroke in the non-human primate[J].JCereb Blood Flow Metab,2008,28(4):786-796.
[29]Umemura K,Tsukada H,Kakiuchi T,et al.PET study of the neuroprotective effect of TRA-418,an antiplatelet agent,in a monkey model of stroke[J].J Nucl Med,2005,46(11): 1931-1936.
[30]FuruichiY,Maeda M,MoriguchiA,etal.Tacrolimus,a potential neuroprotective agent,ameliorates ischem ic brain damage and neurologic deficits after focal cerebral ischem ia in nonhuman primates[J].J Cereb Blood Flow Metab,2003,23(10): 1183-1194.
[31]Young AR,Touzani O,Derlon JM,et al.Early reperfusion in the anesthetized baboon reduces brain damage follow ing m iddle cerebral artery occlusion:a quantitativeanalysis of infarction volume[J].Stroke,1997,28(3):632-638.
Nonhum an Prim ate Chronic Stroke M odel with M idd le Cerebral A rtery Endovascu lar Em bolism
WANG Qiang,ZHANG Tong, ZHAO Chun-yu,etal.Neurological Rehabilitation Centre,CapitalMedical University School ofRehabilitation Medicine,Beijing Bo'aiHospital,China Rehabilitation Research Centre,Beijing 100068,China
Ob jectiveTo establish chronic cerebral infarction animalmodel in nonhuman primate.M ethods10 adultmale rhesusmonkeyswere embolized them iddle cerebral artery(MCA)in contra-lateral of handedness,and divided into M 1 segment embolism group(n= 3),upper trunk embolism group(n=5),and lower trunk embolism group(n=2).Acute neurological deficitwasevaluated with standard neurological scale,and themotor function in chronic stage was assessed with a task of retrieving food pill in wells.Resu ltsAnimals in M 1 segmentembolism group all died 38~62 h after surgery.Upper trunk embolism group survived,and MRIshowed front parietal cortex infarction contra-lateral paralyzed side.A ll of them paralyzed one side in acute stage,and 4 of them persisted dysfunction in chronic stage,that could not finish the task of retrieving food pill in wells;only one completed the task.The lower trunk embolism group paralyzed one side in acute stage,but recovered quickly and completely,that finished the task within 7 d.ConclusionEmbolism of MCA upper trunk can cause infarction of precise and proper size with one side limb dysfunction in the acute stage and long-term dysfunction inmostanimals,which is feasible for treatmentand neural plasticity research in recovery.
cerebral infarction;chronic stage;nonhuman primate;animalmodel;endovascular embolism
R743.3
A
1006-9771(2012)05-0401-05
2011-08-01
2011-11-10)
“十一五”国家科技支撑计划重大项目(No.2006BAI01A 14)。
1.首都医科大学康复医学院,北京市100068;2.中国康复研究中心北京博爱医院,a.神经康复中心;b.影像科;c.基础所,北京市100068。作者简介:王强(1975-),男,河南淇县人,博士,主治医师,主要研究方向:神经疾病康复。通讯作者:张通。
10.3969/j.issn.1006-9771.2012.05.001
