离子束注入改造壬二酸生产菌株的初步研究
2012-05-07孙弘宇
于 平,孙弘宇
(中国石油大庆炼化公司,黑龙江 大庆 163411)
壬二酸分子式为C9H11O4,又称杜鹃花酸,是一种直链饱和二元酸,主要用于制备增塑剂、润滑剂及特殊塑料和化学纤维等。目前国内外壬二酸的制备方法主要有不饱和脂肪酸的氧化裂解、醇醛等有机物的氧化反应以及生物法等。
利用微生物(如热带假丝酵母)发酵氧化制备壬二酸,原料来源充足(石油炼制的副产物正构烷烃)、生产条件温和(常温、常压)、工艺简单、成本低、污染少、产品纯度高。在热带假丝酵母转化烷烃生成长链二元酸的代谢过程中,烷烃被吸收进细胞后首先经α-氧化生成α-一元酸,接着经ω-氧化生成目标产物α、ω-二元酸。此外,α、ω-氧化过程中生成的一元醇和一元酸都可以被肉毒酰转移酶(CoT酶)转移进入微体中经过β-氧化而代谢消耗掉。要使生物体内积累壬二酸,必须抑制β-氧化,加强菌体的α、ω-氧化。催化菌体的α、ω-氧化的酶均是由细胞色素P450酶和羟基化酶组成的复合酶,其中细胞色素P450酶可以经诱导产生。因而高产壬二酸菌株必须满足两个条件:(1)菌株的α、ω-氧化能力强,在碳水化合物中生长良好、产酸高;(2)菌株的β-氧化能力相对较弱,难以利用烷烃或同化烷烃生长,对壬二酸的降解能力差[1~4]。
近年来,壬二酸生产菌株的选育主要通过物理化学诱变方法来进行,随着基因工程技术的发展,新兴的离子束生物技术也被应用于长链二元酸生产菌株的改造[5~10]。作者在此采用低能离子束注入的方法对壬二酸生产菌种改造进行了初步的研究。
1 实验
1.1 菌种
热带假丝酵母(Candidatropicalis)TSW-1。
1.2 主要培养基
麦芽汁斜面培养基:12 Brix麦芽汁,琼脂2%。
种子培养基:KH2PO40.8 g,玉米浆0.3 g,酵母膏0.3 g,n-C95 mL,蒸馏水100 mL,pH值5.0。
筛选培养基:
SEL-1培养基:NaH2PO40.2 g,K2HPO40.4 g,NaCl 0.1 g,(NH4)2SO45 g,n-C920 mL,2%琼脂,蒸馏水100 mL,pH值7.0。
SEL-2培养基:NaH2PO40.2 g,K2HPO40.4 g,NaCl 0.1 g,(NH4)2SO45 g,葡萄糖3 g,2%琼脂,蒸馏水100 mL,pH值7.0。
SEL-3培养基:蔗糖3 g,NaH2PO40.2 g,K2HPO40.4 g,酵母膏0.1 g,玉米浆1 g,尿素0.14 g,n-C920 mL,pH值9.0,1%~3%的酚红指示剂。
发酵培养基:KH2PO40.8 g,NaCl 0.1 g,玉米浆1 g,酵母膏0.2 g,n-C915 mL,蒸馏水100 mL,pH值5.0。
以上培养基均在 121 ℃下灭菌20 min。
1.3 诱变育种及筛选方法
1.3.1 诱变方法
1.3.1.1 样品制备
将出发菌株接种于麦芽汁斜面培养基上,30 ℃活化48 h,用5 mL无菌水洗涤菌苔,制成菌悬液。取0.5 mL菌悬液接入装有50 mL液体种子培养基的500 mL三角瓶中,于30 ℃、110 r·min-1振荡培养至对数生长后期。取10 mL培养液于无菌离心管中,3000 r·min-1离心10 min,收集菌体,无菌水洗涤3次,将菌体悬浮于10 mL无菌水中,经适当稀释(104)后取5 μL,均匀涂布于2 cm×2 cm的无菌玻片上(以在显微镜下观察不相重叠为宜),无菌风吹干待用。
1.3.1.2 存活率测定
将含菌玻片放入离子束注入仪,抽真空至1×10-4Pa,选择注入能量和剂量,采用脉冲注入,每个脉冲注入55 s,以消除大剂量下热效应产生的副作用。离子束注入后取出玻片,置于装有20 mL蒸馏水的无菌摇瓶中110 r·min-1洗脱菌株,分别取不同种类、能量、剂量的处理液各1 mL适当稀释,进行活菌计数。以注入量为0时的活菌数为基准,计算不同种类、能量、剂量注入下该菌株的存活率,以注入剂量为横坐标、存活率为纵坐标绘制存活率曲线。
1.3.1.3 诱变
按照与存活率测定相同的方法,选择不同种类、剂量、能量进行离子束注入,注入结束后,取出玻片,置于装有50 mL液体种子培养基的500 mL三角瓶中,于28 ℃、110 r·min-1振荡洗脱菌体。
1.3.2 壬二酸突变株的筛选
将洗脱下的菌体经适当稀释后在麦芽汁平板上均匀涂布,28 ℃培养3 d,用无菌牙签挑取单菌落分别一一对应接种于SEL-1培养基和SEL-2培养基上,再培养3 d,选择在SEL-1培养基上不生长、在SEL-2培养基上生长旺盛的菌株,接种于SEL-3培养基中,测定不同菌株在SEL-3培养基上的R*值(菌落产酸面积/菌落面积),选择R*值大的菌株进一步进行摇瓶发酵,测定壬二酸的产率,选择产率最高者作为生产菌株。
1.4 分析方法
菌体浓度用721型分光光度计在620 nm波长、1 cm光程的比色皿中测定。
壬二酸的检测采用酸碱滴定法。
2 结果与讨论
2.1 离子束注入选育壬二酸生产菌株
研究发现,出发菌株TSW-1产酸能力较弱,且发酵周期长。
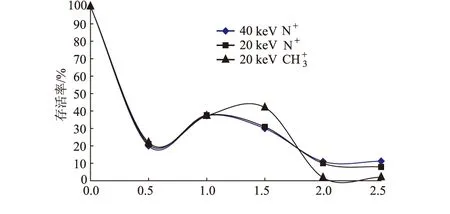
采用不同种类、不同能量的离子在不同剂量下注入TSW-1进行诱变,注入后菌株的存活率曲线如图1所示。
注入剂量/×1017ions·cm-2
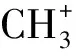
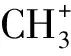
2.2 壬二酸突变菌株的筛选(表1)
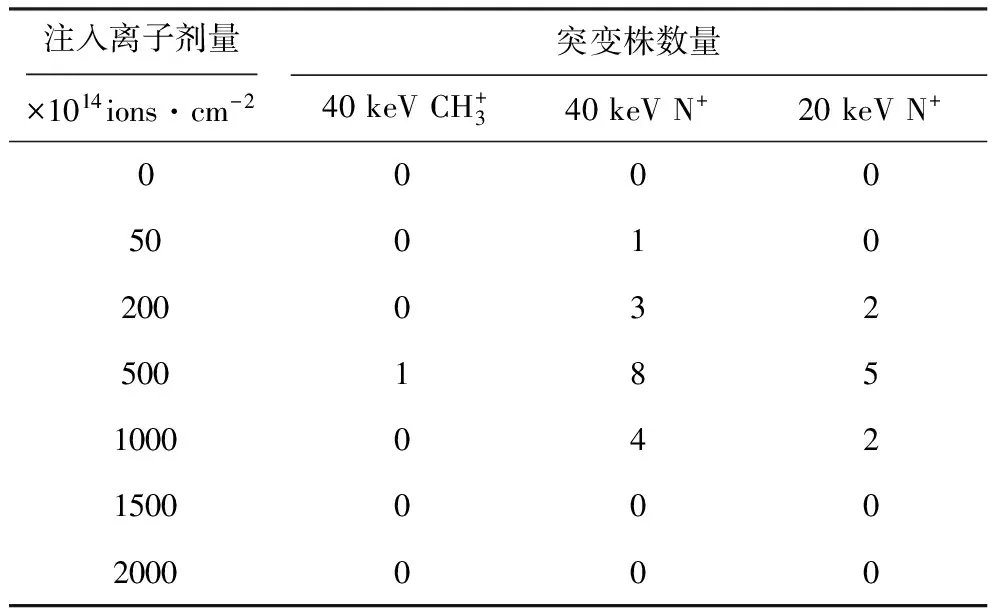
表1 离子束注入后突变株的筛选
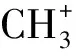
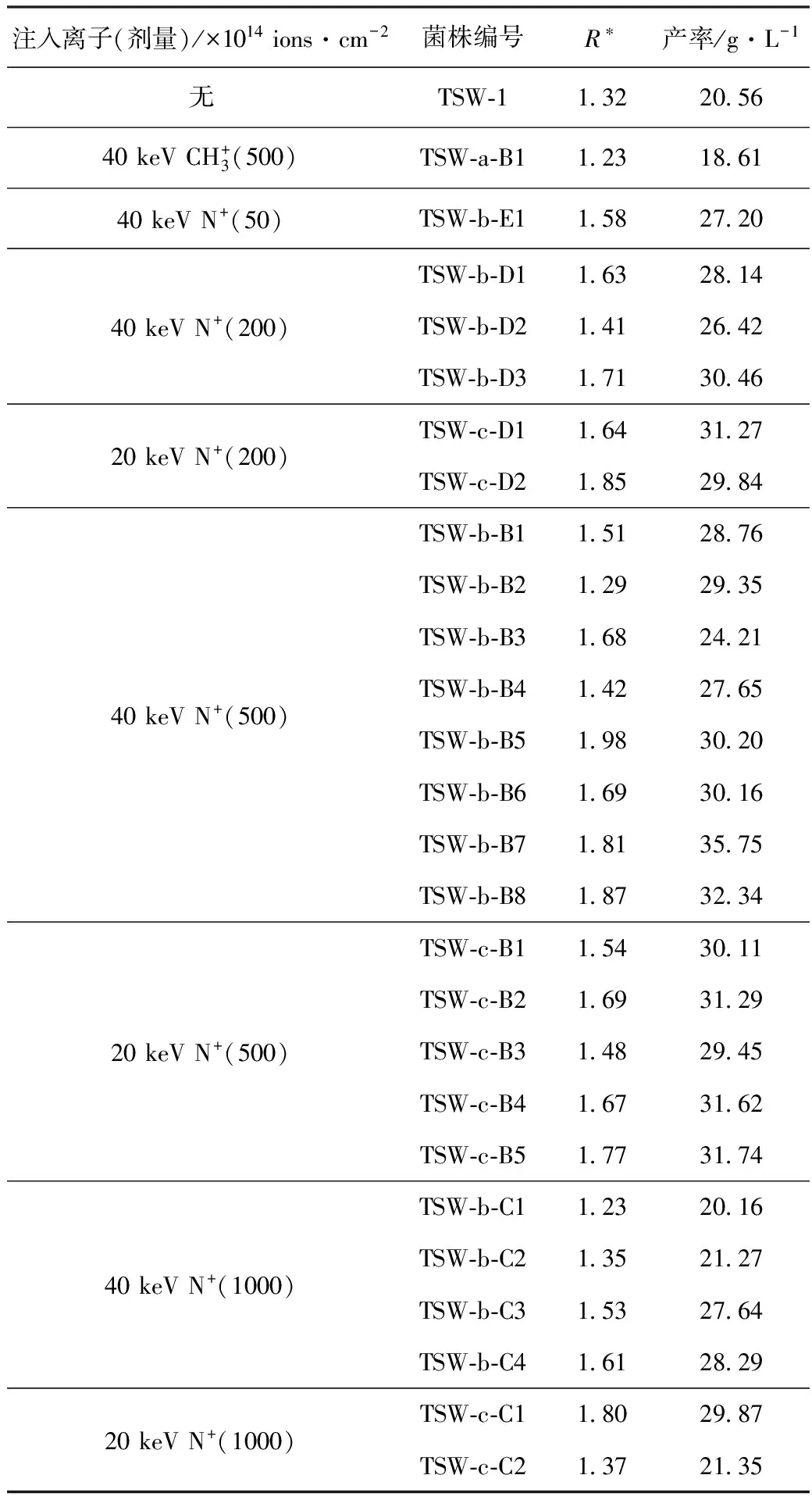
表2 烷烃利用减弱型或缺陷型菌株产酸能力
从表2可以看出,经离子束注入后,许多突变株的壬二酸产率有了大幅的提高,尤其是TSW-b-B7、TSW-b-B8壬二酸产率分别高达35.75 g·L-1、32.34 g·L-1。对其进行积累壬二酸的稳定性实验,结果如表3所示。
从表3可以看出,TSW-b-B7和TSW-b-B8菌株遗传7代后,其壬二酸产率仍比较稳定,在该剂量处选育的突变株其存活率正处于马鞍型曲线的谷底,这与紫外线、X-射线和乙烯亚胺等多种诱变得到的正向突变较多出现在偏低剂量中一致,但要证明这一点尚需进一步研究。TSW-b-B7的壬二酸产率较高且较稳定,最高达35.81 g·L-1,较出发菌株提高了74.17%,为最佳壬二酸突变菌株,将其编号为TSW-35,并对其菌落特性进行研究。
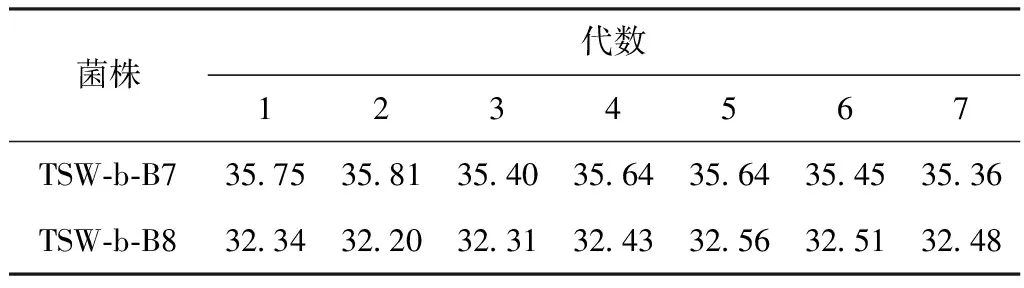
表3 积累壬二酸稳定性实验/g·L-1
2.3 离子束注入对菌落形态的影响
将出发菌株TSW-1和TSW-35涂平板培养3 d后进行观察,结果如4所示。

表4 离子束注入对菌落外观形态的影响
从表4可以看出,离子束注入对菌落外观有明显的诱变影响。因此,可以通过观察菌落形态对菌株产酸能力进行初步判断。
3 结论
采用离子束注入法对壬二酸生产菌株进行改造,通过对照培养基和指示剂培养基筛选α、ω-氧化能力增强以及β-氧化能力减弱的突变株,得到一株壬二酸产率达到35.81 g·L-1的菌株TSW-35,壬二酸产率比出发菌株提高了74.17%。
离子束注入作为新兴的诱变手段,能够在其它诱变方法无能为力的情况下诱发突变产生,其存活率曲线为典型的“马鞍型”,能够在低致死(存活率20%~30%)的情况下诱发大量正突变菌株。
参考文献:
[1]陈远童.新兴的绿色化学工业——微生物发酵生产长链二元酸[J].微生物学通报,2000,27(4):309.
[2]陈远童.生产长链二元酸菌株的诱变筛选[J].微生物学通报,2001,28(2):104.
[3]谷志勇,胡望明.壬二酸的制备及应用[J].精细石油化工,1998(6):40-44.
[4]焦鹏,华玉涛,李书良,等.热带假丝酵母转化烷烃过程中P450酶活的研究[J].微生物学报,2001,41(1):117-120.
[5]宋道军,王纪,姚建铭,等.离子注入对耐烷烃微球菌存活及生物量的影响[J].激光微生物学报,1999,8(1):19-21.
[6]杨垂绪(美),梅曼彤(中).太空放射生物学[M].广州:中山大学出版社,1995:128-157.
[7]陈佳洱.核技术[M].北京:科学出版社,1991:76-125.
[8]宋道军,姚建铭.离子注入对微生物细胞的刻蚀与对DNA的损伤及修复[J].遗传,1999,21(4):37-40.
[9]江泽慧,彭振华.离子生物技术[J].安徽农业大学学报,1994,21(3):295-298.
[10]许安.离子注入生物学研究述评[J].工业微生物,1998,28(4):21-25.
