皮肤鳞状细胞癌中PCNA和PTEN的表达与临床病理特征的关系
2012-04-29方木平叶文正王珊珊吴一文
方木平 叶文正 王珊珊 吴一文

[摘要]目的:探讨PCNA和PTEN在皮肤鳞状细胞癌(SCC)中的表达情况,研究其表达与临床病理特征的关系。方法:采用免疫组化SP法检测52例皮肤鳞状细胞癌组织和10例正常皮肤组织石蜡标本中PCNA和PTEN蛋白的表达。结果:在SCC标本中,PCNA蛋白阳性表达率明显高于正常皮肤组织,PTEN蛋白阳性表达率明显低于正常皮肤组织(P<0.005)。PCNA蛋白的阳性表达与病理分级呈明显正相关(r=0.484),PTEN蛋白阳性表达与病理分级呈明显负相关(r=0.507),差异均有统计学意义(P<0.005);在低分化SCC标本中,PCNA蛋白的阳性表达率高于高中分化组,PTEN蛋白的阳性表达率低于高中分化组(P均<0.001); PCNA与PTEN蛋白的表达存在明显的负相关(r=0.557);两者表达均与年龄和部位无关(P>0.05)。结论:在SCC 组织标本中,PCNA强表达,PTEN低表达或失表达,在SCC的发生、发展及转移过程中发挥重要作用,二者对于判断SCC的进展和预后具有重要的临床意义。
[关键词]癌;鳞状细胞;PCNA;PTEN;免疫组化
[中图分类号]R739.5[文献标识码]A[文章编号]1008-6455(2012)06-0936-03
PCNA是一种细胞增殖相关核抗原,在细胞周期调节过程中起重要作用,在增殖细胞和高度恶性肿瘤中表达增强;PTEN是迄今发现的第一个具有双特异性磷酸酶活性的抑癌基因,主要通过脱磷酸化作用调控细胞内信号传导通路,从而调节细胞的生长、发育及抑制肿瘤增殖、粘附、转移。本研究采用免疫组化SP法检测皮肤鳞状细胞癌组织和正常皮肤组织石蜡标本中PCNA和PTEN蛋白的表达情况,试图探讨其表达与临床病理特征的关系。
1资料和方法
1.1 一般资料:收集本院皮肤科和病理科于2005年1月~2011年12月手术切除的76例疑似鳞状细胞癌组织标本,病历资料完整和病理诊断明确的52例。男23例,女29例;年龄41~80岁,平均65.2±2.1岁,病程3个月~11年(平均1.3±0.4年)。按Broders病理分级法将其分为:Ⅰ级12例,Ⅱ级15例,Ⅲ级14例,Ⅳ级11例。Ⅰ级为高分化鳞癌,Ⅱ级为中分化鳞癌,Ⅲ级~Ⅳ级为低分化鳞癌。另选取10例皮肤外科手术室切除的正常皮肤组织标本作为对照组,男4例,女6例。
1.2 方法
1.2.1 主要试剂:鼠抗人PCNA单克隆抗体(克隆号PC10)与PTEN单克隆抗体(克隆号28H6)和SP免疫组化试剂盒(浓缩型)均购自北京中山生物技术开发有限公司。
1.2.2 实验方法:采用免疫组化SP法,实验步骤严格按照试剂盒说明书进行,用PBS液代替一抗作阴性对照,用已知的阳性切片作阳性对照。
1.2.3结果判定:由2位病理科医师和1位皮肤科病理医师共同评判。标准如下:①PCNA与PTEN根据着色强弱,染色强弱以多数细胞的呈色反应为准:不着色为0分,浅黄色为1分,深黄色为2分,棕黄色为3分;②低倍镜下选取细胞分布均匀的视野,高倍镜视野下用HMIAS高清晰病理彩色图像分析系统进行图像分析,每张切片在×40高倍镜下随机选取5个视野,每个视野计数100个细胞,计数阳性细胞数所占的百分比均值:<25%为1分,25%~50%为2分,>50%为3分。根据上述两项的记分之和将PCNA和PTEN蛋白阳性结果分为4级:阴性(-)为<2分,弱阳性(+)为<3分,阳性(2+)为3~4分,强阳性(3+)为>4分。
1.3 统计学处理:用SPSS13.0软件,计数资料采用卡方检验、Fisher确切概率法,组间比较采用单因素方差分析,用直线相关分析计算相关系数,并判定其相关程度。P<0.05为差异有统计学意义。
2结果
2.1 PCNA蛋白在SCC中的表达: PCNA蛋白主要表达于癌细胞核,少数表达于细胞浆(图1)。在SCC中,PCNA蛋白的阳性表达率显著高于正常皮肤组织,差异均有统计学意义(P<0.005);PCNA在不同病理分级间表达均有统计学差异(P<0.001),且PCNA蛋白表达与病理分级存在相关性(r=0.484)。通过两两比较,研究发现Ⅰ级和Ⅲ级间,Ⅰ级和Ⅳ级间PCAN表达均有统计学差异(P<0.05)。将Ⅰ级和Ⅱ级,Ⅲ级和Ⅳ级分别进行合并,并比较两组间表达差异,发现低分化(Ⅲ+Ⅳ)级组PCAN表达高于高中(Ⅰ+Ⅱ)组(P<0.001);研究结果提示病理分级越高,癌分化越差,PCNA蛋白表达越强。在增生活跃的正常表皮基底层中,仅有少数弱表达PCNA蛋白(1例,占10%)(图2);与患者的年龄与部位无关(P>0.05)(表1)。
2.2 PTEN蛋白在SCC中的表达:PTEN蛋白主要表达于正常细胞(图3),在SCC中的阳性表达率显著高于正常皮肤组织差异有统计学意义(P<0.005),与患者的年龄和部位无关(P>0.05)。PTEN在不同病理分级间表达也有统计学差异(P<0.005),且存在相关性(r=0.507)。通过两两比较,研究发现Ⅰ级和Ⅲ级间,Ⅰ级和Ⅳ级间PTEN表达均有统计学差异(P<0.05),Ⅲ级和Ⅳ级表达均低于Ⅰ级表达。同样将Ⅰ级和Ⅱ级,Ⅲ级和Ⅳ级分别进行合并,低分化(Ⅲ+Ⅳ)级组PTEN表达低于(Ⅰ+Ⅱ)级组(P<0.001),提示病理分级越高,癌分化越差,PTEN的表达越弱。但是有1例Ⅲ级鳞状细胞癌的PTEN蛋白强表达(图4、表1)。
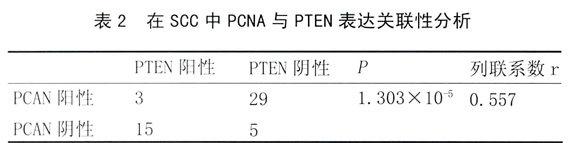
2.3 皮肤鳞状细胞癌中PCNA和PTEN表达的关系:在SCC中,PCAN和PTEN的表达阳性率存在差异性(P<0.05),从统计数据来看,在PCNA 高表达组往往有PTEN低表达,34例PTEN低或失表达组中,PCNA 高表达的有29例(占85.29%),说明两者之间可能存在负相关。通过进一步研究两种表达结果是否存在关联性,计算得到P<0.05,说明两种表达之间存在关联性, Pearson列联系数r=0.557,说明两者间中度关联(表2)。
3讨论
近年来研究表明,恶性肿瘤的发生、发展和浸润与多种癌基因强表达和抑癌基因低表达或失表达密切相关,是一种多基因、多因素相关性疾病。侵袭和转移是恶性肿瘤的重要特性,是影响预后的重要因素,寻找有价值的预测预后及指导临床治疗的生物学指标已成为肿瘤研究的新热点。
PCNA是 DNA复制时所必需的调节蛋白,是与细胞增殖周期有关的周期蛋白,在 DNA 复制及细胞分裂过程中不可或缺。其表达在 G1期开始增高,S期达到高峰,G2期和 M期明显下降[1]。PCNA 的阳性程度可直接反应出 DNA 复制的活跃程度[2-3]。本研究结果显示,在正常组织中,PCNA 的表达较低;高中分化组阳性率与低分化组阳性率之间有显著性差异,与Yamazaki[4]等的研究结果相似。随着SCC的病理分级增高,PCNA 的表达明显增强。提示 PCNA 可促进细胞增殖,并加速肿瘤恶变。本研究结果也显示,在SCC中PCNA与PTEN的表达呈明显负相关,提示二者之间可能以负反馈调节方式参与SCC的发生发展。
PTEN是继p53基因后被发现的一种能识别肿瘤的抑制基因,在细胞的生长、凋亡、黏附、迁移和浸润等方面有重要作用。PTEN蛋白失表达与一些恶性肿瘤的生物学行为和预后密切相关,阳性表达者多分化好、浸润较浅、不伴淋巴结转移和预后良好[5-7]。大量研究证明,PTEN 蛋白在多种肿瘤中表达下调,且表达的水平与肿瘤的恶性程度呈负相关,说明PTEN 与多种恶性肿瘤如:胃癌、宫颈癌、间皮瘤等的发生、发展密切相关[8-9]。本研究结果显示,PTEN 在正常组织中表达率远高于SCC中表达率,提示PTEN表达下调与SCC的发生有关。其中高中分化组与低分化组为之间有显著性差异,随着病理分级的升高,阳性率呈递减趋势,也提示了该基因在诱导肿瘤分化过程中起重要作用。因此PTEN 蛋白的检测不仅有助于了解SCC发生、发展的分子生物学机制,而且对判断患者的预后等可提供参考价值,为临床治疗等提供新的方向。本研究也表明,PCNA与PTEN在SCC中的表达与患者的年龄、发病部位没有关系。
PCNA 的过表达与PTEN 的失表达是SCC侵袭和转移的重要环节。联合检测PCNA和PTEN蛋白可以为临床诊断、确定治疗方案以及预后评估提供重要参考指标,也可为手术或放射治疗SCC提供依据,减轻患者痛苦。有可能也为血管抑制剂、局部注射抑癌因子治疗SCC提供了理论依据。但PCNA 和PTEN的表达在SCC增殖和转化中的相互间的调节与作用机制还有待于更深层次的研究。
[参考文献]
[1]Taftachi R, Ayhan A, Ekici S, et al. Proliferating-cell nuclear anti2gen ( PCNA) as an independent prognostic marker in patients after prostatectomy: a comparison of PCNA and Ki267[J].BJU Int, 2005,95(4):650-654.
[2]任海霞,闫春梅,王卡娜,等.宫颈鳞状细胞癌组织中PTEN、PCNA的表达及意义[J].山东医药,2008.48(43):17-18.
[3]Deniz K,Yuce I,Cagli S, et al. Expression of PCNA and bcl-2 in basaloid squamous cell carcinoma of the larynx: a controlled study[J].Ear Nose Throat J,2008, 87(8):469-473.
[4]Yamazaki K,Kumamoto Y,Tsukamoto T.Expression of squamous cell carcinoma-associated antigen in bladder cancer cells--a comparative study with the expression of proliferating cell nuclear antigen (PCNA) [J].Nihon Hinyokika Gakkai Zasshi,1994,85(4):589-598.
[5]方木平,易海英,刘汉忠. P105,CD105和 PTEN在皮肤鳞状细胞癌中的表达及相关性分析[J].中国皮肤性病学杂志,2011,25(12):934-937.
[6]方木平,易海英,刘汉忠.P105和PTEN在皮肤鳞状细胞癌中的表达及相关性研究[J].中国美容医学,2012.21(1):61-63.
[7]Depowski PL,Rosenthal SI,Ross JS. Loss of expression of the PTENgene protein product is associated with poor outcome in breast cancer[J].Mod Pathol,2001,14(7):672-676.
[8]Kurasawa Y,Shiiba M,Nakamura M,et al.PTEN expression and methylation status in oral squamous cell carcinoma[J].Oncol Rep,2008,19(6):1429-1434.
[9]Storkel S,Reichert T,Reiffen KA,et al. EGFR and PCNA experession in oral squamous cell carcinomas-a valuable tool in estimating the patient''''s prognosis[J].Eur J Cancer Part B:Oral Oncology,1993, 29(4):273-277.
[收稿日期]2012-02-28 [修回日期]2012-04-23
编辑/张惠娟
