一种新的提取脂肪间充质干细胞的方法及对提取细胞的分离、培养及鉴定
2012-04-27张校通胡忠国申重阳赵令卉王小燕陈静娴郑榆坤
张校通,海 泉,胡忠国,申重阳,赵令卉,王小燕,陈静娴,郑榆坤*
(1.成都清科生物科技有限公司干细胞转化医学研究中心,成都 610000;2.重庆卓驰生物科技有限公司,重庆 400700)
近年来干细胞的应用越来越广泛[1]。人们对它的研究也越来越深入。间充质干细胞(Mesenchymal stem cells,简称MSCs)是干细胞家族的重要成员,来源于发育早期的中胚层和外胚层。MSCs最初在骨髓中发现,因其具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点而日益受到人们的关注。如间充质干细胞在体内或体外特定的诱导条件下,可分化为多种组织细胞,连续传代培养和冷冻保存后仍具有多向分化潜能,可作为理想的种子细胞用于衰老和病变引起的组织器官损伤修复。脂肪间充质干细胞( Adipose-derived stem cells, ADSCs) 是一种来源广泛、含量丰富、分离简单的间充质干细胞,属于成体干细胞的一种,被认为是脂肪组织中具有干细胞特性的细胞群,脂肪间充质干细胞是具有多向分化的干细胞[2]。研究证实来自脂肪组织的干细胞在培养后也比其他来源的干细胞生长得均匀[3]。脂肪干细胞在特定刺激因素下可分化为脂肪细胞,且经过长时间的培养,仍可维持此种分化能力[4]。因此,脂肪间充质干细胞被广泛的应用在医学、美容方面。
膨胀液是在1000 ml生理盐水中加入20 ml利多卡因、1 ml肾上腺素和32万单位庆大霉素。盐水中加入利多卡因的作用是起到局部注射麻醉的作用。而加入肾上腺素的作用是使血管扩增和皮肤、黏膜的血管缩小,其与利多卡因一起使用可以起到止血的作用。
目前,脂肪间充质干细胞的分离主要来源于抽取的脂肪组织。相关的论文及已有的专利申请,目前都是从脂肪组织中提取,例如:一种脂肪干细胞的分离培养方法;人脂肪成体干细胞的获取方法及该干细胞库的构建方法;一种脂肪间充质干细胞的分离培养方法及其应用;从脂肪组织中分离间充质干细胞的方法等。局部注射膨胀液是抽脂手术中常用的一种方法,该方法既可保证麻醉效果的确切性,又可使术中出血减少,术后疼痛减轻,在抽脂手术中得到广泛的应用。目前,还尚未有从膨胀液中分离脂肪间充质干细胞的相关报道或专利。通过研究,我们发现从膨胀液中也可以分离出脂肪间充质干细胞,分离间充质干细胞经体外培养扩增以及细胞特性鉴定,结果证实间充质干细胞的生物学特性各项检测指标均符合国际标准,该方法为提取脂肪间充质干细胞提供了一个新的途径。
1 材料与方法
1.1 仪器和试剂
主要仪器及耗材:离心管(Corning);移液管(Corning);细胞滤网(BD);移液枪(BRAND);离心机(湖南湘麓);培养瓶(Corning);细胞培养箱(SANYO);流式细胞仪(BD)。
主要试剂:250ml生理盐水(太极药业,H50021610);利多卡因(上海复星朝晖药业,0.2g*10ml,H31021073);肾上腺素(杭州民生药业,1mg/ml,H33021601);红细胞裂解液(Solarbio,R1010);DMEM (HyClone,SH30243.01B);间充质干细胞培养基(stem cell);抗体(BD)。
1.2 方法
1.2.1 抽取含脂肪间充质干细胞的膨胀液
抽脂前向所要抽取部位灌注过量膨胀液,然后将抽脂过程中获取的脂肪与膨胀液混合液约500 ml置于室温下放置10 min,待脂肪与膨胀液完全分离后,移液枪抽取下层红色液体,即为含有脂肪干细胞的膨胀液。
1.2.2 膨胀液的处理
将收集到的膨胀液放入离心机以1500 rpm离心5 min。离心吸取弃掉离心管上面部分的液体,收集沉淀。每管用3 ml PBS液悬浮,按1:2的体积比加入红细胞裂解液,室温静置5 min,以1200 rpm离心3 min,弃上清液取沉淀备用。
1.2.3 脂肪干细胞的分离
将所得沉淀物用低糖DMEM培养基悬浮,细胞滤器过滤,然后将过滤液体以1200 rpm离心3 min,沉淀即为要获取细胞。再加入DMEM(不含血清)重复以上的操作洗涤3次,去除红细胞裂解液,得到细胞即为目的细胞。
1.2.4 脂肪干细胞的培养
将获取细胞接种至75 cm2细胞培养瓶内,加入10 ml间充质干细胞培养基,37 ℃,5% CO2培养,48 h换液继续培养。
2 两种分离方法得到的干细胞比较
由图1我们可以看到,膨胀液来源的脂肪间充质干细胞,光镜下贴壁生长,呈长梭形,核大,内含1~2个核仁。随细胞数量增加,可呈鱼群状排列,有极性细胞数量非常多时可融合成片。
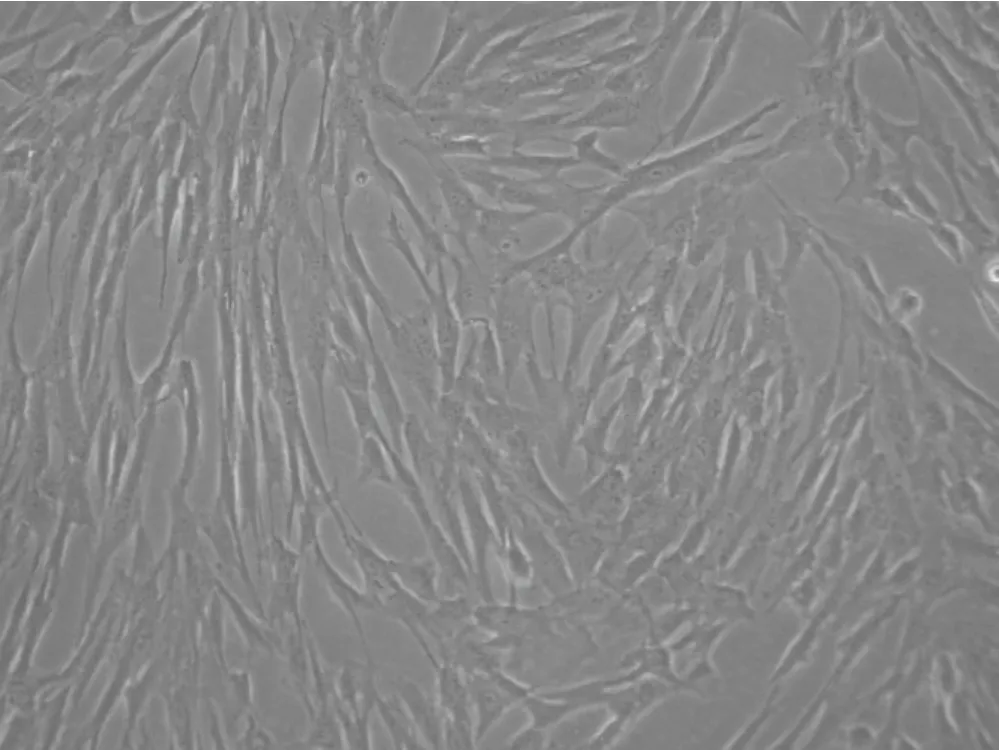
图1 膨胀液来源的脂肪干细胞 (×100)Fig.1 Adipose-derived stem cells isolated from tumescent liquid.(×100)
如表1、图2、图3所示,对从膨胀液及脂肪组织来源的脂肪间充质干细胞进行免疫表型CD73,CD90,CD105和CD45,CD34,CD11b,CD19,HLA-DR检测。结果显示,细胞传至第五代时,检测CD73,CD90,CD105均呈高表达,而CD45,CD34,CD11b,CD19,HLA-DR均呈现低表达。
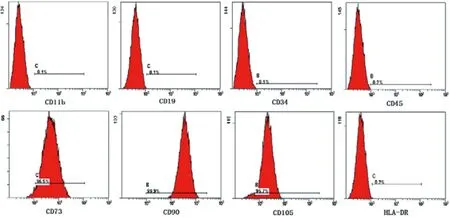
图2 流式细胞术检测膨胀液来源脂肪干细胞干性标记物Fig.2 The expression of Adipose-derived stem cell surface markers detected by flow cytometry.Stem cells were isolated from tumescent liquid.

图3 流式细胞术检测脂肪组织来源脂肪干细胞干性标记物Fig.3 The expression of Adipose-derived stem cell surface markers detected by flow cytometry.Stem cells were isolated from adipose.
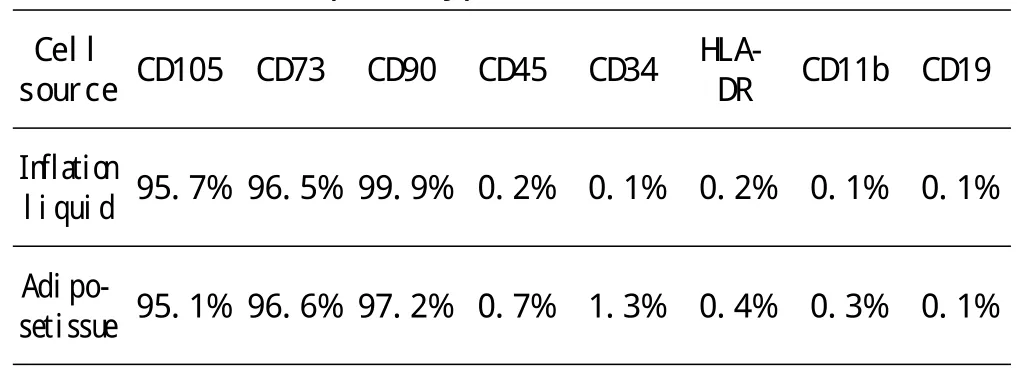
表1 细胞传至第五代时免疫表型检测结果Table 1 The cells to the fifth generation immune to phenotype test results
通过对从膨胀液及脂肪组织来源的脂肪间充质干细胞进行培养,我们发现分离自膨胀液的间充质干细胞数量虽然明显低于与等体积脂肪组织来源干细胞,但细胞生长动力学表明,但其增殖速度较快,生长至第8天时,密度已基本等同于脂肪组织来源干细胞,细胞形态也无。明显差异。按照相同的操作方法分离5人次脂肪抽吸过程中获得的膨胀液,都得到了脂肪干细胞,说明此方法稳定可靠。
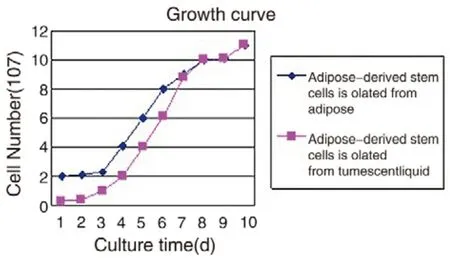
图4 细胞生长曲线比较两种方法分离的脂肪间充质干细胞增殖活性Fig.4 Cells growth curve displayed the comparison of cell proliferation activity between stem cells isolated from tumescent liquid and adipose tissue.
由图5的a、b、c图我们可以看到,对膨胀液来源的脂肪间充质干细胞进行成脂、成骨和成软骨三向分化的诱导以后,我们发现干细胞可以向这三个方向分化。这与国际干细胞协会规定的间充质干细胞定义相符。因此,分离细胞确为脂肪间充质干细胞。
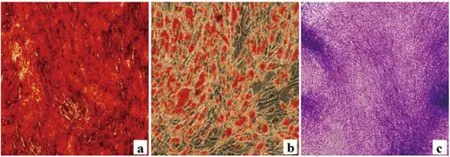
图5 膨胀液中提取脂肪干细胞3向分化(×50)(a) 成骨分化实验结果;(b)成脂分化实验结果;(c) 成软骨分化实验结果Fig.5 Multi-directional differentiation properties of stem cells isolated from tumescent liquid(×50)(a) osteogenic differentiation;(b)adipocytic trans-differentiation; (c)chondrogenic differentiation
3 讨论
间充质干细胞可以分化成神经细胞、肝细胞、软骨细胞、心肌细胞等组织细胞,并具有体外增生与多从分化的能力,能运用于器官与组织的再生与修复。已有研究利用脂肪干细胞和支架成功地修复了鼠、兔、犬骨缺损模型中的缺损[5-7]。目前经研究可以取得间充质干细胞的来源有脂肪、脐带、骨髓、乳牙等。研究指出,从脐带和脂肪中取得的间充质干细胞,作为未来细胞疗法、组织工程、再生医学的材料,其重要性及未来的发展潜力与日俱增。
脂肪组织来源干细胞是位于脂肪基质内的一种细胞。脂肪来源的基质细胞,是继骨髓间充质干细胞后,在成体干细胞中具有重要作用的一类干细胞,具有多向分化潜能。在适宜的条件下,可以定向分化为多种细胞,如脂肪、心肌、平滑肌、骨骼肌、软骨、骨、神经、血管、肝脏、血管内皮细胞等, 因此, 受到越来越多的关注[8-20]。并且脂肪干细胞有望成为脂肪组织工程构建的优良源细胞,并与生物支架材料有效结合[21-22]。随着对其特性及分子机制的深入研究,脂肪间充质干细胞在组织工程和临床医学的研究中将极具潜力[23-24]。常规实验分离脂肪间充质干细胞的方法是从脂肪组织中分离得到。作者经过多年的实验经验,从膨胀液中也分离得到脂肪间充质干细胞。虽然相同体积的膨胀液和相同体积的脂肪组织比较,脂肪组织提取到的脂肪间充质干细胞要多一些。但经过后期的细胞培养以后,细胞的数量逐渐接近。经过细胞免疫表型检测,两种来源的脂肪间充质干细胞的表型变化相同。而且通过实验我们发现细胞可以向成脂、成骨和成软骨三向分化。这与国际干细胞协会规定的间充质干细胞定义相符。因此,分离细胞确为脂肪间充质干细胞。所以本发明为提取脂肪间充质干细胞提取提供了新的来源。为提取脂肪间充质干细胞找到了新的途径。为以后进行此类实验的人员,提供了一个参考。
[1] Phinney DG, Prockop DJ.Concise review: mesenchymal stem multipotent stromal cells: the state of transdifferentiation and modes of tissue repair--current views.Stem Cells.2007;25(11):2896-2902.
[2] Zuk PA, Zhu M, Ashjian P, et al.Human adipose tissue is a source of multipotent Stem cells.Mol Biol Cell, 2002, 13:4279-4295.
[3] Sun XL, Li Q, progress in research and clinical applications of adipose-derived stem cells, J Fouth Mil Med Univ,2009,30( 9) : 860-862.孙晓龙,李青,脂肪干细胞的研究及临床应用进展.第四军医大学学报,2009,30( 9): 860-862.
[4] PU L L, CUI X, FINK B F, et al.The viability of fatty tissues within adipose aspirates after conventional liposuction; a comprehensive study.Ann plast surg, 2005, 54(3): 288-292.
[5] Cui L, Liu B, Liu G, et al.Repair of cranial bone defects with adipose derived stem cells and coral scaffold in a canine model.Biomaterials, 2007, 28(36): 5477-5486.
[6] Cowan CM, Shi YY, Aalami OO, et al.Adipose -derived adult stromal cells heal critical -size mouse calvarial defects.Nat Biotechnol, 2004, 22(5): 560-567.
[7] Dudas JR, Marra KG, Cooper GM, et al.The osteogenic potential of adipose- derived stem cells for the repair of rabbit calvarial defects.Ann Plast Surg, 2006, 56(5): 543-548.
[8] FRASER J K, WULUR I, ALFONSO Z, et al.Fat t issue:an under appreciated source of stem cells for biotechnology.Trends Biotechnol, 2006, 24(4): 150-154.
[9] SONG Y H, GEHMERT S, SADAT S, et al.VEGF is critical for spontaneous differentiation of stem cells into cardiomyocytes.Biochem Biophys Res Commun, 2007, 354(4):999-1003.
[10] BAI X, PINKERNELL K, SONG Y H, et al.Genetically selected stem cells from human adipose tissue express cardiac markers.Biochem Biophys Res Commun, 2007, 353(3): 665-671.
[11] RODRIGUEZ A M, ELABD C, AMRI E Z, et al.The human adipose tissue is a source of multipotent stem cells.Biochimie,2005, 87(1): 125-128.
[12] LIN L, FU X, ZHANG X, et al.Rat adipose- derived stromal cells expressing BMP4 induce ectopic bone format ion in vitro and in vivo.Act a Pharmacol Sin, 2006, 27(12): 1608-1615.
[13] SHEN F H, ZENG Q, LV Q, et al.Ost eogenic differentiation of adiposederived stromal cells treated with GDF- 5 cultured on a novel three- dimensional sintered microsphere matrix.Spine J, 2006, 6(6): 615- 623.
[14] DIMUZIO P, FISCHER L, MCILHENNY S, et al.Development of a tissue - engineered bypass graft seeded with stem cells.Vascular, 2006, 14(6): 338-342.
[15] BURKS CA, BU NDY K, FOT UH I P, et al.Characterization of 75: 25 poly (l-lactide-co-epsilon- caprolact one) thin films for the endoluminal delivery of adipose-derived stem cells to abdominal aortic aneurysms.Tissue Eng, 2006, 12(9): 2591-2600.
[16] WEI Y, HU Y, LV R, et al.Regulation of adipose-derived adult stem cells differentiating into chondrocytes with the use of rhBMP- 2.Cyt otherapy, 2006, 8(6): 570-579.
[17] ES TES BT, WU AW, ST ORMS RW, et al.Ext ended passaging, but not aldehyde dehydrogenase activity, increases the chondrogenic potential of human adipose-derived adult stem cells.J Cell Physiol, 2006, 209(3): 987-995.
[18] LEE W C, RUBIN J P, MARRA K G.Regulation of alpha smooth muscle actin protein expression in adipose-derived stem cells.Cells Tissues Organs, 2006, 3(2): 80- 86.
[19] KOKAI L E, RUBIN J P, MARRA K G.The potential of ad-I pose- derived adult stem cells ascells.Plast Reconstr Surg,2005, 6(5): 1453-1460.
[20] JACK G S, ALM EIDA F G, ZHANG R, et al.Processed lipoaspirate cells f or tissue engineering of the lower urinary tract: implications for the treatment of stress urinary incont inence andbladder reconstruct ion.J Urol, 2005, 74(5): 2041-2045.
[21] AhnHH, Lee JH, Kim KS, et al.Polyethy leneiminemediated genedelivery into human adipose derived stem cells.Biomaterials.2008, 29(15): 2415-2455.
[22] Brayfield C, Marra K, Rubin JP.Adipose stem cells for soft tissue regeneration.Handchir Mikrochir Plast Chir.2010,42(2):124-128.
[23] Mizuno H.Adipose-derived stem cells for tissue repair and regeneration: ten years of research and a literature review.J Nippon Med Sch.2009, 76(2): 56-66.
[24] Lu F, Mizuno H, Uysal AC, et al.Improved viability of random pattern skin flaps through the use of adipose-derived stem cells.Plast Reconstr Surg.2008, 121: 50-58.
