基于MEMS微电极芯片的电穿孔系统*
2012-04-24魏泽文李学明赵德尧梁子才李志宏
闫 浩,魏泽文,李学明,赵德尧,梁子才,李志宏*
(1.北京大学微电子所,微米纳米加工技术国家级重点实验室,北京100871;2.北京大学深圳研究生院,深圳518055;3.北京大学分子医学所,北京100871)
细胞电穿孔(Electroporation)是指细胞在外加脉冲电压的作用下,细胞膜脂双层上形成瞬时微孔的生物物理过程[1]。从1994年第一个商用细胞电穿孔设备发布以来[2],已经陆续报道了近百种细胞电穿孔设备。
然而,目前电穿孔技术和设备都存在一些显著的缺陷[2-5]。传统技术加工的电极间距大,而细胞电穿孔所需的电场较高,这导致现有设备需要非常高的电压才能完成电穿孔。高电压使实验具有一定的危险性,而且增加了实验和设备成本,更为重要的是由于高电压引起水电解对细胞有极大的损伤[6]。因此,电穿孔效率不高。
为了避免高电压电穿孔对细胞的损伤,提高电穿孔效率,我们研制了基于MEMS工艺的微型电极的细胞电穿孔芯片[7]。通过降低电极间距,大大的降低电穿孔所需工作电压。同时独特的环形叉指结构,能最大程度优化细胞在芯片上的覆盖。基于电穿孔电穿孔芯片,我们制作了芯片载具和完整的电穿孔电路系统。
1 设计和加工
完整的电穿孔系统包括:电穿孔芯片、芯片载具和电穿孔电路系统。系统的核心是电穿孔芯片,为了更方便的使用电穿孔芯片进行实验,我们设计了芯片载具并且完成了整套电穿孔电路系统的开发。
1.1 电穿孔芯片
电穿孔芯片是多重圆环嵌套而成的环形叉指结构,相邻两个圆环分别连接不同电极。电穿孔芯片选用金作为电极材料,具有良好的导电性和生物兼容性。
1.2 芯片载具
为了保证每次实验中的细胞悬浮液均有同样体积和细胞密度,为芯片提供可靠的电学连接,我们制作了电穿孔芯片载具。
电穿孔芯片载具如图1所示。它包括用于连接芯片和脉冲发生装置的电学连接件和用来精密控制细胞量的盒盖上方中间凸起的圆柱结构。圆柱结构能对液体表面的进行平整处理,控制细胞量,提高电穿孔效率。小圆柱在盒子关闭的时候和芯片的间距小到几百微米。芯片载具的材质可以为透明材料(图1(c))或者不透明材料。使用透明的材料可以方便的观察到细胞的状态。芯片载具包括轴和卡扣,用于盒子的开关和连接。

图1 (a)电穿孔芯片载具的结构图,其中电穿孔芯片在载具的正中。(b)(c)为电穿孔芯片载具实物图,其中图(c)为透明材料制作
另外,电穿孔芯片载具能够承载并保护芯片。由于生物实验对环境要求较高,做成密封的盒子能够防止细胞污染。
1.3 电穿孔电路系统
基于电穿孔芯片和芯片载具,我们设计了完整的电穿孔电路系统。该系统如图2(a)所示,只需将细胞导入到芯片上,将芯片载具插入电穿孔系统的插槽中,通过键盘输入数据,即可完成电穿孔。
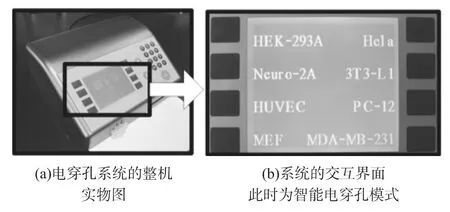
图2 用户只需选择相应的细胞种类即可,细胞库里包含常用细胞,也包括原代细胞和干细胞
交互界面使用的是320 240点阵的LCD液晶屏。用户可以采用多种模式的电穿孔,包括手动电穿孔和智能电穿孔。手动电穿孔可以根据用户需要调整电脉冲参数,优化电穿孔效率。
智能电穿孔时,用户使用系统自带的细胞库,选择相应的细胞,即可对相应细胞进行电穿孔。只需要用户选择相应的细胞种类,系统将自动完成电穿孔参数的设置。大多数现有电穿孔设备由于受到细胞状态,溶液导电率,系统功率等因素的影响,电穿孔的一致性差,难以用相同条件得到相同结果。从而无法使用智能电穿孔模式。我们的电穿孔系统由于精巧的芯片设计,能产生更均一的电场,保证每次都能得到优秀的实验结果。
电穿孔系统的电路部分是基于单片机STC89C58RD+,结合模拟和功率放大电路制作而成。系统结构如图3所示。用户通过键盘和显示模块输入电学参数。利用单片机程序的控制,系统可以读取用户所需电压的幅度和脉冲宽度等数据,并且产生一个信号。该信号经过一级放大,二级放大和功率放大,得到最终的脉冲输出。存储模块用来存储用户添加的数据。蜂鸣器发声配合按键,同时还可以作为过流警报。当系统输出过大电流时,过流保护模块能自动断电,以保护系统安全。

图3 系统电路结构框图
2 实验结果
为了验证电穿孔系统的性能,我们采用HEK-293A细胞进行GFP(绿色荧光蛋白)转染实验。实验时,将分离出来的细胞,加入缓冲液和GFP质粒,滴到电穿孔芯片上,将芯片载具放入所述系统中进行操作。实验条件为:脉冲电压60 V,脉冲宽度0.1 ms,脉冲间隔2 s,脉冲次数为3。成功电穿孔并表达GFP的细胞会发出绿色荧光。实验结果如图4(a)、(b)所示,图4(a)亮场图包含所有的细胞,图4(b)荧光图是表达绿色荧光的细胞,即被电穿孔的细胞。由图可知,HEK-293A的电穿孔效率高于90%,存活率亦高于80%。

图4 HEK-293A细胞的GFP转染实验
除了向易于被转染的细胞中输运质粒DNA以外,细胞转染技术面临的更大挑战是向难以被转染细胞中输运siRNA等大分子。而现有的电穿孔系统都很难完成该种实验。
为了验证所述电穿孔系统的适用范围,我们选择另一种公认的难以转染的细胞3T3-L1(小鼠胚胎成纤维细胞)进行电穿孔实验[8]。3T3-L1在诱导成脂肪细胞的时候会产生一种MALAT1的非编码RNA,我们通过电穿孔导入MALAT1的siRNA对它进行抑制。实验结果如图5所示,在电穿孔后第一天,实验组中MALAT1的表达被抑制了80%。这个结果表明3T3-L1的电穿孔效率高达80%。

图5 3T3-L1的电穿孔实验
3 结论
基于电穿孔的微加工芯片,我们研制了完整的电穿孔系统,它能够提供多种细胞的高效电穿孔。通过良好的人机交互界面,用户可以很方便的进行智能电穿孔和手动电穿孔。由于结合了MEMS微电极芯片,使电穿孔所需的电压大大降低,因而减小了对细胞的损伤。电穿孔的细胞存活率和电穿孔率都高于所见报道的结果。在实验中,HEK-293A的电转效率达到90%,3T3-L1的电穿孔效率高达80%。该电穿孔系统已经在北京大学的几个实验室里试用,并且做过大量的电穿孔实验。系统稳定性好,使用方便。
[1] Neumann E,Schaefer-Ridder M,Y Wang,et al.Gene Transfer into Mouse Lyoma Cells by Electroporation in High Electric Fields[J].The EMBO Journal,1982,1(7):841.
[2] Murakami Yuji,Motohashi Ken,Kazuyoshi Yano,et al.Micromachined Electroporation System for Transgenic Fish[J].Journal of Biotechnology,1994,34(1):35-42.
[3] siPORTerTM-96 Electroporation Chamber(Cat#13500)Instruction Manual.
[4] http://www.lonzabio.com/cell-biology/transfection/
[5] http://zh.invitrogen.com
[6] Kim J A,Cho K,Shin M S,et al.A Novel Electroporation Method Using a Capillary and Wire-Type Electrode[J].Biosensors and Bioelectronics,2008,2(12):1353-1360.
[7] Huang Huang,Zewen Wei,Yuanyu Huang,et al.An Efficient and High-Throughput Electroporation Microchip Applicable for siRNA Delivery[J].Lab on a Chip,2011,11:163-172.
[8] Wei Liao,Audrey Nguyen M T,Takeshi Imamura,et al.Lentiviral shRNA-Mediated Knockdown of GLUT4 in 3T3-L1 Adipocytes[J].Endocrinology,February 23,2006,10.1210/en.2005-1638.
