高糖对小鼠胰岛和胰岛b细胞株INS-1E的长期作用
2012-04-24张艳玲邹本良
张艳玲, 邹本良
高糖对小鼠胰岛和胰岛b细胞株INS-1E的长期作用
张艳玲1*, 邹本良2
(中国中医科学院西苑医院:1教育处,2内分泌科, 北京 100091)
探讨高糖对胰岛b细胞INS-1E和小鼠胰岛的慢性作用。雌性NMRI小鼠, 6~10周龄, 苯巴比妥腹腔注射麻醉, 应用胶原酶技术消化胰腺分离胰岛。传代培养的INS-1E细胞和分离的小鼠胰岛分别于含11.1, 25.0 mmol/L葡萄糖的RPMI1640培养液中培养72 h, 然后于含3.3, 16.7 mmol/L葡萄糖的Krebs-Ringer缓冲液中培养60 min, 留取上清液行胰岛素测定。INS-1E细胞在含不同浓度的葡萄糖的RPMI 1640培养液中培养72 h, 提取其总RNA, 合成相应的cDNA, 再行RT-PCR检测胰十二指肠同源异形盒-1(Pdx1), 胰岛素1(Ins1), 胰岛素2(Ins2)和葡萄糖转运子2(Glut2)的基因表达。高糖培养后INS-1E细胞和小鼠胰岛的基础INS分泌增加[INS-1E细胞:(10.47±0.78)(7.71±0.59)ng/10000细胞,<0.01; 小鼠胰岛:(3.85±0.26)(2.18±0.21)mg/L,<0.001], 糖刺激的INS分泌减少[INS-1E细胞:(17.11±1.98)(30.76±2.20)ng/10000细胞,<0.001; 小鼠胰岛:(14.78±1.03)(20.46±1.49)mg/L,<0.01];高糖处理后INS-1E细胞的Pdx1, Ins1, Ins2和Glut2的mRNA水平下降。高糖对胰岛β细胞具有慢性毒性作用。
葡萄糖; 胰岛素分泌细胞; INS-1E细胞
胰岛b细胞分泌胰岛素(insulin, INS)减少和INS抵抗是2型糖尿病(type 2 diabetes, T2D)的主要发病机制。研究发现, 糖耐量减退的患者和T2D患者的早期即呈现特征性胰岛β细胞功能不全[1]。T2D是一种进行性进展性疾病, 研究发现, 波动性或持续性高血糖可能对胰岛β细胞造成持续性损害, 导致β细胞功能不全进行性加重, 但尚无一致性结论。本研究应用小鼠胰岛和克隆的β细胞株INS-1E细胞, 探讨了过多葡萄糖可能对胰岛β细胞的慢性毒性作用。
1 材料与方法
1.1 材料
葡萄糖、氯化钠、氯化钾、氯化钙、氯化镁、牛血清白蛋白、N-2-羟乙哌嗪-N-2-乙烷磺酸(HEPES)、RPMI 1640均购自Sigma公司; 自行配制Krebs-Ringer缓冲液(主要成分为115 mmol/L氯化钠、4.7 mmol/L氯化钾、1.28 mmol/L氯化钙、5.0 mmol/L碳酸氢钠、25 mmol/L HEPES, pH 7.4), INS-1E细胞由C.B.Wollheim教授(瑞士)馈赠。
1.2 细胞培养
INS-1E细胞的培养液为改良的RPMI1640(含有10%胎牛血清, 11.1 mmol/L葡萄糖, 10 mmol/L HEPES, 100 IU/ml青霉素, 100 mg/L链霉素, 0.5%牛血清白蛋白), 细胞在细颈瓶中贴壁生长, 每周传代1次。
1.3 INS-1E细胞释放胰岛素
应用胰酶消化, 培养液稀释, 离心收集INS-1E细胞, 种植在24孔板中, 每孔1 ml, 2.5×106/孔, 37℃、5%CO2培养1 d, 然后分别于11.1, 25.0 mmol/L葡萄糖的RPMI1640中培养72 h。经不同浓度葡萄糖处理后, INS-1E细胞在Krebs-Ringer缓冲液预培养15 min;而后每孔中加入含3.3或者16.7 mmol/L葡萄糖的Krebs-Ringer缓冲液1 ml培养1 h, 每孔留取200 μl上清液-20℃保存待测。
1.4 INS-1E细胞计数
移出每孔中剩余的培养液, 加入蒸馏水1 ml, 于FLUOstar Galaxy细胞计数仪上进行本底测定, 然后加入20ml SYTO24试剂(SYTO24溶于0.01 mmol/L二甲基亚砜中), 37℃培养箱放置45 min后对细胞核进行染色, 再次于FLUOstar Galaxy细胞计数仪上进行细胞数测定。以细胞数来校正INS水平。
1.5 INS-1E细胞的基因表达
INS-1E细胞分别于含11.1, 25.0 mmol/L葡萄糖的RPMI1640中培养72 h, 应用RNeasy mini试剂盒(Qiagen公司, 德国), 提取INS-1E细胞总RNA。应用iScriptTMcDNA合成试剂盒(Bio-Rad公司, 美国)进行逆转录反应(reverse transcription, RT), 每20ml RT体系中加入1mg总RNA。在ABI 7500快速多聚酶链反应(polymerase chain reaction, PCR)仪上进行RT-PCR反应。相关基因的探针和引物为: 胰十二指肠同源异形盒-1(pancreas-duodenum homeobox-1, Pdx1, Rn00755591_m1), 胰岛素 1(insulin 1, Ins1, Rn02121433_g1), 胰岛素 2(insulin 2, Ins2, Rn01774648_g1), 葡萄糖转运子2(glucose transporter type 2, Glut2, Rn00563565_m1), 均购自美国应用生物系统公司。RT-PCR的反应体系如下:5ml 2×TaqMan Universal Master 混合液, 0.5ml 20×TaqMan 探针, 与50 ng总RNA相当的cDNA水溶液。热循环如下: 95℃ 20 s, 95℃ 40循环(每个循环3 s), 60℃ 30 s。以真核细胞18 s核糖体RNA为管家基因, 应用2-CT的方法计算基因的相对表达[2]。
1.6 小鼠胰岛的分离和培养
雌性NMRI小鼠购自丹麦Bomholtgaard饲养研究中心, 饲以标准颗粒饲料和瓶装自来水。实验时, 苯巴比妥腹腔注射麻醉, 腹腔正中切口, 胰脏管道注入3 ml冰浴的Hanks平衡盐溶液(0.3 mg胶原酶P/ml), 取出胰腺, 37℃水浴箱中温浴19 min后, 用冰浴的Hanks平衡盐溶液洗涤3次, 体视显微镜下挑选胰岛, 迅速转移到含RPMI1640的培养皿中, 37℃培养箱(5%CO2, 95%空气)过夜培养。第二天小鼠胰岛分别转移到含11.1, 25.0 mmol/L葡萄糖的RPMI1640培养液中培养72 h。
1.7 小鼠胰岛释放胰岛素
小鼠胰岛经上述处理后, 在加有0.1%牛血清白蛋白, 3.3 mmol/L葡萄糖的10 ml Krebs-Ringer缓冲液中, 37℃水浴箱预培养15 min。然后单个胰岛分别小心地置入100ml含3.3或16.7 mmol/L葡萄糖的Krebs-Ringer缓冲液中, 37℃培养1 h, 从每孔胰岛中吸取50ml上清夜, -20℃保存待测。
1.9 胰岛素的测定
应用大鼠INS(Novo Nordisk, 丹麦)作为标准, 单125碘标记的人INS(Novo Nordisk A/S, 丹麦)作示踪剂, 应用豚鼠抗猪INS抗体(Novo Nordisk A/S, 丹麦)进行放射免疫测定INS, 应用乙醇分离自由的和结合的放射活性, 批内变异系数5%, 批间变异系数10%。
1.10 统计学处理

2 结 果
2.1 高糖对INS-1E细胞分泌INS的影响
高浓度葡萄糖处理后, INS-1E细胞的基础INS分泌增加, 葡萄糖刺激的INS-1E细胞的INS分泌反应下降(表1)。
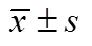
表1 高糖处理后INS-1E细胞分泌INS的变化
注: 与11.1 mmol/L葡萄糖组比较,**<0.01,***<0.001
2.2 高糖对小鼠胰岛分泌INS的影响
高浓度葡萄糖处理后, 小鼠胰岛的基础INS分泌增加, 葡萄糖刺激的小鼠胰岛分泌INS的反应下降(表2)。
2.3 高糖培养后INS-1E细胞基因表达的改变
如图1所示, 高糖处理后, INS-1E细胞Pdx1, Ins1, Ins2, Glut2的mRNA水平较对照组明显下降。
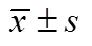
表2 高糖处理后小鼠胰岛分泌INS的变化
注: 与11.1 mmol/L葡萄糖组比较,**<0.01,***<0.001

图1 高浓度葡萄糖培养对INS-1E细胞Pdx1, Ins1, Ins2, Glut2 mRNA水平的影响
Figure 1 Effect of higher glucose concentration on Pdx1, Ins1, Ins2, Glut2 mRNA in INS-1E cells
A: Pdx1; B: Ins1; C: Ins2; D: Glut2。与11.1 mmol/L葡萄糖组比较,*<0.05,**<0.01
3 讨 论
T2D起病和进行性发展的根本原因是胰岛β细胞功能的进行性减退[1], T2D前期和T2D患者的高血糖和高血脂被认为是胰岛β细胞功能减退的重要原因, 但尚未得出一致结论。本研究应用克隆的胰岛β细胞株和分离的小鼠胰岛证实, 慢性高血糖可以引起胰岛β细胞功能减退, 即β细胞的基础INS分泌增加, 葡萄糖刺激的INS分泌减退。本研究显示, 慢性过多葡萄糖通过下调促INS转录的转录因子Pdx1的表达, 减少了INS基因的转录和表达, 进而导致葡萄糖刺激的INS分泌下降。
高糖培养后葡萄糖刺激的INS分泌减退不仅发生在INS-1E细胞, Robertson等[3]最早在高糖的条件下培养克隆的β细胞株HIT-T15, 发现高糖培养数代后, HIT-T15细胞的INS含量和INS mRNA 水平明显下降, 其葡萄糖刺激的INS分泌下降; 而改用低浓度葡萄糖培养后其INS含量和mRNA水平得以部分恢复。而Brock等[4]应用克隆的β细胞株INS-1 细胞, 在高糖环境下培养4 d, 其INS mRNA水平较对照组减少90%, 并且高糖和低糖每天交替培养亦不能阻止mRNA水平的下降, 同时INS-1细胞也显示了葡萄糖刺激的INS分泌的下降。El-Assaad等[5]应用β细胞株INS832/13, 证实单纯高脂培养, 其葡萄糖刺激的INS分泌无变化, 高糖培养后其葡萄糖刺激的INS分泌下降, 而高糖联合高脂培养后其葡萄糖刺激的INS分泌下降更明显。本组研究证实, 高糖培养后小鼠胰岛的葡萄糖刺激的INS分泌减退, 而Khaldi 等[6]发现, 大鼠胰岛在高糖环境下培养1周, 胰岛β细胞的基础INS分泌增加, 葡萄糖刺激的INS分泌下降。Harmon等[7]应用ZDF糖尿病大鼠(Zucker diabetic fatty rat, ZDF)观察慢性高血糖在体内对胰岛β细胞的作用, 发现6周龄尚未成模大鼠的胰岛INS mRNA水平较对照组代偿性增加, 而15~16周龄成模ZDF大鼠胰岛的INS mRNA和Pdx1 mRNA水平较对照组大鼠明显下降, 其胰岛的葡萄糖刺激的INS分泌较对照组大鼠下降。尤其重要的是, 从T2D患者分离的胰岛也具有葡萄糖刺激的INS分泌减退的特征[8]。这些不同来源的β细胞都表现出高糖所致的相同的b细胞功能异常特征。
进一步的研究发现, 慢性高血糖引致多元醇通路、己糖途径、糖基化通路、蛋白激酶C同分异构体的激活等异常增加, 反应性氧簇(reactive oxygen species, ROS)的形成增加, 过多的ROS使Pdx1的表达下降[9], 而且Pdx1蛋白和INS基因启动子的结合能力减退[7,9]。Pdx1是强力刺激INS基因转录的转录因子, 本研究、Robertson等[3]、Brock等[4]和Harmon等[7]的研究均证实, 慢性高糖导致克隆的β细胞和ZDF大鼠胰岛的INS mRNA表达水平下降。而且本研究表明, 慢性高糖使Glut2 mRNA表达下降也是β细胞的葡萄糖刺激的INS分泌减退的一种可能原因, 因为Glut2位于β细胞膜, 促进葡萄糖转运入β细胞, 是葡萄糖刺激INS分泌的必须环节。Lombardi等[10]的研究则证实, 高糖培养后, INS-1E细胞发生内质网应激, 导致Pdx1, Ins1, Glut2 mRNA水平下降, 结果INS-1E细胞的葡萄糖刺激的INS分泌减退。
综上所述, 长期过多葡萄糖可能通过下调Pdx1和Glut2的表达, 影响INS mRNA的表达和葡萄糖在β细胞内的代谢, 导致胰岛β细胞功能减退, 这可能是T2D发病和进行性发展的重要原因。
4 致谢
感谢丹麦奥胡斯大学医院Per Bendix Jeppesen的技术指导。
[1] Ferrannini E, Gastaldelli A, Miyazaki Y,. Predominant role of reduced beta-cell sensitivity to glucose over insulin resistance in impaired glucose tolerance[J]. Diabetologia, 2003, 46(9): 1211-1219.
[2] Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Res, 2001, 29(9): e45.
[3] Robertson RP, Zhang HJ, Pyzdrowski KL,. Preservation of insulin mRNA levels and insulin secretion in HIT cells by avoidance of chronic exposure to high glucose concentrations[J].J Clin Invest, 1992, 90(2): 320-325.
[4] Brock B, Mogensen JH, Gregersen S,. Glucose desensitization in INS-1 cells: evidence of impaired function caused by glucose metabolite(s) rather than by the glucose molecule per se[J]. Metabolism, 2002, 51(6): 671-677.
[5] El-Assaad W, Joly E, Barbeau A,. Glucolipotoxicity alters lipid partitioning and causes mitochondrial dysfunction, cholesterol, and ceramide deposition and reactive oxygen species production in INS832/13 ss-cells[J]. Endocrinology, 2010, 151(7): 3061-3073.
[6] Khaldi MZ, Guiot Y, Gilon P,. Increased glucose sensitivity of both triggering and amplifying pathways of insulin secretion in rat islets cultured for 1 wk in high glucose[J]. Am J Physiol Endocrinol Metab, 2004, 287(2): E207-217.
[7] Harmon JS, Gleason CE, Tanaka Y,.prevention of hyperglycemia also prevents glucotoxic effects on PDX-1 and insulin gene expression[J]. Diabetes, 1999, 48(10): 1995-2000.
[8] Lupi R, Del Guerra S, Mancarella R,. Insulin secretion defects of human type 2 diabetic islets are correctedby a new reactive oxygen species scavenger[J].Diabetes Metab, 2007, 33(5): 340-345.
[9] Robertson R, Zhou H, Zhang T,. Chronic oxidative stress as a mechanism for glucose toxicity of the beta cell in type 2 diabetes[J]. Cell Biochem Biophys, 2007, 48(2-3): 139-146.
[10] Lombardi A, Ulianich L, Treglia AS,. Increased hexosamine biosynthetic pathway flux dedifferentiates INS-1E cells and murine islets by an extracellular signal- regulated kinase (ERK)1/2-mediated signal transmission pathway[J]. Diabetologia, 2012, 55(1): 141-153.
(编辑: 任开环)
Chronic effects of high glucose concentration on function of isolated mouse islets and islet β cell line INS-1E
ZHANG Yanling, ZOU Benliang
(Department of Education, Department of Endocrinology, Xiyuan Hospital, Chinese Academy of Chinese medicine, Beijing 100091, China)
To explore the chronic effects of excess glucose on INS-1E cells and isolated mouse islets.Islets were isolated by the collagenase digestion from adult female NMRI mice (6-10 weeks) after induction of anesthesia by phenpbarbital. INS-1E cells and isolated mouse islets were cultured in RPMI 1640 supplemented with 11.1 or 25.0 mmol/L glucose for 72 h, respectively. Then the medium were changed to Krebs-Ringer buffer containing 3.3 or 16.7 mmol/L glucose and incubated for 1 h. Correspondingly upper medium was collected for insulin assay. Total RNA was extracted from INS-1E cells after 72 h incubation with different concentration of glucose, then cDNA was synthesized and mRNA expressions of Pdx1, insulin 1, insulin 2, and GLUT2 were determined by RT-PCR.After incubation with excess glucose, basal insulin secretion was increased in both INS-1E cells and isolated mouse islets [INS-1E cells: (10.47±0.78)(7.71±0.59) ng/10000 cells,<0.01; isolated mouse islets: (3.85±0.26)(2.18±0.21)mg/L,<0.001], and glucose-stimulated insulin secretion was impaired [INS-1E cells: (17.11±1.98)(30.76±2.20) ng/10000 cells,<0.001; isolated mouse islets:(14.78±1.03)(20.46±1.49)mg/L,<0.01]. Pdx1, insulin 1, insulin 2, and GLUT2 mRNA levels were reduced in INS-1E cells after treatment of excess glucose.Long-term exposure to supraphysiologic glucose concentrations may cause dysfunction of pancreatic islet cells.
glucose; insulin-secreting cells; INS-1E cell line
R587.1
A
10.3724/SP.J.1264.2012.00055
2011-07-09;
2012-01-29
张艳玲, Tel: 010-62887973, E-mail: zhyllzhp@yahoo.com.cn
