不同耕作方式下春小麦生育期土壤酶时空变化研究
2012-04-12罗珠珠黄高宝蔡立群张仁陟李玲玲谢军红
罗珠珠,黄高宝,蔡立群,张仁陟,李玲玲,谢军红
(1.甘肃农业大学资源与环境学院,甘肃 兰州730070;2.甘肃省干旱生境作物学省部共建国家重点实验室,甘肃 兰州730070)
*土壤酶主要来源于植物根系分泌物和土壤微生物的增殖及其死亡残体的胞溶[1],在生态系统有机质的分解及养分循环过程中起着重要的作用[2-4],其活性反映了土壤中各种生物化学过程的强度和方向,并在响应作物轮作[5,6]、残留物管理[7-9]和土壤压实[7]、耕翻[9-11]等不同土壤管理措施的效果时比较敏感,对土壤质量状况具有指示作用[12]。Caravaca等[13]研究指出,对于土壤质量的变化,土壤酶活性比土壤有机质的变化更为敏感,能够在短期内发生变化,而土壤有机质的变化要缓慢得多,且土壤酶活性与土壤有机质、微生物量、土壤呼吸和碳截留量等指标显著相关[14-17]。也有研究[18]发现,免耕可以提高表层土壤蔗糖酶、脲酶、磷酸酶、芳基硫酸酯酶和α-2葡萄糖苷酶等土壤酶活性,但对深层土壤酶活性的研究结果却差异很大,这可能与作物种类、土壤类型和气候条件的差异有关[19]。此外,作物不同生育时期土壤酶活性存在一定的差异[20]。
土壤酶作为评价土壤质量的敏感性生物指标,一直以来在土壤理化性质与酶活性的关系、有机肥与化肥的施用对酶活性的影响等方面进行的研究较多[21,22]。而关于耕作方式对作物不同生育期土壤酶活性动态变化影响的报道较少。因此,本研究以黄土高原旱地为对象,探讨了不同耕作方式下参与土壤碳、氮、磷循环转化的4种土壤酶在春小麦生育期的时空变化,以期为评价耕作方式对土壤质量的影响提供科学依据。
1 材料与方法
1.1 研究区概况
试验设在黄土高原半干旱丘陵沟壑区的定西市安定区李家堡镇麻子川村,属中温带半干旱区,平均海拔2 000 m,年均太阳辐射592.9 kJ/cm2,年均降水390.9 mm,年蒸发量1 531 mm,干燥度2.53,为典型的雨养农业区。土壤为典型的黄绵土,土质疏松,土层深厚,质地均匀,贮水性能良好,其理化性状如表1所示。
1.2 试验设计
试验共设4个处理(表2),4次重复,共16个小区,小区面积4 m×20 m,随机区组排列。供试作物为春小麦(定西35)(Triticum aestivum),播种量187.5 kg/hm2。T、NT、TS、NTS用中国农业大学研制的免耕播种机播种,行距20 cm,播深为7 cm。各处理均施N 105 kg/hm2,P2O5105 kg/hm2(尿素+二铵);所有肥料都作为基肥在播种时同时施入。春小麦前茬作物为豌豆(Pisum sativum),秸秆还田处理豌豆收获脱粒后所有秸秆均归还原小区。
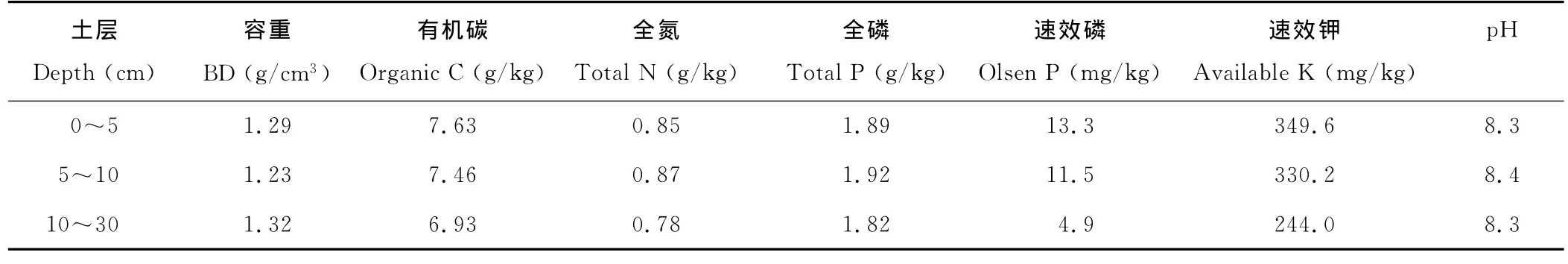
表1 研究区土壤理化性质Table 1 Soil chemical and physical properties

表2 试验处理描述Table 2 Treatments description
1.3 试验方法
2007年春小麦苗期(4月5日)、拔节期(5月10日)、灌浆期(7月1日)和成熟期(7月29日)采样,每小区用“S”形取样法随机选取5点,用土钻取0~30 cm土层土样,将所得土样装入塑料袋,写明采样地点、采样日期和采样深度。样品带回实验室,经混匀风干处理过1 mm筛后,进行室内分析。
土壤过氧化氢酶活性采用高锰酸钾滴定法[23],以20 min后1 g土壤所需的0.1 mol/L高锰酸钾的毫升数表示;碱性磷酸酶活性采用磷酸苯二钠比色法[24],以24 h后1 g土壤中释放的酚的毫克数表示;蔗糖酶活性采用3,5-二硝基水杨酸比色法[25],以24 h后1 g土壤中含葡萄糖的毫克数表示;脲酶活性采用靛酚蓝比色法[23],以24 h后1 g土壤中释放氨态氮的毫克数表示。
1.4 统计方法
所有分析均在SPSS 18.0软件下进行。
2 结果与分析
2.1 不同耕作方式下春小麦生育期土壤酶活性动态
不同生育期4种土壤酶活性在耕层0~30 cm土壤表现不一(表3)。土壤过氧化氢酶活性和蔗糖酶活性在春小麦整个生育期变化趋势基本一致,苗期2种酶活性均较低,平均为4.73 m L/(g·h)和16.92 mg/(g·d),拔节期2种酶活性均上升,到灌浆期出现峰值之后逐渐降低。但从方差分析结果来看,二者的变化却不尽相同,过氧化氢酶活性不同生育期存在一定差异,特别是灌浆期与其他生育期差异显著,而蔗糖酶活性各生育期均无显著差异。土壤耕层0~30 cm脲酶活性苗期到拔节期平均提高27.68%,拔节期达到整个生育期的峰值,之后持续下降一直延续到灌浆期,灌浆之后又有所回升。统计分析表明,脲酶活性拔节期显著高于成熟期,成熟期显著高于苗期和灌浆期,苗期与灌浆期无差异。土壤碱性磷酸酶活性与脲酶活性变化相似,表现为随着春小麦生育期的推进,拔节期上升,之后持续下降一直延续到灌浆期,灌浆之后又开始回升。但与土壤脲酶有所不同的是,碱性磷酸酶活性峰值出现在成熟期而非拔节期。因此,土壤碱性磷酸酶活性总体表现为各处理成熟期均显著高于其他生育期,TS和NTS灌浆期显著低于苗期和拔节期。
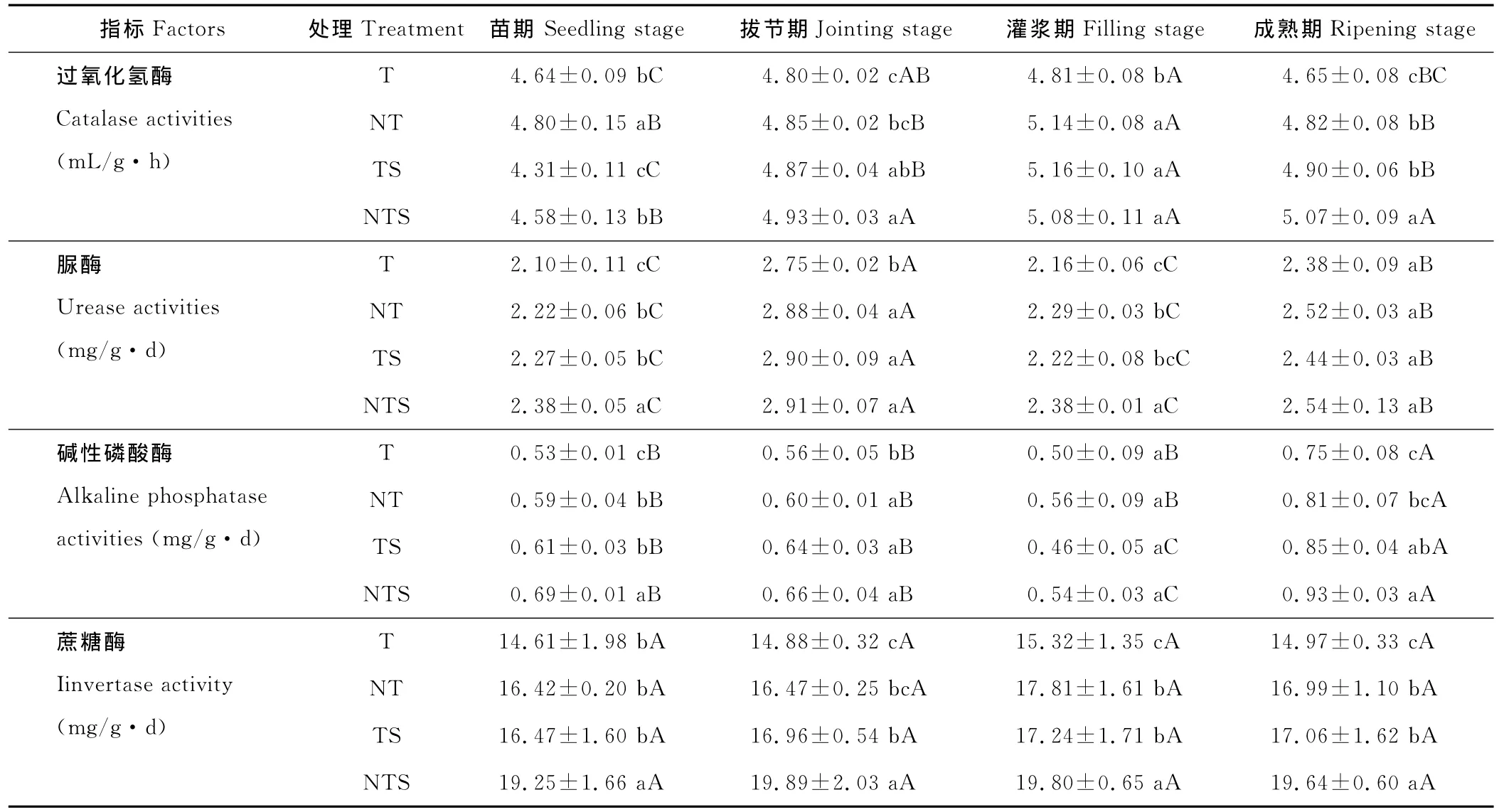
表3 不同耕作方式下小麦生育期耕层土壤酶活性(0~30 cm)Table 3 Soil enzyme activities under different tillage measures during spring wheat growing season
不同耕作方式间比较(表3),土壤过氧化氢酶活性苗期表现为NT>T>NTS>TS,随着小麦生长发育,拔节期和成熟期表现为NTS>TS>NT>T,灌浆期表现为TS>NT>NTS>T。进一步统计分析发现,苗期NT与其余处理间差异显著,拔节期和成熟期NTS与其余处理差异显著,灌浆期前3种处理均与T差异显著。与传统耕作T相比,整个生育期NTS、NT、TS过氧化氢酶活性分别比T增加4.02%,3.76%和1.80%。土壤脲酶活性生育前期(苗期和拔节期)表现为NTS>TS>NT>T,生育后期(灌浆期和成熟期)表现为NTS>NT>TS>T;苗期和灌浆期NTS与其余处理间差异显著,拔节期NTS仅与T差异显著,成熟期各处理间无差异。与传统耕作T相比较,整个生育期NTS、NT、TS脲酶活性分别比T增加8.74%,5.54%和8.06%。土壤碱性磷酸酶活性苗期、拔节期和成熟期表现为NTS>TS>NT>T,灌浆期为NT>NTS>T>TS;苗期和成熟期NTS与其余处理间差异显著,拔节期NTS仅与T差异显著,灌浆期各处理间无差异。与传统耕作T相比,整个生育期NTS、NT、TS碱性磷酸酶活性分别比T增加20.51%,9.40%和9.40%。土壤蔗糖酶活性整个生育期(包括苗期、拔节期、灌浆期和成熟期)均以NTS最高,T最低,且NTS与其余处理间差异显著。与传统耕作T相比较,整个生育期NTS、NT、TS蔗糖酶活性分别比T增加31.45%,13.23%和14.33%。
2.2 不同耕作方式下春小麦生育期土壤酶活性垂直变化
4种不同耕作方式下土壤过氧化氢酶活性在耕层0~30 cm剖面变化不一,随着土层的加深,T呈先增后减趋势,表现为5~10 cm>10~30 cm>0~5 cm;NTS、NT、TS呈递减趋势,表现为0~5 cm>5~10 cm>10~30 cm(图1)。不同处理间比较,表层0~5 cm土壤,免耕处理土壤过氧化氢酶活性显著高于翻耕,NTS和NT分别比T提高了9.35%和6.14%;5~10和10~30 cm土层虽然表现为免耕高于传统翻耕,但各处理间无显著差异。
4种不同耕作方式下,3种水解酶活性剖面分布与过氧化氢酶活性有所不同。免耕处理3种水解酶活性其剖面分布呈一定的规律性,NT和NTS 3种水解酶活性在0~30 cm剖面均呈递减趋势,表现为0~5 cm>5~10 cm>10~30 cm(图1)。翻耕处理除TS蔗糖酶活性在耕层呈递减趋势外,其余均呈先增后减趋势,表现为5~10 cm>0~5 cm>10~30 cm。不同处理间比较,表层0~5 cm土壤脲酶活性NTS和NT显著高于T,分别提高了13.65%和6.38%;5~10 cm表现为NTS显著高于T,提高了7.46%;10~30 cm土层NT和TS显著高于T,分别提高了6.18%和5.85%。碱性磷酸酶活性表层0~5 cm表现为NTS和NT显著高于T,分别提高了42.99%和16.58%;5~10和10~30 cm各处理间无显著差异。蔗糖酶活性表层0~5 cm土层NTS、NT和TS显著高于T,分别提高了52.70%,23.15%和21.14%;5~10 cm土层NTS和TS显著高于T,分别提高了21.00%和12.46%;10~30 cm土层NTS和NT显著高于T,分别提高了19.15%和10.91%。

图1 不同耕作方式下土壤酶活性垂直变化Fig.1 Soil enzyme activities at the profile of 0-30 cm under different tillage measures
2.3 耕作方式和生育时期对土壤酶活性的效应
方差分析表明(表4),生育时期、耕作方式和覆盖与否对土壤过氧化氢酶、脲酶、碱性磷酸酶和蔗糖酶(生育时期对蔗糖效应不明显)的单独效应均达到5%或1%显著水平。但三者对4种土壤酶活性的影响效应不同,其中生育时期对脲酶的影响最大,耕作方式和覆盖对蔗糖酶的影响最大,两两交互作用和三者交互作用均对过氧化氢酶的影响最大。表明耕作方式和生育时期对土壤酶活性有重要影响,通过合理耕作措施增强土壤酶活性,进而改善土壤肥力状况,可达到提高春小麦产量的目的。

表4 耕作方式和生育时期对土壤酶活性的影响(F值)Table 4 Effects of growth stage,tillage and cover on soil enzyme activities(F value)
3 讨论
3.1 耕作方式对不同生育期土壤酶活性的影响
土壤蔗糖酶、脲酶和磷酸酶在土壤碳、氮、磷循环中起重要作用[1,26]。土壤过氧化氢酶是由土壤中的细菌、真菌和植物的根部分泌的、是直接参与土壤中物质和能量转化的一种酶。本研究发现不同耕作方式下土壤蔗糖酶和过氧化氢酶活性随小麦生育期的推进一直上升,在灌浆期出现峰值之后开始下降,这与前人的研究结果基本一致[27]。其原因主要是随着生育期的递进,在拔节至灌浆期春小麦处于生长最旺盛的阶段,根系发达,且根系分泌物增多,微生物和酶代谢活动增强,在灌浆期活性达到最大值;灌浆之后,根系对养分吸收速度减慢,根系分泌物减少,土壤中蔗糖酶和过氧化氢酶活性也随之下降[27]。土壤脲酶活性从苗期开始到拔节期迅速上升并且达到整个生育期的峰值,这与当时的气温及作物生长的繁茂程度有关,因为脲酶活性主要受土壤温度和氮源影响。苗期根小,气温低,土壤脲酶活性低,随着生育期的后延,春小麦进入营养生长阶段,气温升高且作物根系生物量增加,根系分泌物增加,土壤脲酶活性亦随之明显增加。土壤脲酶活性在拔节期出现峰值之后开始下降,是由于拔节期到灌浆期作物生长旺盛,对土壤养分吸收迅速,出现作物与微生物争夺氮素营养的局面,从而抑制了土壤微生物的生长和繁殖,造成土壤脲酶活性降低。在灌浆之后土壤酶活性上升,其原因有待于进一步研究。土壤碱性磷酸酶活性从苗期到拔节期变化趋势平缓,到灌浆期活性降低,成熟期活性最高,总体表现出春小麦生长后期活性高于生长前期的趋势。García-Gil等[28]研究表明,当土壤中无机磷含量较高时,土壤磷酸酶活性受到抑制,而低磷条件下磷酸酶活性可被诱导。小麦的生育前期对养分的吸收以N素为主,到了生长后期,随着核蛋白物质增加,对磷素的吸收剧增,加之磷素易被固定而释放缓慢,则速效磷被作物吸收而迅速减少,从而诱导磷酸酶活性迅速增强。因此,小麦成熟期磷酸酶活性显著高于其他时期。
本研究同时发现,除苗期过氧化氢酶、灌浆期碱性磷酸酶和成熟期脲酶之外,免耕秸秆覆盖(NTS)4种土壤酶活性在春小麦其余生育阶段均显著高于传统耕作,这一方面与土壤表层的秸秆覆盖有关,因为作物残体是土壤生物活动的主要和有效能源,通过秸秆还田可给土壤酶提供大量作用底物,因而能激发并提高土壤酶活性[29]。特别是春小麦拔节后随着作物生育期的推进,地表温度升高、湿度增大,土壤微生物对地表秸秆的分解速度加快,从而提高了土壤酶活性[30]。另一方面与多年免耕造成的特殊土壤环境有关[31],免耕减少了土壤的扰动次数,有较好的团粒结构,维持了土壤良好的通透性,从而更有利于土壤酶活性的增加。单独的免耕(NT)或秸秆还田(TS)对土壤酶活性的效应表现为阶段性,二者对过氧化氢酶和蔗糖活性的提高作用主要体现在春小麦生育后期,而对脲酶和碱性磷酸酶活性的增强作用主要表现在春小麦生育前期,其原因尚有待于进一步研究探讨。
3.2 耕作方式对不同土层深度土壤酶活性的影响
Roldán等[32]的研究指出,免耕措施有利于提高表层土壤酶活性,但对深层土壤酶活性的影响不显著。这与本研究中土壤过氧化氢酶和碱性磷酸酶活性在剖面分布趋势一致,即表现为表层0~5 cm免耕处理(NT和NTS)显著高于传统翻耕 (T),而深层无差异。这主要是因为与免耕相比,常规耕作土壤有机质在各个土层的分布更为均匀,而免耕土壤有机质主要集中在土壤表层[33]。另外,植物根系和微生物对土壤酶的活性也有一定的影响,Holland[34]研究指出,土壤中分布的微生物群落和植物根密度在表层土壤免耕高于常规耕作,而在土壤深层常规耕作高于免耕。本研究中土壤脲酶和蔗糖酶活性在整个耕层0~30 cm均表现为NTS显著高于T,这与以往的研究有所不同,可能是土壤水热环境不同造成的。
免耕处理(NT和NTS)土壤过氧化氢酶、脲酶、蔗糖酶和碱性磷酸酶活性随着土层加深均呈下降趋势,这主要是因为耕作方式引起的土壤有机质的分层分布对土壤微生物的生长和繁殖产生影响,进而影响到土壤酶的活性[35]。翻耕处理中T土壤过氧化氢酶、脲酶、蔗糖酶和碱性磷酸酶活性以及TS土壤脲酶和碱性磷酸酶活性随土层加深,呈先增后减趋势,这与土壤中功能菌群的活性变化以及植物根系的分布有关[31];TS土壤过氧化氢酶和蔗糖酶活性随土层加深呈递减趋势,这与秸秆在土壤剖面的分布有关。
[1] 张丽莉,张玉兰,陈利军,等.稻-麦轮作系统土壤糖酶活性对开放式CO2浓度增高的响应[J].应用生态学报,2004,15(6):1019-1024.
[2] 王长庭,龙瑞军,王根绪,等.高寒草甸群落地表植被特征与土壤理化性状、土壤微生物之间的相关性研究[J].草业学报,2010,19(6):25-34.
[3] 文都日,李刚,张静妮,等.呼伦贝尔不同草地类型土壤微生物量及土壤酶活性研究[J].草业学报,2010,19(5):94-102.
[4] 托尔坤·买买提,于磊,鲁为华.不同生长年限苜蓿对土壤酶活性与养分的影响[J].草业科学,2010,27(11):21-25.
[5] Dick R P.Soil enzyme activity as biodiversity measurements as integrating biologic indicators[A].In:Doran J W.Handbook of Methods for Assessment of Soil Quality[C].Madison:SSSA Spec.Pub 49.Soil Society of America Special Publication pub,1996:247-272.
[6] Bolton H,Jr Elliot L F,Papendick R L,etal.Soil microbial biomass and selected soil enzyme activities effects of fertilization and cropping practices[J].Soil Biology &Biochemistry,1985,17:297-302.
[7] Dick R P,Myrold D D,Kerle E A.Microbial biomass and soil enzyme activities in compacted and rehabilitated skid trail soils[J].Soil Science Society of American Journal,1988,52:512-516.
[8] Bandick A K,Dick R P.Field management effects on soil enzyme activities[J].Soil Biology &Biochemistry,1999,31:1471-1497.
[9] Verstrate W,Voets J P.Soil microbial and biochemical characteristics in relation to soil management and fertility[J].Soil Biology &Biochemistry,1977,9:253-258.
[10] Martems D A,Johnson J B,Frankenberger Jr W T.Production and persistence of soil enzyme with repeated addition of organic residues[J].Soil Science,1992,153:53-61.
[11] Werten W,Scherer H W,Olfs H W.Influence of long-term application of sewage and compost from garbage with sewage sludge on soil fertility criteria[J].Journal of Agronomy and Crop Science,1988,160:173-179.
[12] Hang Y M,Zhou G Y,Wu N,etal.Soil enzyme activity changes in different aged spruce forests of the Eastern Qinghai Tibetan plateau[J].Pedosphere,2004,14:305-312.
[13] Caravaca F,Masciandaro G,Ceccanti B.Land use in relation to soil chemical and biochemical properties in a semiarid Medi-terranean environment[J].Soil & Tillage Research,2002,68:23-30.
[14] Aon M A,Cabello M N,Sarena D E,etal.Spatial-temporal patterns of soil microbial and enzymatic activities in an agricultural soil[J].Applied Soil Ecology,2001,18:239-254.
[15] Aon M A,Colaneri A C.Temporal and spatial evolution of enzymatic activities and physic-chemical properties in an agricultural soil[J].Applied Soil Ecology,2001,18:255-270.
[16] Roldán A,Salinas-García J R,Alguacil M M,etal.Changes in soil enzyme activity,fertility,aggregation and C sequestration mediated by conservation tillage practices and water regime in a maize field[J].Applied Soil Ecology,2005,30:11-20.
[17] Riffaldi R,Saviozzi A,Levi Minzi R,etal.Biochemical properties of a Mediterranean soil as affected by long-term crop management systems[J].Soil & Tillage Research,2002,67:109-114.
[18] 罗珠珠,黄高宝,李光棣,等.保护性耕作对旱作农田耕层土壤肥力及酶活性的影响[J].植物营养与肥料学报,2009,15(5):1085-1092.
[19] Wang F E,Chen Y X,Tian G M,etal.Microbial biomass carbon,nitrogen and phosphorus in the soil profiles of different vegetation covers established for soil rehabilitation in a red soil region of southeastern China[J].Nutrient Cycling in Agroecosystems,2004,68:181-189.
[20] Hernández R M,López Hernández D.Microbial biomass,mineral nitrogen and carbon content in savanna soil aggregates under conventional and no-tillage[J].Soil Biology & Biochemistry,2002,34:1563-1570.
[21] 叶家颖,马承豪,杨爱平,等.月柿根际土壤酶活性的研究[J].广西师范大学学报(自然科学版),2000,18(4):82-86.
[22] 林天,何园球,李成亮,等.红壤旱地中土壤酶对长期施肥的响应[J].土壤学报,2005,42(4):682-686.
[23] 严昶升.土壤肥力研究方法[M].北京:农业出版社,1988.
[24] 赵兰坡,姜岩.土壤磷酸酶活性测定方法探讨[J].土壤通报,1986,17(3):138-141.
[25] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
[26] 张玉兰,张丽莉,陈利军.稻-麦轮作系统土壤蔗糖酶活性对开放式CO2浓度增高的响应[J].应用生态学报,2004,15(6):1014-1018.
[27] 沈宏,曹志洪,徐本生.玉米生长期间土壤微生物量与土壤酶变化及其相关性研究[J].应用生态学报,1999,10:471-474.
[28] García Gil J C,Plaza C,Soler Rovira P,etal.Long-term effects of municipal solid waste compost application on soil enzyme activities and microbial biomass[J].Soil Biology &Biochemistry,2000,32:1907-1913.
[29] Bergstrom D W,Monreal C M,Tomlin A D,etal.Interpretation of soil enzyme activities in a comparison of tillage practices along a Topographic and textural gradient[J].Canadian Journal of Soil Science,2000,80:71-79.
[30] 宋日,吴春胜,牟金明,等.玉米生育期内土壤微生物量碳和酶活性动态变化特征[J].吉林农业大学学报,2001,23(2):13-16.
[31] 李焕珍,张忠源,杨伟奇,等.玉米秸秆直接还田培肥效果的研究[J].土壤通报,1996,27(5):213-215.
[32] Roldán A,Salinas García J R,Alguacil M M,etal.Changes in soil enzyme activity,fertility,aggregation and C sequestration mediated by conservation tillage practices and water regime in a maize field[J].Applied Soil Ecology,2005,30:11-20.
[33] 杨晶,沈禹颖,南志标,等.保护性耕作对黄土高原玉米-小麦-大豆轮作系统产量及表层土壤碳管理指数的影响[J].草业学报,2010,19(1):75-82.
[34] Holland J N.Effects of above-ground herb ivory on soil microbial biomass in conventional and no-tillage agro-ecosystems[J].Applied Soil Ecology,1995,20:275-279.
[35] Balota E L,Filho A C,Andrade D S,etal.Long-term tillage and crop rotation effects on microbial biomass and C and N mineralization in a Brazilian Oxisol[J].Soil & Tillage Research,2004,77:137-145.
