氮、磷输入对黄河口潮滩湿地不同生境下碱蓬种子萌发与幼苗生长的影响
2012-04-12宋红丽孙志高孙景宽牟晓杰姜欢欢孙文广
宋红丽,孙志高,孙景宽,牟晓杰,姜欢欢,孙文广
(1.中国科学院海岸带环境过程重点实验室 烟台海岸带研究所 山东省海岸带环境过程重点实验室 中国科学院烟台海岸带研究所,山东 烟台264003;2.中国科学院研究生院,北京100049;3.中国科学院湿地生态与环境重点实验室 中国科学院东北地理与农业生态研究所,吉林 长春130012;4.滨州学院 山东省黄河三角洲生态环境重点实验室,山东 滨州256603)
*氮(N)、磷(P)是湿地生态系统中非常重要的营养元素,其供给状况对于植物的初级生产具有重要影响。N是植物生长需求量最大的营养元素,作为形态建成的参与者、生理活动的限制者和调节者,N普遍制约着植物的初级生产力[1]。P是植物生长发育不可缺少的营养元素之一,它既是植物体内许多重要有机化合物的组分,同时又以多种方式参与植物体内各种代谢过程[2]。
黄河三角洲位于渤海湾南岸和莱州湾西岸,由黄河携带大量泥沙填充渤海淤积而成,是我国暖温带最广阔、最完整和最年轻的滨海湿地。黄河三角洲的天然植被大多为耐盐植被,主要包括芦苇(Phragmitesaustralis)、柽柳(Tamarixchinensis)、碱蓬(Suaedasalsa)、补血草(Limoniumsinense)等。碱蓬是黄河三角洲重要的盐生植被之一,作为潮滩湿地生态系统演替先锋阶段的碱蓬盐沼是黄河三角洲丹顶鹤、白鹭、鹆形目鸟类等的主要栖息地,同时还起着维持湿地系统正常演替,防风固堤,调节气候等多重重要功能。碱蓬常分布于海陆交互作用的潮滩地带,大面积碱蓬在潮滩分布形成奇特壮丽的“红地毯”景观。潮汐作用是影响潮滩湿地变化的重要驱动力,在海陆相互作用下,潮滩地带的各种环境因素变化剧烈、频繁,湿地的稳定性、干扰程度及频率也在不断变换,湿地面貌和结构始终处于变化之中。在碱蓬分布区内,由于潮滩不同位置环境条件特别是水盐条件的差异,分别在中潮滩和低潮滩形成了2种不同表现型的碱蓬群落,其对于盐分变化极为敏感。
近年来,由于人类活动(化学肥料使用、生活生产污水排放以及水土流失等)的影响,黄河口的有机物以及营养盐入海通量呈明显增加趋势。据2009年山东省海洋环境质量公报,每年大约有4 650 t的营养盐经黄河口进入渤海。大量营养盐的输入不仅对黄河入海口近岸水体的营养状况产生重要影响,而且其对于黄河口潮滩湿地N、P营养水平的影响也非常深刻。有研究表明,黄河口潮滩湿地不同生境条件下碱蓬的生长受N、P养分的限制状况不尽一致,中潮滩碱蓬主要受N养分限制,低潮滩碱蓬同时受N、P限制,但更主要受P限制[3]。在当前黄河入海口及潮滩湿地N、P营养盐输入量增加以及2种表现型碱蓬对N、P养分限制状况存在较大差异的前提下,N、P输入量的增加是否会对碱蓬的种子萌发及幼苗生长产生重要影响,目前尚不清楚。鉴于此,本研究以不同生境条件下2种表现型碱蓬为对象,探讨了不同N、P浓度对二者种子萌发和幼苗生长的影响。研究结果对于回答黄河口N、P输入量增加对潮滩湿地植被的生态影响具有重要意义,并可为黄河三角洲碱蓬退化湿地的生态修复提供理论依据。
1 材料与方法
1.1 研究区域与种子采集
黄河三角洲国家级自然保护区(37°40′~38°10′N,118°41′~119°16′E)于1992年经国家林业局批准建立,是全国最大的河口三角洲自然保护区,在世界范围河口湿地生态系统中具有较强的代表性,主要保护黄河口新生湿地生态系统和珍稀濒危鸟类。保护区总面积15.3万hm2,其中核心区面积5.8万hm2,缓冲区面积1.3万hm2,试验区面积8.2万hm2。保护区属暖温带季风性气候区,具有明显的大陆性季风气候特点,雨热同期,四季分明,冷热干湿界限极为明显。春季干旱多风,常有春旱,夏季炎热多雨,高温高湿,时有台风侵袭。该区年平均气温12.1℃,无霜期196 d,≥10℃的年积温约4 300℃,年均蒸发量1 962 mm,年平均降水量为551.6 mm,70%的降水集中于7和8月。保护区的土壤类型主要为隐域性潮土和盐土,主要植被类型为芦苇群落、芦苇-荻群落、穗状狐尾藻(Myriophyllumspicatum)群落、柽柳群落、碱蓬群落及补血草群落等,其中芦苇群落、柽柳群落及翅碱蓬群落分布较广。
1.2 种子采集与保存
2009年10月下旬,在黄河三角洲国家级自然保护区今黄河入海口北部的潮滩碱蓬分布区内,采集中潮滩碱蓬群落(37°45′57.0″N,119°09′40.7″E,JP1)和低潮滩碱蓬群落(37°46′38.9″N,119°09′41.4″E,JP2)的种子,其中低潮滩与中潮滩湿地的土壤理化性质、水分条件及养分条件等均存在较为明显的差异(表1)。采集的种子在自然风干后储存于4℃的冰箱中备用。

表1 不同生境下碱蓬湿地环境条件比较Table 1 Comparison of environmental conditions of S.salsa wetland in different conditions
1.3 试验设计
试验于2010年10-11月在中国科学院烟台海岸带研究所滨海湿地生态实验室进行。设置3个盐分浓度(A:0 mmol/L;B:300 mmol/L;C:600 mmol/L),3个 N 浓度(N1:1 mmol/L、N2:5 mmol/L、N3:10 mmol/L),3个P浓度(P1:1 mmol/L、P2:5 mmol/L、P3:10 mmol/L),共计18个处理。其中 N、P分别由 NaNO3、Na H2PO3提供,为了更明确地研究N、P对碱蓬种子萌发和幼苗生长的影响,仅考虑单种元素的影响,即在研究N的作用时溶液中不含有P,反之亦然。选择形态饱满的种子50粒,分别放在装有珍珠岩的发芽盒中,同时加入上述18种处理溶液于光照培养箱中,设置12 h光照(25℃)和12 h黑暗(20℃)交替培养,每个处理3个重复。
试验共进行20 d,前10 d每天测定种子萌发的个数,试验进行到第20天时,测定发芽盒中全部幼苗的鲜重、根、茎、叶的鲜重以及长度,然后放在烘箱中80℃烘干称重。计算叶重比(leaf weight ratio)(叶干重/全株干重)、茎重比(stem weight ratio)(茎干重/全株干重)、根重比(root weight ratio)(根干重/全株干重)和根冠比(root/shoot)(根干重/地上部分干重)。
1.4 数据处理与统计
运用Origin 7.5软件对数据进行作图和计算,运用SPSS 16.0对数据进行统计分析,碱蓬类型、盐分胁迫以及N或P养分对种子出芽率、干重鲜重的影响采用三因素方差分析。
2 结果与分析
2.1 N、P浓度及盐分对种子萌发的影响
2种碱蓬的种子发芽率均随盐分的升高而降低,相同盐分条件下,JP1的发芽率均明显高于JP2,且达到显著水平(P=0.00)(图1和表2)。通过对比不同N浓度对种子发芽率的影响可知,无盐分胁迫下,N浓度为1和10 mmol/L时,二者种子的发芽率均比5 mmol/L时高;但在高盐分胁迫下(600 mmol/L),高N浓度有利于二者种子的萌发;当盐分浓度为300 mmol/L时,不同N浓度对二者种子萌发的影响存在较大差异,低N浓度有利于JP1种子萌发,而高N浓度有利于JP2种子萌发。
不同P浓度对2种碱蓬种子萌发的影响存在显著差异(P<0.01)(图2),低盐分胁迫下(0和300 mmol/L),高P浓度有利于JP1种子的萌发,不利于JP2种子的萌发;但在高盐分胁迫下,二者的种子在低P浓度时均表现出较高的出芽率(18.6%和3.0%)。

图1 N浓度和盐分含量对碱蓬种子萌发的影响Fig.1 Effects of nitrogen and salinity concentration on the germination of S.salsa

图2 P浓度和盐分含量对碱蓬种子萌发的影响Fig.2 Effects of phosphorus and salinity concentration on the germination of S.salsa
2.2 N、P浓度及盐分对幼苗干重和鲜重的影响
2种碱蓬幼苗鲜重和干重的变化趋势基本一致,总体均表现为JP1>JP2(图3)。对比不同N浓度对幼苗鲜重和干重的影响发现,无盐分胁迫下,不同N浓度对JP1干重和鲜重的影响并无差异(P>0.05)。随着盐分的升高(300 mmol/L),低 N浓度(1 mmol/L)有利于JP1的生长,且其干重和鲜重均取得最大值(0.016和0.197 g);而高N浓度条件下,JP1的鲜重和干重均呈降低趋势。当盐分浓度升高至600 mmol/L时,随着N浓度的升高,JP1的鲜重和干重均呈增加趋势,即在高盐分条件下,高N浓度可促进植物的生长。JP2鲜重和干重的变化趋势与JP1基本一致,但在无盐分胁迫下,低N浓度对JP2生长的促进作用更为明显。

图3 N浓度和盐分含量对碱蓬鲜重和干重的影响Fig.3 Effects of nitrogen and salinity concentration on the fresh or dry weights of S.salsa
P浓度对2种碱蓬幼苗干重和鲜重影响的研究表明,P浓度相同时,盐分胁迫对于二者幼苗鲜重和干重的影响基本一致,即鲜重和干重均随盐分升高而降低(图4);不同P浓度对二者鲜重和干重的影响并不一致。无盐分胁迫下,高P浓度(10 mmol/L)有利于JP1幼苗的生长,且随P浓度升高其鲜重和干重均呈增加趋势。随盐分升高,低P浓度对JP1幼苗的生长比较有利,特别是当盐分浓度为600 mmol/L、P浓度为1 mmol/L时,JP1的幼苗具有最大的鲜重和干重(0.109和0.009 g)。与之相比,JP2的幼苗在低盐分胁迫(0和300 mmol/L)以及中等P浓度(5 mmol/L)条件下的生长比较有利,且干重和鲜重在此条件下均取得最大值(0.005和0.077 g)。与JP1相似,随着盐分的升高,低P浓度也有利于JP2幼苗的生长。对2种碱蓬种子出芽率、鲜重以及干重进行三因素方差分析,结果表明盐分含量和碱蓬类型存在明显的交互作用(表2)。
2.3 N、P浓度及盐分对幼苗不同器官生长的影响
不同N、P浓度条件下,2种碱蓬幼苗的根、茎和叶的长度变化不大(图5和6)。整体而言,二者根、茎的长度在N浓度或P浓度相同时均随盐分的增加而有所减小。对比不同N、P浓度对幼苗根、茎和叶长度的影响发现,随着N浓度的升高,JP1叶的长度呈增加趋势,而JP1的根、茎以及JP2的根、茎、叶对N浓度响应均不明显;与之相比,P对二者各器官的长度均无明显影响。
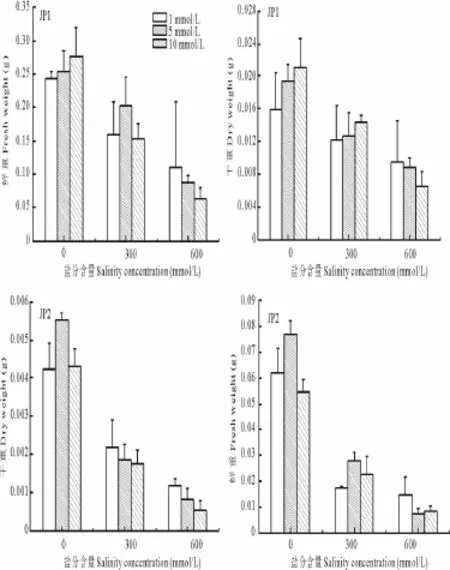
图4 P浓度和盐分含量对碱蓬鲜重和干重的影响Fig.4 Effects of phosphorus and salinity concentration on the fresh or dry weights of S.salsa

表2 不同N、P浓度条件下2种碱蓬种子出芽率、鲜重以及干重的三因素方差分析Table 2 Results of 3 factors analysis of variance for germination,fresh and dry weights of S.salsa in different nitrogen or phosphorus concentrations
在N浓度相同时,随着盐分的升高,2种碱蓬幼苗的根重比、茎重比和根冠比均降低,而叶重比均增大(表3和4),说明二者在盐分胁迫下,根和茎的生长减缓,而叶的生长相对较快。对比不同N浓度对各器官生长的影响发现,在无盐分胁迫下,不同N浓度对二者的根重比、茎重比、叶重比和根冠比几乎无影响;在盐分浓度为300 mmol/L时,二者根重比和根冠比的变化趋势一致,而茎重比和叶重比的变化趋势正好相反。在N浓度为5 mmol/L时,二者的根重比和根冠比取得最大值(0.26,0.35;0.14,0.16),而叶重比取得最小值(0.31,0.35);随着盐分浓度升高(600 mmol/L),二者的根重比和根冠比在N浓度为10 mmol/L时取得最大值(0.06,0.07;0.10,0.11),叶重比则在N浓度较低时取得最大值(0.64,0.60)。总之,不同N浓度对二者各器官生长的影响虽基本相似但是也存在一些差异,其中JP2的根冠比在高盐分高N浓度条件下要比JP1大。

图5 N浓度和盐分含量对碱蓬幼苗根、茎和叶长度的影响Fig.5 Effects of nitrogen and salinity concentration on the lengths of leaf,stem and root of S.salsa seedlings

图6 P浓度和盐分含量对碱蓬幼苗根、茎和叶长度的影响Fig.6 Effects of phosphorus and salinity concentration on the lengths of leaf,stem and root of S.salsa seedlings
不同P浓度以及盐分胁迫对2种碱蓬幼苗各器官生长的影响差异较大(表5和6)。在P浓度为5和10 mmol/L条件下,随着盐分的升高,JP1的根重比、茎重比和根冠比减小,叶重比增大,而JP2的相应变化规律并不明显,仅根冠比在高盐分(600 mmol/L)条件下取得最大值(0.21,1.21)。当P浓度为1 mmol/L时,JP1除茎重比呈降低趋势外,其他指标均呈增加趋势;而JP2的根重比、茎重比和根冠比均降低,叶重比则增加。对比不同P浓度对各器官生长的影响发现,在无盐分胁迫下,P浓度对二者根重比、茎重比、叶重比和根冠比的影响几乎无差异(P>0.05)。在盐分浓度为300 mmol/L时,不同P浓度对二者幼苗生长的影响基本一致,均表现为中等P浓度不利于根、茎的生长,但有利于叶的生长,且根冠比均在最大P浓度时最大(0.10,0.18)。随着盐分的升高(600 mmol/L),二者幼苗的生长状况差异较大。整体而言,随着P浓度的升高,JP1的根重比和根冠比均增加,叶重比降低,而JP2的根重比和根冠比均降低,叶重比增加。
3 讨论
3.1 N、P浓度及盐分对种子萌发的影响
本研究发现,在相同盐分条件下,JP1的出芽率均显著高于JP2。该研究结果与Song等[4]的相关研究结论相近。导致JP2的出芽率显著低于JP1的原因可能主要有两方面:1)JP2生长在低潮滩,其生长节律特别是种子成熟时间与JP1存在一定差异。已有研究表明,2种碱蓬的成熟时间有所不同,低潮滩碱蓬的成熟时间要比中潮滩碱蓬晚15~20 d[5]。2)由于JP2处于低潮滩,在这种盐分较高且环境多变条件下发育的植物种子质量一般较低,加之潮汐的作用,很多成熟的种子很容易会被潮汐带走或散落地面而被沉积物掩埋,进而使得不易采集到最理想状态的种子。
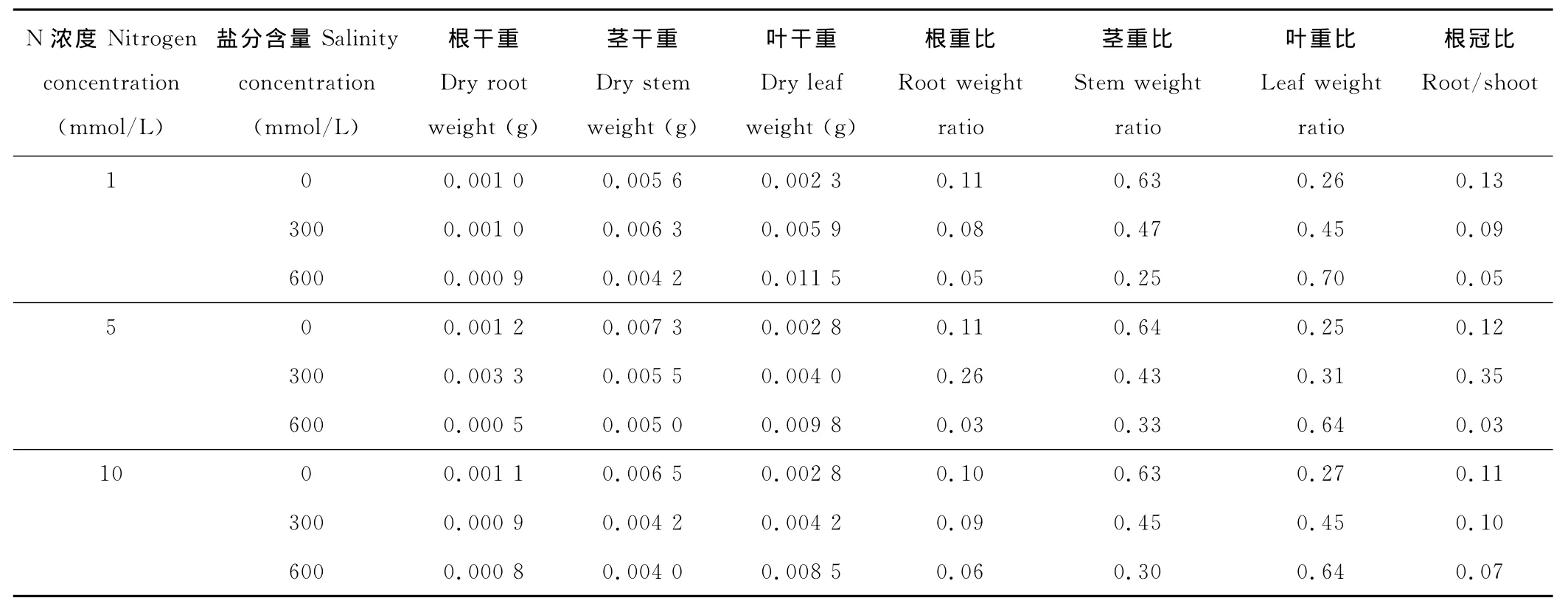
表3 N浓度及盐分含量对JP1幼苗各器官生长的影响Table 3 Effects of nitrogen and salinity concentration on the growth of leaf,stem and root of JP1

表4 N浓度及盐分含量对JP2幼苗各器官生长的影响Table 4 Effects of nitrogen and salinity concentration on the growth of leaf,stem and root of JP2

表5 P浓度及盐分含量对JP1幼苗各器官生长的影响Table 5 Effects of phosphorus and salinity concentration on the growth of leaf,stem and root of JP1
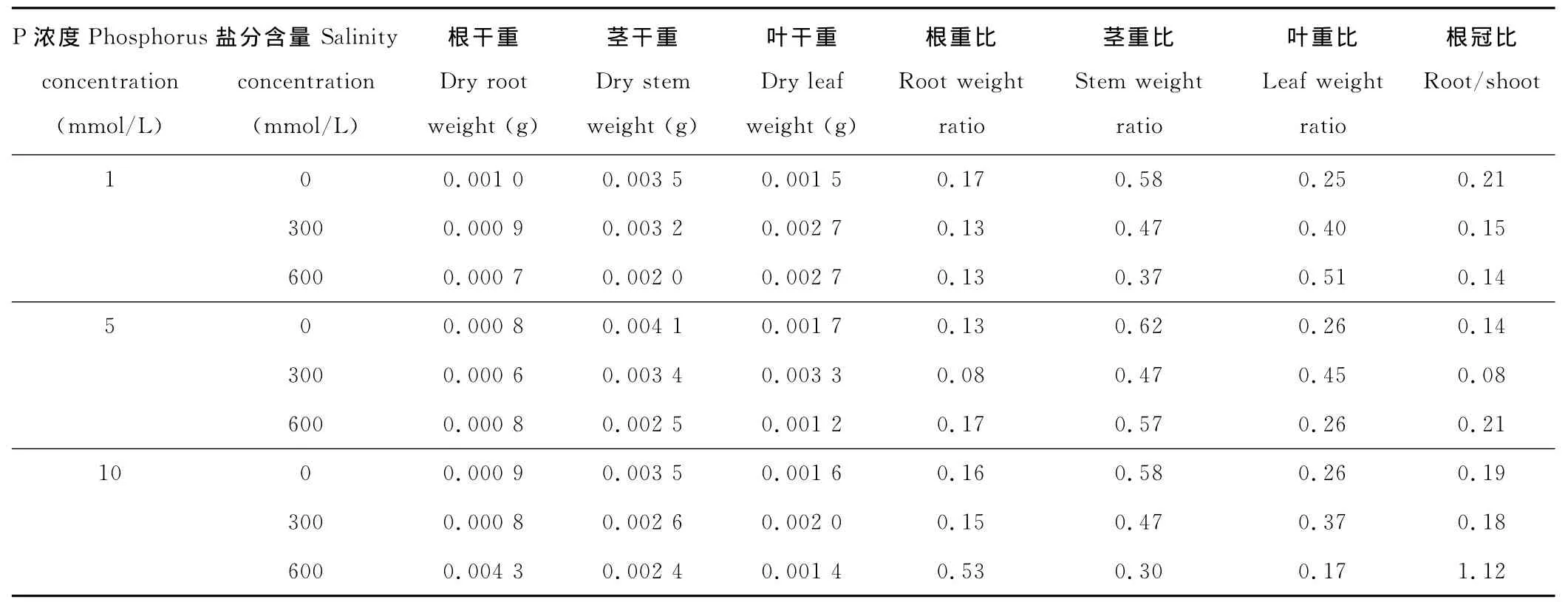
表6 P浓度及盐分含量对JP2幼苗各器官生长的影响Table 6 Effects of phosphorus and salinity concentration on the growth of leaf,stem and root of JP2
盐分胁迫对碱蓬种子萌发的影响较大。随着盐分浓度的增加,二者种子的出芽率均呈降低趋势,主要与高盐分胁迫下介质中较高的渗透压会影响种子萌发过程中水分吸收有关。另外,盐分增加还会使种子萌发过程中可溶性蛋白活性降低,一些溶解性或者非溶解性糖类减少,进而影响种子的萌发率[6]。研究还发现,高N浓度可缓解盐分对种子萌发的影响,即在高盐分(600 mmol/L)胁迫下,高N浓度有利于2种碱蓬种子的萌发。相关研究也得到类似的结论。赵海泉[7]的研究表明,氮化合物可促进花生(Arachis hypogaea)种子的萌发。Hendricks和Taylorson[8]研究也发现,重氮化合物、硝酸盐、亚硝酸盐、羟胺以及铵盐对种子萌发有促进作用,且该促进作用主要与这几种化合物抑制了过氧化氢酶对H2O2的分解以及硝酸盐和亚硝酸盐还原酶在活体内非常充足,可为种子萌发提供足够的NH2OH·HCl及还原剂有关。由于以上研究仅提及N的作用,而关于盐分和N养分交互作用对种子萌发影响的研究还鲜有报道,所以本研究得出的高盐条件下高N可促进种子萌发的结论以及其相应机制还有待进一步研究。
3.2 N、P浓度及盐分对鲜重和干重的影响
本研究表明,盐分胁迫和N水平均影响2种碱蓬幼苗的生长。在低N浓度(1和5 mmol/L)条件下,二者的鲜重和干重均随盐分浓度的升高而降低。但在高N浓度条件下,二者鲜重和干重随盐分浓度的升高均呈先降低后增加趋势,说明在高盐分条件下高N浓度可促进植物生长。原因主要有两方面:其一,高N浓度可减缓盐分胁迫对叶绿素a和叶绿素b的毒害作用[9]。范志强[10]对水曲柳(Fraxinusmandshurica)幼苗的研究也发现,供N水平增加时,水曲柳幼苗叶片的叶绿素含量、类胡萝卜素、可溶性蛋白含量以及可溶性糖含量增加,高N引起的这种生理水平上的改变可能有助于减缓盐分胁迫的毒害作用。其二,高浓度的NO3--N有助于植物在高盐分胁迫下调节体内的离子平衡,促进植物生长[11]。Song和 Xing[11]研究发现,低盐胁迫下(1 mmol/L)高浓度的NO3--N对叶中K+的含量没有很大的影响,但在高盐分胁迫下(600 mmol/L),高浓度N可增加叶片中K+的含量。植物体中有50多种酶是被K+激活的,并且K+的这种作用不能被Na+所代替[12],所以当植物体中K+缺乏时,植物的生长会受到抑制。由于本试验也是选用NO3--N作为N的供体,所以得出的结论与Song和Xing[11]的研究结果存在一定的相似性。
P营养对2种碱蓬幼苗生物量的积累也具有明显影响。低盐分胁迫下,高P浓度有利于生物量的积累,此时鲜重和干重较大。由于低盐分条件下盐分不是植物生长的主要制约因素,而P营养却是植物光合作用中光合磷酸化不可缺少的营养物质。在碳水化合物的代谢过程中,许多物质必须首先进行磷酸化作用,所以P就通过控制碳水化合物的代谢影响着植物的光合作用,进而控制植物的初级生产力[13],温洋和金继运[14]研究发现,增施磷肥可提高苜蓿(Medicagosativa)叶片叶绿素含量和叶绿素a/b。低盐分胁迫下,碱蓬生物量的积累受P的影响较大,从而表现出高P浓度有利于碱蓬生物量的积累。比较而言,在高盐分胁迫下,低P浓度却有利于2种碱蓬生物量的积累。由于在高盐分胁迫下植物的生理生化指标(如叶片质膜透性、脯氨酸含量和可溶性糖含量[15]、MDA含量[16]以及叶片叶绿素含量[17]均会发生很大变化,所以碱蓬生物量的积累主要受盐分和P交互作用的影响。在高盐胁迫和低P条件下,碱蓬幼苗将光合产物更多地分配至地下根系,其幼苗根冠比(表1,表2)和P利用效率高,从而有利于幼苗的生长。林磊和周志春[18]对木荷(Schimasuperba)的研究也得到类似结果,当植物处于环境胁迫(干旱)以及低P条件下,有利于木荷的生长。由于当前关于盐分胁迫与P交互作用的相关研究还鲜有报道,所以结合当前相关研究及本研究结果推测,低P偏好可能是植物适应环境胁迫的一个特殊生理适应机制,但该推论的正确性有待于进一步证实。
3.3 N、P浓度及盐分对幼苗生长状况的影响
N营养水平改变引起的植物体内碳分配的变化通常用叶重比、茎重比、根重比(叶、茎和根干重占整株干重的百分比)[19]、根茎比和根冠比[20]等参数加以描述。本研究发现,在N浓度相同条件下,随着盐分的升高,2种碱蓬幼苗的根重比、茎重比和根冠比均降低,而叶重比均增大。这主要是由于植物在逆境时,通常会调节地上和地下生物量分配,即改变植物的根重比、茎重比、叶重比以适应胁迫环境变化有关[21]。本研究结果与庄伟伟等[22]对银沙槐(Ammodendronargenteum)幼苗的研究结论不同,即随着胁迫程度(盐旱胁迫)的增加,银沙槐幼苗的根重比和根冠比增加,而叶重比降低。原因主要与盐分胁迫条件下不同植物幼苗各器官对盐分响应机制的差异有关。马红媛等[23]对4种禾本科牧草的研究发现,4种牧草的根冠比对NaCl胁迫的响应不同。随着NaCl浓度的增加,羊草(Leymuschinensis)根冠比呈显著上升趋势;高冰草(Agropygronelongatum)根冠比在低盐胁迫时 (50~150 mmol/L)显著低于对照;俄罗斯新麦草(Elymusjunceus)根冠比则随着 NaCl浓度增加呈显著下降趋势;苇状羊茅(Festucaarundinacea)的根冠比随着NaCl浓度增加则无显著变化。由于碱蓬为叶片肉质植物,该特点也是其对盐分胁迫的一种结构上的适应,因为在盐分胁迫下该结构可增大叶片中液泡的体积,从而可在叶片中积累更多水分(可溶性离子)[24]。
N营养对植物根冠的生长具有调控作用[25]。贫N诱发根系竞争性生长,冠根比(地上部分干重/根干重)相对较低;提高供N水平,地上干重增长速率高于地下,冠根比提高;过高的N营养则抑制根系的伸长,冠根比非常高[26]。对不同生境下碱蓬的相关研究发现,在无盐分胁迫下,N对幼苗不同器官的生长基本无很大影响;在中等盐分胁迫下,二者幼苗的根重比和根冠比在N浓度为5 mmol/L时取得最大值;在高盐分胁迫下,二者幼苗的根重比和根冠比在10 mmol/L时取得最大值,说明不同N浓度对二者幼苗生长状况的影响与盐分之间存在密切关系。另外,根系的生长状况与地上部生理代谢和干物质积累也密切相关。根冠比过小,表明根系生长不良,难以为地上部输送充分的养分和水分,而根冠比过大,出现根系冗余,使光合产物向生殖器官的投入减少,影响地上部生物学产量的形成,导致水分和养分的利用效率降低[25]。2种碱蓬的根系在高盐分胁迫下的生物量较低,从而影响养分和水分的供给,但在N存在条件下,会缓解这一现象。此时,植物根系增加可提供足够的养分和水分,进而使得植物可适应高盐分胁迫。
P营养对植物不同器官的生长状况也具有一定的调节作用。已有研究表明,根系形态及其在低P胁迫条件下的变化是影响植物吸磷能力的一个重要因素。植物在低P条件下,不仅地上部同化物向根系的运输量增加[27],而且根系对同化物的利用效率也有所提高[28],进而使缺磷植物的根冠比增大。根冠比增大是植物适应低P环境的重要机制之一[29]。不同P浓度对2种碱蓬幼苗各器官生长状况的影响差异较大。在低盐分胁迫下,不同P浓度对二者幼苗生长的影响基本一致,但在高盐分胁迫下,随着P浓度的升高,JP1的根重比和根冠比均增加,叶重比降低,而JP2的根重比和根冠比均降低,叶重比增加。相关研究发现,二者由于所处水盐梯度的差异形成绿色和紫红色2种表现型,其叶片肉质化程度[30]、叶片色素积累及光合特性[31]、叶片抗氧化系统[32]等均具有明显差异,内部组织结构的差异可能会影响到幼苗对P的吸收和利用,进而表现为P对碱蓬各器官生长状况(如根冠比等)影响的差异。
综上所述,N、P浓度对不同生境下碱蓬种子萌发及幼苗生长存在影响,且整体表现在高盐分胁迫条件下,高N浓度或低P浓度有助于二者种子萌发和幼苗生长。据2009年山东省海洋环境质量公报显示,近年来黄河口营养盐呈增加趋势,且主要污染物为无机氮,P含量相对较低,为黄河口近岸海域的限制性因子。所以依据本研究结果,黄河水的输入对黄河口潮滩碱蓬退化区的恢复具有有利的作用。
[1] Attiwill P M,Adams M A.Nutrient cycling in forests[J].New Phytology,1993,124:561-582.
[2] Theodorou M E,Plaxton W C.Metabolic adaptations of plant respiration to nutritional phosphate deprivation[J].Plant Physiology,1993,101:339-344.
[3] 牟晓杰.黄河口滨岸潮滩湿地系统氮生物循环特征与循环模式研究[D].北京:中国科学院研究生院,2010.
[4] Song J,Fan H,Zhao Y Y,etal.Effect of salinity on germination,seedling emergence,seedling growth and ion accumulation of a euhalophyteSuaedasalsain an intertidal zone and on saline inland[J].Aquatic Botany,2008,88:331-337.
[5] 牟晓杰,孙志高,王玲玲,等.黄河口滨岸潮滩不同生境下翅碱蓬氮的累积与分配特征[J].湿地科学,2010,8(1):57-66.
[6] Yasin Ashraf M,Afaf R,Saleem Qureshi M,etal.Salinity induced changes inα-amylase and protease activities and associated metabolism in cotton varieties during germination and early seedling growth stages[J].Acta Physiologiae Plantarum,2002,24:37-44.
[7] 赵海泉.KNO3、(NH4)Mo7O6、NADH 预处理对花生种子活力及幼苗生长的影响[J].安徽农业大学学报,1997,24(3):302-305.
[8] Hendricks S B,Taylorson R B.Promotion of seed germination by nitrate,nitrite,hydroxylamine,and ammonium salts[J].Plant Physiology,1974,54:304-309.
[9] Kaya C,Tuna A L,Ashraf M,etal.Improved salt tolerance of melon(CucumismeloL.)by the addition of proline and potassium nitrate[J].Environmental and Experimental Botany,2007,60:397-403.
[10] 范志强.氮磷营养及氮形态对水曲柳幼苗生长和生理的影响机制[D].哈尔滨:东北林业大学,2004.
[11] Song J,Xing S.Effects of salinity and nitrogen on growth,contents of pigments,and ion accumulation of a euhalophyteSuaedasalsain an intertidal zone and on saline inland[J].Communications in Soil Science and Plant Analysis,2010,41:88-97.
[12] Bhandal I S,Malik C P.Potassium estimation,uptake,and its role in the physiology and metabolism of flowering plants[J].International Review of Cytology,1988,110:205-254.
[13] 那守海.氮磷营养对落叶松幼苗生长的调控[D].哈尔滨:东北林业大学,2008.
[14] 温洋,金继运.施磷对紫花苜蓿光合特性以及生长的影响[J].中国土壤与肥料,2007,(6):34-37.
[15] 王凌晖,施福军,朱宏光,等.盐分胁迫下巨尾桉苗期生长与生理特性的变化[J].福建林学院学报,2009,29(2):97-102.
[16] 李俊贞,覃静,邓力,等.盐分胁迫对灰木莲苗木生长及生理指标的影响[J].西部林业科学,2011,40(2):40-43.
[17] 张建锋,张旭东,周金星,等.盐分胁迫对杨树苗期生长和土壤酶活性的影响[J].应用生态学报,2005,16(3):426-430.
[18] 林磊,周志春.水分和磷素对木荷不同种源苗木生长和磷效率的影响[J].应用生态学报,2009,20(11):2617-2623.
[19] Vender Werf A,Nagel O W.Carbon allocation to shoots and roots in relation to nitrogen supply is mediated by cytokinins and suerose[J].Plant and Soil,1996,185:21-32.
[20] Mackie Dawson L A,Millard P,Proe M F.The effect of nitrogen supply on root growth and development in Sycamore and Sitka spruce trees[J].Forestry,1995,68(2):107-114.
[21] 韦莉莉,张小全,侯振宏,等.杉木苗木光合作用及其产物分配对水分胁迫的响应[J].植物生态学报,2005,29(3):394-402.
[22] 庄伟伟,李进,曹满航,等.盐旱交叉胁迫对银沙槐幼苗生理生化特性的影响[J].武汉植物学研究,2010,28(6):730-736.
[23] 马红媛,梁正伟,王明明,等.NaCl胁迫对四种禾本科牧草种子萌发的影响[J].生态学杂志,2009,28(7):1229-1233.
[24] Vicente O,Boscaiub M,Narajo M A,etal.Responses to salt stress in the halophyte Plantago crassifolia(Plantaginaceae)[J].Journal of Arid Environments,2004,58:463-481.
[25] 任书杰,张雷明,张岁岐,等.氮素营养对小麦根冠协调生长的调控[J].西北植物学报,2003,23(3):395-400.
[26] 林文,李义珍,郑景生,等.施氮量及施肥法对水稻根系形态发育和地上部生长的影响[J].福建稻麦科技,1999,17(3):21-24.
[27] Rufty Jr T W,Israel D W,Volk R J,etal.Phosphate regulation of nitrate assimilation in soybean[J].Joural of Experimental Botany,1993,44:879-891.
[28] Freeden A L,Rao I M,Terry N.Influence of phosphorus nutrition on growth and carbon partitioning inGlycinemax[J].Plant Physiology,1989,89:225-230.
[29] Marschner H.Functions of Mineral nutrition:Macronutrients,in Mineral Nutrition of Higher Plants[M].London:Academic Press,1995:229-312.
[30] 刘彧,丁同楼,王宝山.不同自然盐渍生境下盐地碱蓬叶片色素积累及光合特性的研究[J].山东师范大学学报(自然科学版),2006,21(2):102-104.
[31] 阮圆,刘彧,王宝山.不同自然盐渍生境下盐地碱蓬叶片色素积累及光合特性的研究[J].山东师范大学学报(自然科学版),2008,23(1):115-117.
[32] 王琳,岳晓翔,王宝山.不同生境下两种表型盐地碱蓬叶片POD比较研究[J].山东师范大学学报(自然科学版),2008,23(4):103-105.
