碳素铬铁水热法制红矾钠
2012-04-10纪柱
纪柱
(中海油天津化工研究设计院,天津300131)
碳素铬铁水热法制红矾钠
纪柱
(中海油天津化工研究设计院,天津300131)
摘 要:在碳素铬铁水热法制铬酸钠的基础上,充分利用二氧化碳的酸化、催化作用,可在不增添设备和原料的情况下,使反应产物由含少量游离碱的铬酸钠碱性液,转变为含少量铬酸钠的重铬酸钠溶液,同时碱耗下降1/3。该反应可用纯碱代替烧碱。结果表明,采用炉料铬粉水热反应制得的红矾钠成本可望低于铬铁矿焙烧法的成本。
关键词:碳素铬铁水热法;红矾钠;纯碱
碳素铬铁是铬铁矿冶炼成的铬铁合金,是生产不锈钢及其他含铬合金的基本原料,也是生产部分铬化合物的原料。水热反应是在超过正常沸点和大气压的水溶液中进行的化学反应。红矾钠是基本化学品之一,不仅可直接作为氧化剂用于生产药物、染料、多种有机物,而且还是生产包括氧化铬、碱式硫酸铬、铬酸酐、金属铬、以及绝大部分铬化合物的基本原料。工业化的红矾钠主要采用铬铁矿碱性氧化焙烧,可使焙烧产物铬酸钠同矿石中的杂质得以廉价、方便地分离,并经酸化后制成红矾钠产品。但铬铁矿中包括六价铬在内的杂质会以铬渣形式排出,难以利用,且会引起环境污染。
目前,仅有山崎仲道[1-4]利用铬铁矿和水热法制备铬酸钠的报道,但因反应温度和压力过高(450℃,12MPa氧压)而未见工业化。继碳素铬铁水热氧化法生产铬酸钠专利[5]公开后,徐红彬等[6]采用铬铁矿水热法制备了铬酸钠,在热压釜内铬铁矿、氢氧化钠溶液同加压下的空气或纯氧、臭氧加热反应,铬氧化率达99%以上。由于其碱用量为理论量的数倍,致使硅、铝亦生成硅酸钠、铝酸钠随同铬酸钠进入浸出液,需加入氧化钙使硅、铝形成不溶性的钙化合物沉淀去除,因而存在与焙烧法类似的铬渣无害化问题。
碳素铬铁是高度富集的铬精矿,国内外都曾尝试将碳素铬铁用回转窑焙烧制得铬酸钠,均因原料价格高于铬铁矿,且所需填料过多,而未能得到广泛推广和应用。梅海军等[5]研究了碳素铬铁水热氧化法生产铬酸钠的工艺,已在3 000 t/a中试线上陆续进行了2 a多的试验,累计产出合格铬酸钠碱性液折合Na2CrO4超过1 000 t,已成功用于生产铬黄颜料。特别是全流程连续72 h考核产出相当于30.6 t铬酸钠的碱性液,取得了新工艺的基本参数。经技术经济比较,其成本与传统工艺持平,但工艺流程简单,环境效益明显优于传统工艺,现正开展50 000 t/a生产厂的前期工作。
1 碳素铬铁水热法制铬酸钠
1.1 工艺过程
搅拌下将粉末状高碳铬铁悬浮于热压釜内的氢氧化钠水溶液中,氢氧化钠量(即配碱率)为高碳铬铁中铬生成铬酸钠所需理论量的80%~90%(质量分数),氢氧化钠水溶液的初始质量浓度为 200~400 g/L,通入可将高碳铬铁中Cr、Fe、C、Si等杂质全部氧化为CrO3、Fe2O3、CO2、SiO2所需理论量100%± 10%(质量分数)的纯氧,在 240~300℃、初压 6~10MPa和30~120min条件下,杂质氧化物与氢氧化钠反应生成钠盐,再与三价铬氧化生成铬酸钠。在优化条件下高碳铬铁中铬转化为铬酸钠的氧化率约90%。
1.2 新技术的优点
1)工艺流程短,设备少。仅有配料、反应、换热冷却(回收反应热)、滤洗4道工序。主要设备为热压釜、供氧及配料装置、换热系统、压滤机及滤洗液贮罐。单位容积反应器的产率远高于传统工艺的回转窑。
2)碳素铬铁水热法制铬酸钠属于环境友好型清洁工艺。除少量来自碳素铬铁中C氧化生成的CO2外,无其他废气排放,且完全不产生工艺废水、废渣,环境效益极好。虽使用热压釜,但通过全程自动化及采取相应的劳动保护措施,可实现安全生产。
3)碳素铬铁水热法制铬酸钠属于节能低碳技术。主要能耗用于物料输送和自动监控系统。反应过程放出的热量较多,足以通过换热系统回收并供给原料预热,故反应过程无能源消耗。
4)滤液除铬酸钠外仅含少量游离碱,产品纯度高,适于制取其他铬化合物,可送其他车间生产红矾钠、铬黄颜料或氧化铬。滤液分离后的滤饼仅含水合氧化铁、水合硅酸及未氧化的氧化铬,可送铬黑车间生产陶瓷颜料,或出售用于生产铁系颜料,从而实现碳素铬铁资源100%利用。
5)2010年初核算显示,以炉料铬粉水热反应制得铬酸钠车间成本与铬铁矿焙烧法大体相当。成本中最大一项为原料碳素铬铁,碳素铬铁按含碳量分为高碳、中碳、低碳、微碳铬铁,以高碳铬铁价格最为低廉。一般高碳铬铁w(Cr)>60%,南非所产铬矿的Cr/Fe质量比小于2,只能生产w(Cr)≈50%的炉料铬,以Cr计的价格低于一般高碳铬铁,破碎分级后形成的大量下脚料——炉料铬粉售价更低,故以廉价炉料铬粉为原料可明显降低水热法成本。
2 二氧化碳的催化作用
碳素铬铁中的碳生成的CO2在密闭的热压釜内具有碳化、酸化、催化作用,有可能在保持碳素铬铁高氧化率的同时降低碱耗。用纯碱代替烧碱,并使水热反应直接产物由原来的碱性液(含有少量游离碱的铬酸钠溶液)提升为酸化液(含有少量铬酸钠的重铬酸钠溶液),从而明显降低红矾钠(晶体二水重铬酸钠)成本。若使用炉料铬粉为原料,可使商品红矾钠成本低于铬铁矿氧化焙烧法。
2.1 主要反应
热压釜内除原料基本反应外还有CO2参与的多种反应[反应式(1)~(3)]。一般高碳铬铁氧化所形成的CO2,在300℃热压釜内若不反应,理论上能形成pCO2≈2MPa的分压,二氧化碳可与之前反应生成的Na2CO3进一步碳化成NaHCO3[式(1)],还能与水共同行使酸化作用,分别使硅酸钠酸化、聚合成易于过滤的大分子水合硅酸SiO2·x H2O[式(2)];也使铁酸钠酸化、水解为高比表面积的水合氧化铁(氢氧化铁的水合物)[式(3)]。

高压下的CO2是有相当强度的酸,能发挥更重要作用,使热压釜内刚生成的铬酸钠酸化为重铬酸钠,如式(4):

同时还生成碳酸氢钠[7],碳酸氢钠可作为碱源参与碱性氧化反应,将三价铬氧化为六价铬,只是碳酸氢钠的反应速度低于碳酸钠和氢氧化钠反应速度,如式(5):
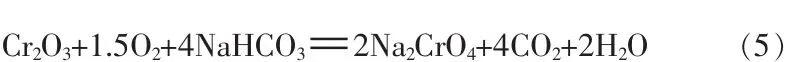
将式(4)、(5)合并,得到更直观的碳酸氢钠碱性氧化反应式:
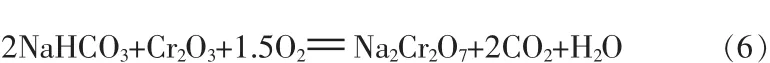
式(4)的CO2对铬酸钠的酸化反应为可逆反应,溶液中酸性Na2Cr2O7和碱性NaHCO3间的平衡浓度依赖于温度、CO2分压、Na2CrO4浓度和总碱浓度。如果反应前原料混合物的配碱率过高,未反应的NaOH、Na2CO3将新生成(酸性的)的重铬酸钠中和,从而抑制式(4)向右进行,阻止铬酸钠酸化为重铬酸钠。相反,若配碱量明显低于理论量,随着水热反应的进行,NaOH、Na2CO3消耗殆尽,CO2对铬酸钠的酸化作用得以增强。如果在280~300℃保持适宜氧分压并适当延长反应时间,将生成的碳酸氢钠引向式(5)、(6),既提高氧化率又推动(4)不断向右进行,促使更多铬酸钠酸化为重铬酸钠,即提高酸化率(酸化率的定义为:以重铬酸钠存在的六价铬占总六价铬的质量分数)。这样,式(4)消耗的CO2在式(5)、(6)的反应中再生,CO2没有其他消耗,只在水热体系内反复循环,起到了催化作用。
2.2 实验
原料:碳素铬铁[成分组成为:w(Cr)=49%、w(Fe)= 36%、w(C)=8%、w(Si)=7%],为南非炉料级高碳铬铁分级后的细碎部分,粒径<70μm。
试剂:烧碱(氢氧化钠)、纯碱(碳酸钠)、重碱(碳酸氢钠),分析纯;部分实验使用工业烧碱,w(NaOH)= 95%;纯氧用工业钢瓶氧气。
仪器:除反应器为容积3 L的不锈钢制热压釜外,其他均使用一般实验室装置,热压釜搅拌速度350 r/min。
将200 g炉料铬粉、1 000mL水、指定量碱置于热压釜内,密闭后通入纯氧至指定压力,不断搅拌下升温至指定温度,恒温搅拌一定时间,冷却至接近室温,减压放空、过滤、水洗,对滤饼、滤液及洗水进行计量和分析。
自变量包括配碱率(实际配碱量与理论需碱量之比,理论需碱量以炉料铬粉中每个铬原子需2个钠原子计)、配氧率(实际通氧量与理论需氧量之比,以炉料铬粉中全部单质Cr、Fe、C、Si氧化为CrO3、Fe2O3、CO2、SiO2所需氧量之和为理论需氧量)、反应温度、热压釜表压。
测定滤洗液量及六价铬浓度、pH、酸化率、及杂质含量;分析滤饼组成,计算氧化率(六价铬占总铬的质量分数)和碱利用率(氧化率与配碱率之比)。
2.3 实验结果
2.3.1 碳酸钠的碱性氧化反应
依上述步骤进行实验,配碱率100%(其中95%用碳酸钠、5%为氢氧化钠),配氧率100%,在300℃下反应2 h。热压釜冷却至33℃出料。铬氧化率及碱利用率均为99.98%;滤液pH约6.5,酸化率为17.79%;洗出液检出NaHCO3。
实验证明:1)水热条件下纯碱亦可参与碱性氧化反应将三价铬氧化为六价铬,实际上即使全部使用烧碱,反应开始不久,碳素铬铁中的碳氧化形成的CO2便可将烧碱碳化为纯碱;2)滤液酸化率为17.79%和洗出液含NaHCO3,证实存在式(4)的可逆反应,致使反应完成液中同时存在 Na2Cr2O7和NaHCO3间的平衡;3)氧化率几乎为100%,证明碳素铬铁中铬可全部氧化,比铬更活泼的单质碳、硅、铁亦可全部氧化;4)酸化、水化生成的水合氧化铁Fe2O3·y H2O及水合硅酸SiO2·x H2O表面积大,致使洗涤速度慢、洗水量大。因此,滤饼宜加工成铁系颜料,作为水热反应有价值的副产品。
2.3.2 碳酸氢钠的碱性氧化反应
除配碱率50%(碳酸钠5%、碳酸氢钠45%)外,其他同2.3.1节的实验。氧化率为80.75%,碱利用率为161.5%;滤液pH约4.5,酸化率为80.38%。
实验证明:1)水热条件下重碱亦参与碱性氧化反应将三价铬氧化为六价铬;2)配碱率低时,氧化率可大于配碱率,致使碱利用率高达161.5%,表明原料NaHCO3提供的CO2增大了热压釜内二氧化碳分压pCO2,增强了CO2催化作用,推动了式(4)的酸化反应,生成了更多NaHCO3参与式(5)、(6)的碱性氧化反应,提高了氧化率和碱利用率;3)酸化率为80.38%,即滤液的六价铬中重铬酸钠为80.38%,铬酸钠不到20%,进一步证明式(4)~(6)的二氧化碳具有酸化、催化作用。
2.3.3 铬酸钠代替碱反应
不用任何碱,仅用铬酸钠和氧在热压釜内对炉料铬粉进行水热反应。将140 g炉料铬粉、700mL铬酸钠溶液(Na2CrO4质量浓度为436.38 g/L)置于热压釜内,配氧率为100%,在300℃反应2 h。反应完成后溶液Na2CrO4质量浓度增至610.58 g/L,酸化率为62.72%。由滤液和洗出水中增加的六价铬量计算得到炉料铬粉中铬的氧化率为95.48%。在配氧率为90%~170%的9个实验中,铬的氧化率为82.57%~99.07%,与使用氢氧化钠或碳酸钠的效果接近。
2.3.4 配碱率对氧化率、碱利用率和酸化率的影响
碱源使用氢氧化钠,配氧率为115%,在300℃反应1h。不同配碱率的水热反应结果见表1。

表1 配碱率对氧化率、碱利用率和酸化率的影响 %
由表1可见,随着配碱率增加,氧化率增大,但碱利用率和酸化率明显下降,其中酸化率下降更快。
2.3 .5 纯碱与烧碱比较
配碱率均为60%,在300℃反应1 h。用氢氧化钠作碱源,氧化率为86.16%,碱利用率143.6%。若1/3用氢氧化钠、2/3用碳酸钠,2次实验的氧化率分别为91.92%和93.94%,碱利用率分别为153.2%和156.6%,效果优于全部用氢氧化钠的实验。进一步证明:与氢氧化钠相比,碳酸钠增大了热压釜内二氧化碳分压,增强了CO2催化作用,进而推动了式(4)~(6)的反应,提高了氧化率、碱利用率。
2.3.6 制晶体十水铬酸钠和红矾钠
将上述实验中酸化率大于70%的滤液混合,浓缩至Na2Cr2O7·2H2O质量浓度为 800 g/L,降温至-12℃,分离析出的晶体十水铬酸钠 Na2CrO4· 10H2O。滤液酸化率增至97%。加入铬酸酐CrO3至酸化率为100.2%,蒸发浓缩、冷却结晶,得到红矾钠:w(Na2Cr2O7·2H2O)=98.38%、w(Cl)=0.070%、w(Si)= 0.057%、w(Fe)=0.070%,符合GB/T 1611—2003《工业重铬酸钠》一等品的要求;上述十水铬酸钠中w(Na2CrO4·2H2O)=104.69%,w(Cl)=0.017%、w(Si)= 0.030%、w(Fe)=0.003%。
3 讨论
同一反应器除在300℃延长反应时间0.5~1 h外,在几乎不增加其他消耗的条件下充分利用二氧化碳催化作用之后,还有以下优势。
1)碱耗明显下降。以上实验显示,只要配碱率为50%~60%和配氧率≥100%,且反应温度、反应时间适宜,氧化率可达80%~90%,甚至高于95%,因而碱用量可以减少约1/3。
2)碱源可用纯碱代替烧碱,不仅价格稍廉,对设备腐蚀性较低,而且可以增大CO2分压及其催化作用,提高铬氧化率,因而降低碳素铬铁消耗。
3)提升产品价值。热压釜产物由原来pH约10的碱性液提升为pH约4的酸化液——含少量铬酸钠的重铬酸钠溶液。由于铬盐的母体产品为红矾钠,商品铬酸钠的需求量很少,铬酸钠碱性液要制成红矾钠须先用酸化剂中和游离碱,然后用硫酸法、碳化法或电解法加工成红矾钠。而2.3.6节制取红矾钠技术极为简单,与工业硫酸法相比,无需原料硫酸,也不产生含六价铬因而价格低廉的副产物硫酸钠;与工业碳化法比较,无需原料浓二氧化碳,不用耐压碳化塔;与电解法相比,电耗极少且成本低。
4)热压釜直接产出的酸化液杂质极少,不仅易于生产红矾钠,而且可以直接用来生产铬盐下游产品,如碱式硫酸铬、氧化铬、铬黄颜料。
5)由于降低了碱耗、用纯碱代替烧碱、反应产物提升为酸化液,可使炉料铬粉制得红矾钠的车间成本低于铬铁矿焙烧法,从而提高竞争力。
6)碳素铬铁用于冶炼含铬合金特别是不锈钢时,从电炉流出熔液冷凝的金属锭经破碎形成大量下脚料——碎粒细粉,对此多采取低价出售的处理方法,仅南非某铁合金厂每年的下脚料便达数十万吨,这些下脚料足够化工行业生产红矾钠。故碳素铬铁水热反应制红矾钠有良好的原料前景。
参考文献:
[1] 山崎仲道.铬铁矿水热浸出六价铬以及铬渣解毒[J].日本化学会志,1977(3):433-434.
[2] 山崎仲道.用水热法从矿物中提取有用元素[J].日本化学会志,1982(7):1147-1151.
[3] 山崎仲道.水热条件下自铬铁矿浸出六价铬的初始动力学[J].日本化学会志,1982(12):1903-1908.
[4] 山崎仲道.铬铁矿水热浸出渣中的γ-Fe2O3:日本,136130[P]. 1980-10-23.
[5] 梅海军,王劲松,宋卫国,等.铬酸盐的高效、节能、清洁的制造方法:中国,101508466[P].2009-08-19.
[6] 徐红彬,张懿,李佐虎,等.一种铬铁矿加压浸出清洁生产铬酸钠的方法:中国,101817561A[P].2010-09-01.
[7] Nobert L,Bernhard S,Hans-Dieter B,et al.Process for the
production ofsodium dichromate:US,5250274[P].1993-10-05.
联系方式:jz330410@sina.com
中图分类号:TQ131.12
文献标识码:A
文章编号:1006-4990(2012)02-0044-04
收稿日期:2011-11-14
作者简介:纪柱(1933— ),男,高工,从事物理化学、分析化学及化学工艺研究,主要研究铬化合物的反应机理和新工艺。发表专著、汇编、文章、译文等共计176件,曾获得国家发明三等奖、化工部科技进步三等奖、中国石油和化工科技进步一等奖。
Preparation of sodium bichromate dihydrateby hydrothermaloxidizing reaction
JiZhu
(CNOOCTianjin Chemical&Design Institute,Tianjin 300131,China)
Abstract:Based on hydrothermaloxidizing reaction ofhigh content carbon ferrochrome formanufacturing sodium chromate,the reaction product sodium chromate alkaline solution containing a small amount of free alkaliwas converted into sodium bichromate solution containing a small amount of sodium chromate,and meanwhile alkali consumption declined by 1/3,by taking full advantage of acidification and catalytic effectof carbon dioxide,and withoutadding equipmentand raw material. Soda can be used to replace caustic soda in the reaction.Experiment results showed thatsodium bichromate costof applying high content carbon ferrochrome powder hydrothermal oxidizing reaction promises to be less than that of high-temperature chromite roasting.
Keywords:hydrothermaloxidizing reaction;sodium bichromate dehydrate;soda
