复杂脑网络研究:现状与挑战
2012-03-22张方风郑志刚
张方风, 郑志刚
(1.北京物资学院信息学院,北京 101149;2.北京师范大学物理系,北京 100875)
科学发展到今天,我们清楚地认识到,自然界并非如牛顿所说的喜欢简单化,相反,现实世界中的多数系统具有复杂的相互关系和作用机制[1],其宏观行为出现了介于统计随机与规则之间的复杂性.自然界很多系统都是由高度相互作用的动力学系统构成的,获得系统的全局特性的一个方法就是将这些系统用网络模型进行分析,将动力学子系统作为节点,子系统之间的相互作用用边表示.网络模型是对实际系统的近似刻画,对实际系统进行合理的抽象与简化,忽略了子系统本身内部的结构等一些细节,这种近似虽然简单,但是在很多情况下仍然能够给出系统的很多重要性质.
1998年,美国康奈尔大学的Watts和Strogatz[2]发现具有与相应的随机网络相近的较小平均最短路径和较大集聚系数的网络——小世界网络.小世界特性的网络具有较高的局部效率和全局效率,网络在局部和全局都能非常有效地传递信息[3-4],使我们对于复杂系统中局部和整体的辩证关系有了新的认识.1999年,Albert和Barabási[5-6]分别在《Nature》和《Science》上发表的研究成果开创了以无标度网络为重点的复杂网络研究的新开端.这些研究结果的公布引起了国际学术界对复杂网络的广泛关注,在社会科学、自然科学以及工程技术等诸多领域得到了积极的反响.从20世纪末开始,对复杂网络的定量与定性特征的科学理解,已成为网络时代科学研究中一个极其重要的挑战性课题,甚至被称为“网络的新科学(new science of networks)”[7-8].
科学家们[9-13]在网络科学研究中累积了大量的研究结果,提出了许多新概念和新方法,其中与心理学、认知神经科学交叉的脑网络[14-18]研究已经形成了复杂网络研究的一个重要方向.研究结果表明,尽管不同系统之间存在着固有的区别,但是大多数的实际网络表现出了很多共同的拓扑结构特征,如小世界特性、无标度特性等.
1 大脑复杂网络研究
大脑是生命活动中最重要的器官之一.脑是人体内结构和功能最复杂的器官,它的平均重量只有1 360g左右,占人体总重量的2%,但所需能量却占人体总能量的20%.它的复杂程度是难以想象的,它的创造力、预见能力、抽象推理能力以及思维情感能力是人类至今都尚未透彻理解和难以模拟的.20世纪90年代被命名为“脑的十年”[19],21世纪被称为脑科学的世纪,探索和揭示脑的奥秘是当代自然科学家面临的重大挑战之一.
人脑大约有1011个神经元,每个神经元又有104的机会与其他神经元联系[20];人脑的发展经过了长时间的进化,可以在特殊的生态体系中保护个体,保证基因组的繁殖;人脑能够穿过聒噪、不稳定和不可预知的环境,在众多不同的形态中提取相对应的模式;构成人脑的神经系统是非线性的动力系统,而且是非静态的;神经元具有适应性、多稳态动力学的特性;可以说人脑或者神经系统是一个复杂适应性系统(CAS)[21]:不仅子系统数目多,而且其相互关系复杂,层次很多,对系统产生影响的外界环境通常也是不确定的.
最近十多年来,由于脑造影技术的进步,人们已在系统层次对大脑的连接及活动方面积累了非常多的有益数据.对于单个神经细胞而言,目前的研究主要集中于其离子通道的结构和功能方面.所用方法有分子生物学(重组DNA技术等)、神经电生理学(膜片括位技术)和药理学等方法.对于由少量神经细胞组成的局部小回路,目前的研究主要集中于突触的可塑性细胞间的相互关系,所用方法主要是分子生物学、神经电生理学和药理生理学等方法.对于大脑局部大回路和功能区的研究,目前主要集中于局部回路结构和功能发生障碍所导致的人或动物的精神性疾患,如帕金森氏病等.对于大脑整体功能的研究,所用方法与脑内局部大回路的研究方法类似,主要集中于认知、学习、记忆等高级功能的研究上.上面的研究方法也绝不是相互孤立的,例如脑的高级功能的研究也已经深入到细胞和分子水平,尤其是对学习和记忆的研究,这既需要行为方面的研究,也依赖于在记忆过程中分子事件的细致分析.
解剖学和生理学的研究已经证实皮层连接的一些基本特性:很大一部分皮层内的连接是局部的,连接几百毫米以内的神经元,通常反应特性很相近.另外一部分连接了较远的距离,连接了不同皮层区域的神经元,形成了区域之间的通道,保证了较远的皮层区域之间可以迅速的相互作用[22-24],这反映了大脑皮层连接的结构具有特殊的性质.
从大脑结构来看,经过亿万年的进化发展,人类大脑不仅被天然地分成左、右两半球,而且两半球还被一束庞大的联合纤维——胼胝体联结在一起,并且正常脑都有广泛的联系,没有任何部分神经系统功能是单独地而不与其他部分协同而活动的.即使对简单认知任务而言,也同时需要激活多个空间分离的脑功能区域,这些空间位置不同的大脑皮层区域,通过相互作用整合起来共同完成认知功能.在这些功能系统中不仅实现自底而顶的信息加工,同时还有顶底的控制与调节功能.很多试验和计算的研究一致认为:大脑皮层是由局部功能特异性的神经群组成,这些脑区的神经群在不同的认知活动下动态的相互作用并且形成不同的回路[25].相对于已有对于大脑集中于定位功能特异脑区、强调脑区定位认知功能,关注大脑区域与特定认知功能的关联,现在越来越多的研究者逐渐重视大脑不同脑区在完成认知功能之间的相互作用,将大脑作为整体进行功能整合来补充和修正功能定位的不足.
功能分化与功能整合是人脑功能的两大组织原则[26-27],大脑功能在广泛分布的局域功能特殊化和脑区间的相互作用之间,即功能的分离和整合之间,达到了很好的平衡.虽然人脑的不同区域具有相对不同的功能,但要完成一项哪怕是非常简单的任务时,也总是需要人脑多个不同的功能区域相互作用、互相协调,共同构成一个网络来发挥其功能,即大脑的功能执行总是依赖于多个脑区之间广泛地交互.神经解剖学和电生理的试验也得到了大量大脑在大尺度上的皮层间通道数据,但是对于大脑网络整体特性的量化和度量还是很初步的,要求发展新的计算方法来分析和研究大量的大脑连接信息.因此,从网络的角度来研究大脑的结构与功能是极为必要的.
研究脑,特别是在脑高级活动时,在实验上无损伤的实时测量和研究脑内发生的变化,主要有以下方法:
a.通过大脑结构的解剖图像获得静态信息.比如说广泛适用的CT(computerized X-ray tomography)和磁共振成像(MRI,magnetic resonance imaging).这类方法能够得到清晰的大脑结构图像,但不能用以了解脑的动态反应.
b.通过大脑对信息处理的反应而获得脑的动态信息.这类方法有脑电图(EEG,electroencephalography)和脑磁图(MEG,magnetoencephalograpy).这两种方法都可以达到亚毫秒的分辨率,因而可以对脑的活动做实时记录.但是由于成像技术的限制,空间分辨率不高.
c.通过大脑功能活动时的代谢活动图像而获得动态信息.比如功能磁共振成像(fMRI,functional magnetic resonance imaging)和正电子发射断层扫描(PET,positron emission tomography).这是通过了解大脑中血流、氧或糖的代谢,而获得脑的动态过程.
根据脑代谢功能成像(PET、单光子断层成像SPECT和fMRI)与生理功能成像(高分辨率EEG、事件相关脑电ERP和MEG等)的数据(图1中为磁共振成像数据),由每个信号源为一个节点(或可根据其他方法重构脑区),根据节点之间的数据信号统计分析建立之间的连接,从而建立大脑网络.
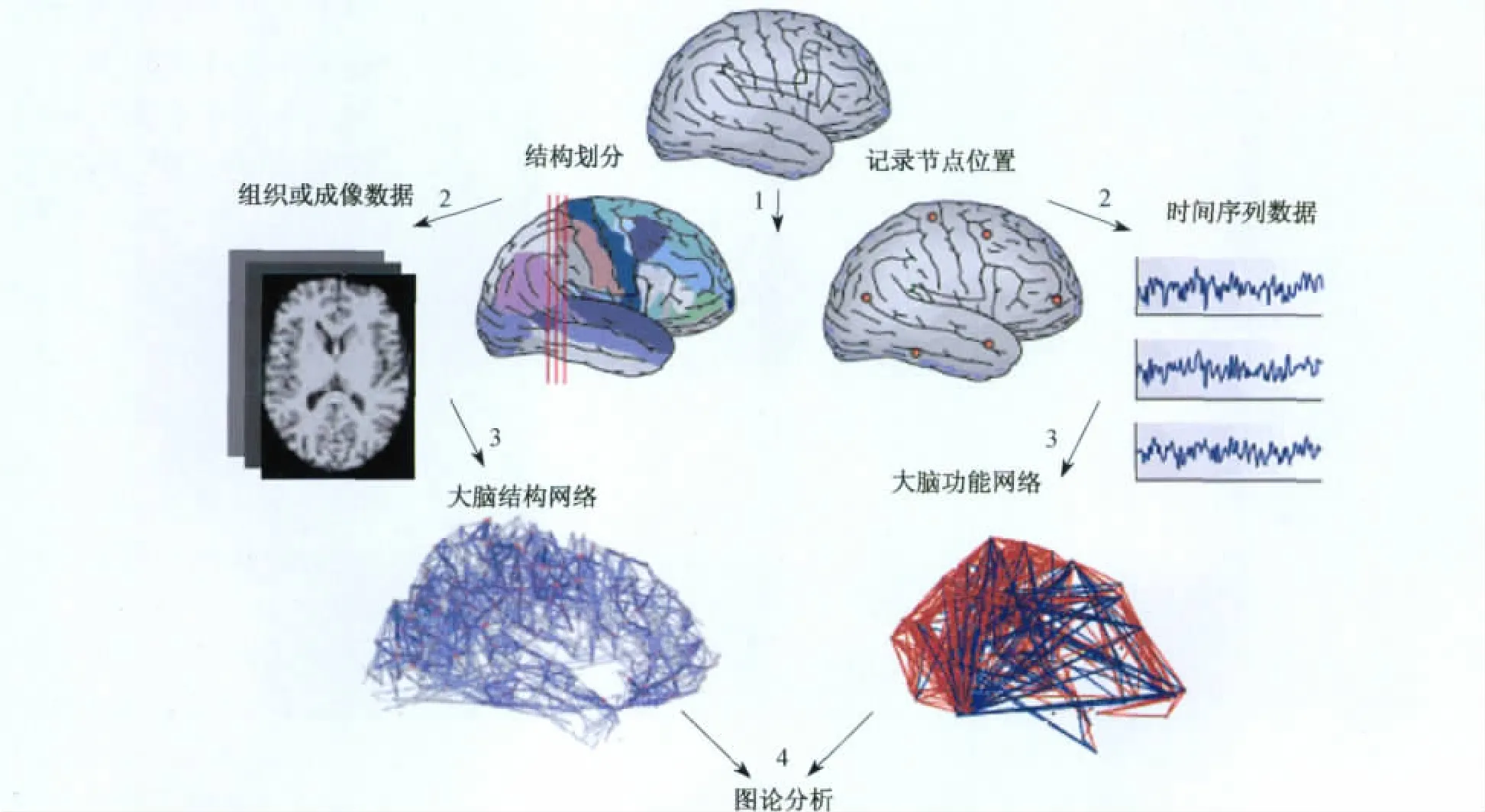
图1 大脑结构和功能网络构建流程[16]Fig.1 Constructs process of brain anatomical and functional networks[16]
文献通常提到三类连接:结构连接、功能连接和有效连接[28-30].结构连接是指描述2个大脑部位之间的物理连接[28].这种连接很难正式定义,因为神经元的连接可以由大脑可塑性调整.另外实验技术的不同造成了解剖学上连接的不同[31].为了得到神经系统连接的完整描述,需有全部信息(如:神经键感受器类型、抑制/活化中间神经元的比率).因此,我们离神经网络的完整解剖学描述还很远.
功能性连接通常定义为空间上较远的神经生理学事件之间在时间上的相关性[32].在微观层次上,神经元的功能性相互作用与它们脉冲串在空间传输的时间相干性(用互相关实验测量)有关[33].相反,已经利用脑电图、脑磁图、局部场电位(LFP)、功能磁共振成像、正电子发射断层扫描记录等数据评价了宏观层次功能相互作用[34-35].功能性连接统一定义的主要问题是记录的动态变化的空间和时间上的不同,由于大脑组织的容量传导,在一处记录的神经元活动反映了它附近所有邻居的动力学行为.
有效连接是一个更抽象的概念,一般定义为一个神经中枢系统通过直接或间接方式对其他系统可能发挥的影响[32].然而,这种连接并不明确反映解剖学连接,因为神经中枢位置及连接的不同排列可能导致同样的整体行为.功能性连接与有效性连接两者的主要问题是他们依赖于对相互作用的量化模型,或者依赖于实验的设计(每次实验产生的变化,主题不同产生的变化等)[28-30].
功能连接的研究通常考察大脑各区域的时间相关性,即脑区时间序列的相关或同步,其基本假定为功能上协同运作的脑区活动是相互关联的,所以其时间序列相关系数显著高于非关联脑区,如主成分分析(PCA)、独立成分分析(ICA)等.这种分析结果可以作为选择感兴趣区域(ROI,region of interest)的依据,但这种基于数据的相关分析的内在机制解释不清.在实验设计阶段进行几组不同任务条件,在不同参数水平下脑区之间的相关性随之变化,认为之间存在有效连接,使用基于一般线性模型(GLM)的心理生理交互作用模型(PPI,psychophysiological interactions)[36]或生理心理交互作用模型[37].对大脑连接的分析还有层次分析法[38],非度量多维定标(NMDS,non-metric multidimensional scaling)[39],非参数聚类分析[40],定量比较—Procreates旋转和近似随机化法[41],简单连接模型[42],最优集分析[43]等.
2 大脑结构网络研究
随着作为脑研究基础的分子和细胞神经生物学的近年来的快速发展,人们对大脑内部结构有了一定了解.了解到由胞体、树突和轴突组成的神经元是大脑的基本构成单位,是神经网络最基本的组成部分.
根据神经元的这些特点,科学家研究了能模拟其特性的人工神经元,按照层次结构的形式组织,每层上的神经元以加权方式与其它层的神经元连接,从而构成神经网络.通过对人工神经网络的研究,可以模拟与生物神经网络类似的活动,同时在对人工神经网络的活动和结构研究的基础上,还可以揭示出生物神经网络新的特点和属性.尽管人工神经网络的研究取得了一定进展,但人工神经网络远不能反映大脑的真实机制,尤其是大脑的一些高级认知功能的机制.人工神经网络的研究属于微观层次的研究,大脑功能是宏观表现,要实现微观层次的人工神经网络和宏观层次的大脑功能的完全解释,还有很长一段路要走.
尽管神经元和它们在大脑皮层的相互连接数量很大(大约1011个神经元和1014个神经键),大脑组织受资源配置最优和约束最小化规则支配,皮层区域的连通性将导致神经中枢点之间的互相连接成本最小,这样产生高效的通讯.在进化过程中,神经元的数量有大量的增加,而它们之间的直接连接变少.神经系统(即通过选择性的交互瞬时连接的神经元网络)形成了分布式网络,而网络非常稀疏.有迹象表明,人类大脑皮层是一个浓密的相互耦合皮层区的整体,全局连接形成一个大规模的皮层回路[44-54].然而,由于每个神经元的内在属性随时间变化(受与环境和与其他神经组相互作用影响驱动),神经元细胞动力学不断变化.这种可塑性使得神经元能根据计算和通讯需要不断改变连接或建立新的连接.因此神经元之间的交互作用变得高度动态.
线虫是理解整个神经系统的结构和功能之间关系的极好的实验系统.此系统的所有潜力来自于解剖学和电生理学数据两者的综合.线虫具有302个不同神经元组成的紧密的神经组织,它们之间的连接可以完全描画出来[55].另外,电生理学记录提供了新的线索来理解感觉神经元的电属性[56].
在哺乳动物的分离大脑区域层次,关于老鼠的海马趾系统连接,短尾猿与老鼠的皮层—皮层系统连接、老鼠的皮层—丘脑系统连接,都已经收集了详细的信息,神经解剖学上连接的大部分整体信息均可以被利用到大规模网络上.
在早期工作[38]中,通过手工分层分类的方法得到了灵长类动物视觉皮层的小连接矩阵(32个大脑区域和305个连接),目的是为了根据它们在皮质层起源和终止的模式将连接分类为上升的、递减的或横向的.这种分层分析需要有关分类方向的详细的先于解剖学的信息.分类方向用于将大脑区域放在分层图中的上、中、下等级,文献[57]得出了较为流行的方法.后来,又利用基于进化算法的计算机方法重新研究了这个分层图[58],目的是找到服从解剖学约束的最优层级.利用与模拟退火相似的算法,在与解剖学约束有关的成本函数下,估计、修改和选择了几个层次模型.这些方法的结果全面体现了视觉皮质区域是怎样组织在一起的.然而,精确的层次模型还没有确定.
对大脑连接的全面描述,已有研究利用比较层次模型和优化模型得到皮质层等级的有关组织区域[42].根据统计比较,发现了有关皮质层连接发展的简单有效机制(即大脑区域之间的连接强度与共同邻居数直接相关)[59-60].
最早应用网络方法研究哺乳动物皮层网络可以追溯到20世纪90年代,有些研究选择大脑某些区域的神经回路建立网络[41]、有些研究选择大脑某些神经元集团之间的连接建立网络[42].
1991年,Felleman和Essen[38]通过对先前文献中结构连接矩阵的分析总结,得出了猕猴视觉皮层32个区域305条轴突连接形成的神经网络.由此建立了一个比较稀疏的有向网络(密度为0.31),其中大多数连接是相互的.他们建立了10个层次的皮层结构连接,发现了若干相互分离的过程通路,这些通路彼此之间平行进行,仅通过少量连接使通路之间连接.后来研究发现他们所提到的通路就是现在广泛被人们接受的视觉神经腹侧和背侧通路,这一结果在后来Young等[39]的研究中也得到证实.
Young等[60]随后使用近似的方法研究了猕猴的结构连接矩阵.在猕猴的初级视皮层研究中,连接矩阵包含30个区域的301个连接,其中每个连接用0~2的数字量化其连接强度(0表示连接很弱或不存在连接),建立了一个30个节点的有向加权网络.研究得到结论:存在着2个彼此分离的通路,即腹侧通路和背侧通路;每个通路内部的组织结构都是层次结构;2个通路之间存在着一些共同节点;邻近的区域之间连接很紧密,而通过少量的连接也使距离较远的区域之间保持连通,即猕猴初级视皮层网络具有密集的局部集聚和少量的长程连接特性.Young等[61]又通过类似方法分析了猫的皮层网络,构建了由65个皮层区域以及皮层区域之间的1 139条连接形成的加权网络.分析得到了4个分离的集团,分别是视觉、听觉、躯体感觉运动区和额叶边缘区,集团内部存在紧密的连接,而集团之间连接比较稀疏.研究者利用规则网络模型对猫的皮层网络进行了模拟,但不论应用近邻连接,还是次近邻连接的规则,都不能很好模拟猫的皮层网络结果,这说明猫的皮层网络拓扑结构并不是规则网络.
Watts等[2]使用复杂网络方法研究神经系统,明确提出神经网络具有小世界特性.他们应用复杂网络的量化方法对C.elegans的神经网络进行研究,每个神经元为网络中的一个节点,突触连接作为网络的边,建立了一个由282个节点2 462条边所构成的有向网络,研究发现此网络的拓扑结构既不是随机网络也不是规则网络,而是一个小世界网络.随后,Hilgetag[62]和Sporns等[63]分别在自己的研究中,利用复杂网络方法对猕猴和猫的大脑皮层网络进行了重新量化分析,证实这些网络具备小世界特性.部分大脑结构网络统计特性与相同规模(节点和连接数相同)的随机网络比较如表1所示.
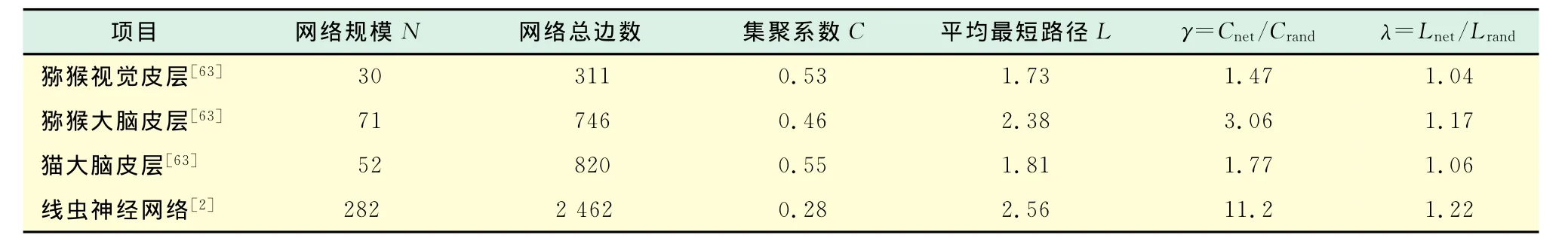
表1 部分大脑结构网络统计特性所示Tab.1 Statistical properties of parts of brain anatomical networks
He等[64]使用正常被试的结构MRI数据和皮层映射技术,由不同脑区皮层厚度的相关性建立了人脑的不同脑区之间的结构连接,分析了此皮层厚度的结构网络平均度、集聚系数和最短路径长度.对比了1 000个相应的随机网络,大脑皮层厚度网络拥有较高的集聚系数和较短的特征路径长度,具有小世界特性;度分布服从截断的幂率分布形式.此研究的贡献在于首次提出应用结构MRI数据构造大脑结构网络的方法:脑的形态学思想.He等[65]还分析了阿尔茨海默氏病患者与正常被试的大脑皮层厚度的结构网络差异,发现患病者大脑结构网络的小世界特性降低,核心脑区与介数较大的脑区位置发生了变化.Chen等[66]应用相同的方法构造了人脑皮层厚度网络对其划分的模块与认知功能有很好的对应(如语言、记忆等),通过对介数的分析得到重要节点主要分布在联合皮层区域,介数较大的边大多数连接不同功能模块的核心节点.Schmitt等[67]分析了具有遗传因素调控的人脑结构网络,仍旧验证了小世界特性,并公布了核心脑区位置.Lenroot等[68]分析了不同年龄组的大脑皮层厚度的结构网络,得到小世界特性对不同年龄的鲁棒性,同时得出随着大脑的发育(年龄的增长),大脑的集聚性和等级性都显著增大.以上结构MRI数据构造复杂网络模型的局限在于基于皮层厚度以脑区为节点的群体平均的大脑解剖网络,无法得到以体素(voxel)为节点的单个个体大脑结构网络.
弥散频谱成像(DSI,diffusion spectrum imaging)技术能够获得大脑中表征每个位置组织特性(尤其是纤维束的方向走行信息)的弥散函数,Mori等[69]利用弥散频谱成像追溯纤维束的走向重建了完整大脑纤维束,将大脑的灰白质交界面以及皮层下的核团边界分割为等面积的小的感兴趣分区作为网络节点,首次成功地构造了以纤维束作为连边的基于个体的大脑解剖网络,分析发现此网络具有小世界特性[70],计算网络的度、介数、效率等揭示了人脑重要的核心结构[71].但是由于数据采集时间较长,他们的研究只是在个体上的研究,较难推广到涉及海量数据的实际问题中.Ituria-Medina等[72]应用弥散加权MRI构造了加权大脑结构网络,验证了小世界特性,网络度分布为指数截尾的幂率分布,并指出了核心节点(hub)的位置.Gong等[73]利用弥散张量成像(DTI,diffusion tensor imaging)技术,通过白质纤维跟踪的方法,在正常人群中成功构建了无权的脑解剖网络,得到相同结果.Li等[74]对Gong等的方法进行改进,分析了个体的智力与其大脑解剖网络属性之间的关系.基于个体构建了无权脑解剖网络和以脑区之间的纤维连接数目作为权重的加权网络,分别计算了网络中边的总数、网络的平均集聚系数、网络的平均最短路径长度和网络的平均全局效率,验证了小世界特性.并且发现网络的效率与其智力评分显著相关,即智力评分越高,网络的边数越多,平均最短距离越短,平均全局效率越高;加权网络的相关性比无权网络更显著.随后,Gong等[75]研究了年龄和性别对大脑结构网络的影响,Yan等[76]分析了性别、脑体积及智力水平与大脑结构网络的关系.Cammoun等[77]采用DTI数据分析了精神分裂症被试与正常被试的的大脑结构连接网络拓扑特性的差异,发现患者被试的网络小世界属性与正常被试相比显著降低.Vaessen等[78]分析了癫痫患者的DTI数据,与正常被试相比,虽然癫痫患者的大脑结构网络也具有小世界属性,但其聚类系数与相应随机网络聚类系数的比值却显著增大.
近年来,在小世界行为框架内研究提出了大脑内各点之间连接最小化假设.事实上,一些物理模型支持这种使轴突长度和神经元所需能量最小的最优连接法则[79-81].
3 大脑功能网络研究
有证据显示[82-84]:功能性相互作用(与时间有关,不仅仅是神经系统的同时发生的激活)是所谓的大规模综合问题的基本机制.根据Friston在1994年对功能连接的定义[85],功能连接描述的是大脑的任意2个节点(根据使用数据的不同节点可以表示大脑的voxel、皮层区域等)在某一认知任务下的功能上的相关程度(相关程度的度量根据数据和采用方法的不同有不同的处理方式),表示的是时间相关的模式,通常表述为协方差矩阵或相关矩阵.功能连通性表现为脑皮层中不同神经模块之间完成认知任务时的协调反应机制.虽然这个定义是受方法学限制的操作性定义,但它描述了功能整合的最基本特征.功能连通性的假设是基于相关或者共变性,这类研究通常不需要先验知识的假设,而只是数据驱动的探索性分析.
大量的研究表明,在进行特定的任务或认知功能时,多重分布式皮层区域展示出一致的、时间精密的相互关系(相关或相干性).很多研究表明,功能连接的相关大脑活动或变化与认知心理学过程相关联,如:记忆编码和检索[86]、意识[87]等.功能连接的改变是特定知觉和认知状态的基础,包含了大脑区域之间的信息过程的整合[87],功能连接在知觉和认知任务中具有很大的重要性.
最早揭示功能连接小世界特性的是Stephan等人[88],他们利用侵入性的神经示踪法得到猴子的神经元连接数据建立功能网络,揭开了应用复杂网络研究大脑功能网络的序幕.Stam[89]利用5个健康被试在无任务条件下的脑磁图的数据,首先建立了人脑的功能网络,每一个通道作为一个节点,得到126个节点,计算在不同的频率范围(δ,θ,α,β,γ)内的任意2个通道之间的同步似然值(synchronization likelihood),当其值大于某一给定阈值时,定义2个节点之间有边连接,从而得到5个稀疏的无向网络.最后得出:在α和β波段集聚系数和平均最短路径近似于规则网络;其他波段集聚系数比规则网络略低(但仍比随机网络高很多),平均最短路径介于规则网络和随机网络之间.据此可以认为:在此试验条件下构建的大脑功能网络在α和β波段网络的拓扑结构近似于规则网络,而在其他波段即低频和高频波段网络具有小世界特性.2006年,Micheloyannis等[90]应用同样的方法分析了14个被试在工作记忆任务下的28个传感器的脑电图,得到了不同的结果:在所有频率范围内,大脑的功能网络都呈现小世界特性.之后,Micheloyannis等[91]分析了不同年龄的诱发脑电图数据,通过不同电极脑电信号的同步性建立功能连接,确定发育对大脑功能网络拓扑结构的影响,发现成年人高频波段的同步性和小世界特性的减弱.Bassett等[92]分析了不同被试不同任务的ERP数据,得到小世界特性的稳定性,但不同频率波段下大脑功能连接的细节特征如核心节点的位置不同.
Ferri等[93]采用了10名被试在睡眠任务下的19个通道的脑电图的数据,构建了一个19个节点的无向网络.他们的研究着重分析了脑电数据中在清醒和睡眠(包括慢波活动)的不同阶段,网络的拓扑结构特性及其区别.得到集聚系数在睡眠任务下均显著高于清醒任务,而睡眠的不同阶段未发现显著区别,睡眠情况下的集聚系数约是同等规模的随机网络的1.6倍.平均最短路径在所考察的不同阶段均未发现明显差异,与同等规模的随机网络的平均最短路径相近.说明在睡眠过程中脑电的慢波同步功能连接的网络结构呈现小世界特征.Dimitriadis等[94]也分析了睡眠不同阶段大脑功能网络拓扑结构的不同,得到了类似结果.
Bullmore小组的Salvador、Achard等[95-98]利用脑图谱(AAL)将整个大脑按照结构分成90个感兴趣的皮层和皮层下的脑区(每个半球45个),分别计算每2个脑区之间的相关、偏相关以及偏相干建立功能连接,进行了一系列的fMRI复杂网络分析.研究主要结果为:分析了网络集聚系数和平均最短路径,得出网络具有小世界特性;进行了功能连接矩阵的多元分析、层次聚类分析等,得到了与之前的大脑结构网络研究相同的结果,即视觉区、感觉运动区等脑区局域内部的紧密连接以及视觉的腹侧和背侧通路之间的少量连接;进行了fMRI的频率域分析,通过小波分析将频率从0.007~0.45Hz之间分成5个区间,根据每一个频率范围内的任意2个区域之间的相关建立边,从而建立了5个无向网络,分析结果显示这5个无向网络均具有小世界特性,尤其在0.03~0.06Hz波段,小世界特性更为突出.在此条件下得到的网络度分布不是指数分布,也不是无标度分布,而是指数删节的无标度分布(exponentially truncated power law)(即P(K)~Kα-1eK/Kc),表示网络中存在核心节点的可能性小于通常的无标度网络,但仍然比随机网络大很多.Meunier等[99]在静息态下建立了大脑功能网络,分析网络的模块结构,结果显示实际大脑具有很强的模块性,而且老龄化对模块结构和模块内部节点作用有显著影响.He等[100]、Laurienti等[101]应用了类似的方法进行了静息态下大脑功能网络的模块化结构的深入细致分析.以上由fMRI数据建立功能网络均是利用脑图谱将整个大脑按照结构分成若干较大的脑区作为节点,大大简化了网络规模,但是受先验图谱不同分区有所不同,并且无法揭示脑区内部的联系.
2005年,Chialvo[102]和Eguíluz等[103]首次以体素为节点,基于特定任务下的fMRI根据体素之间的简单线性相关建立大脑功能连接.当任意2个体元脑区活动的时间序列之间的简单线性相关大于某一给定的阈值时,认为2个节点间存在边的连接,从而可以得到不同阈值条件下的大脑功能网络.通过分析,不同阈值情况下得到的网络均具有小世界的特性(阈值大于0.8更加显著).并且网络度分布是幂率分布(power law)(即P(K)~K-α),这表示网络中存在具有很多的边连接的节点,即核心节点.笔者在不同认知任务下的大脑功能网络研究[104-107]中也得到了类似结论,并给出了不同认知任务下网络结构的差别(如核心节点位置、鲁棒性等).Heuvel等[108]的研究揭示了智力水平与静息态下大脑功能网络的平均最短距离的负相关性.部分典型的大脑功能网络统计特性如表2所示.
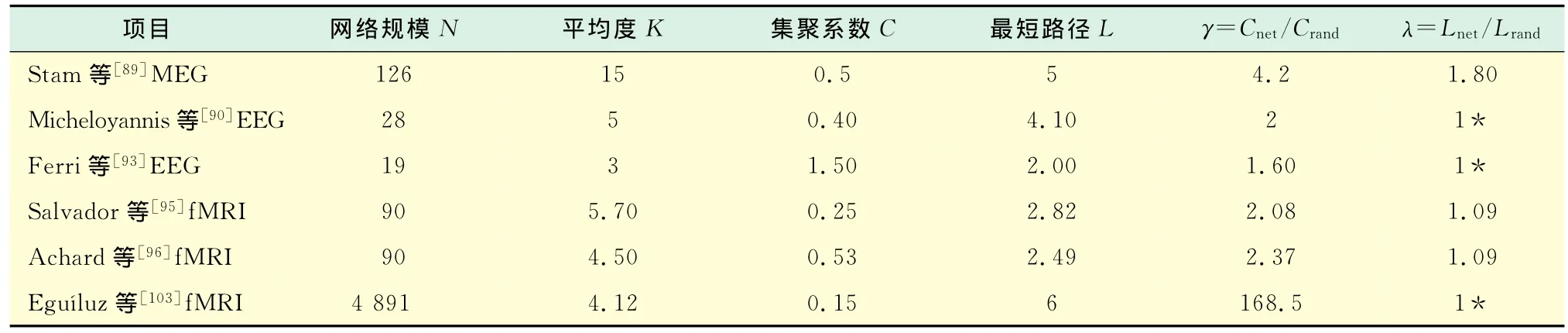
表2 部分典型大脑功能网络统计特性(其中*为近似值)Tab.2 Statistical properties of parts of brain functional networks
许多研究者研究功能网络与疾病之间的关系.Micheloyannis等[109]借助脑电图发现精神分裂症患者在静息状态和工作记忆任务下脑功能网络局部集聚系数相对于正常人都降低,而平均最短路径长度只在静息状态下显著增加.Pachou等[110]分析了记忆任务下精神分裂患者与正常被试功能连接的差异.Rubinov等[111]的研究均表明精神分裂症患者的大脑功能网络的小世界特性不明显,网络拓扑结构更接近随机网络,验证了Micheloyannis等的结果.Stam等[112-113]分析了脑磁图的大脑功能网络,发现阿尔茨海默病患者平均最短路径长度相对于正常人显著增加,提示了患者神经网络组织效率降低.Buckner等[114]和Supekar等[115]从集聚系数与核心节点的角度分析了静息态fMRI阿尔茨海默病患者与正常人的大脑功能连接的不同,Supekar等[115]研究能够以较大的准确率区分患者与健康人.Ponten等[116]发现癫痫患者功能网络结构在发作期向规则网偏移,在间歇期向随机网偏移.蔡世民等[117]通过对脑电信号(EEG)基于相点距离集合的算法将脑电的时间序列确定嵌入维数重构了其相空间,利用相空间的矢量空间距离得出矢量之间的紧密程度,用回归图描述相空间的回归状态,将得到的回归矩阵进行变换得到复杂网络的连接矩阵进行分析;分析了癫痫患者在癫痫活动和非活动期,平均度值、集聚系数和平均最短距离的特征差异,验证了大脑网络的小世界特性.Fallani等[118]发现脊髓损伤患者运动网络局部效率增加.Bartolomei等[119]发现脑瘤患者静息脑功能网络全局和局部连接特性都降低,从而提示了脑瘤患者功能网络向随机网偏移.王亮等[120]所在研究组基于静息态fMRI借助小世界模型,研究注意缺陷多动障碍儿童功能网络的拓扑特性,发现患病儿童功能网络认知加工效率与正常人相比有所下降,网路结构向规则网络偏移,而且额叶纹状体通路部分节点加工效率出现异常[121].方小玲等[122]验证了酒精成瘾症患者的各项复杂网络特征指数与正常人相比有明显不同,定义了大脑神经网络信息熵及神经网络标准信息熵的概念,发现脑病患者的大脑神经网络信息熵明显小于正常人.
已有的大脑功能网络分析大多数具有小世界特性,这点并非偶然.很多研究结果已经建议具有小世界特性的网络结构是不同脑区神经活动同步的最优选择[123],是大脑功能的两大组织原则——功能分化与功能整合的信息交换属性的集中体现[124],是大脑对刺激信号的自适应结果.大脑的这种特性有利于在多个系统之间实时高效地传递信息[124-126]、方便有效地处理外界刺激信息[96],使得不同功能分区之间的信息交互能够高效运行[97].
4 大脑结构与功能的联系
结构和功能是复杂网络研究的主要核心问题.对复杂网络结构与功能之间关系的研究,目前主要集中在考察相同的动力学过程在不同结构的网络上是否表现出不同的特性.大脑皮层的结构连接与功能连接间相互关联,相互制约[127-132].结构连接限制功能连接,而功能连接的相互作用又改变结构连接[133-134].
文献[44-45]早期工作的分析指出了神经元组织与神经中枢功能之间的相互作用,强调了神经系统连接结构与大脑功能有关.Lago-Fernández等[135]将复杂网络中的节点视作神经元,每个节点的动力学过程满足Hodgkin-Huxley(HH)方程.他们考察了这个动力学过程在随机、规则以及小世界网络上表现出的特性,发现在随机网上能够产生快速响应,但是不能产生持续震荡;在规则网上能产生持续震荡,但是不能产生快速响应;而在处于随机网和规则网之间的小世界网上,则既能快速响应,又能产生持续震荡.因此,他们的工作从网络是否能快速响应并产生持续震荡这个角度,证明了网络结构与功能之间存在关系.利用建立在元胞自动机基础上的神经网络模型,可以看到活动在实际脑皮层拓扑结构中比在规则网或等价的随机连接网中传播得要好[136].利用HH神经元网络[137],通过随机连接方法[136]得到快速但不一致振荡反应.另一方面,规则拓扑结构显示一致振荡,但是在低的时间尺度范围,这可能成为神经元信息处理的障碍.这些行为与能产生快速一致振荡反应的小世界属性形成对比.利用FitzHugh-Nagumo(FN)神经元网络[138-139],发现一致振动频率受网络拓扑结构高度调控[135].与HH模型相比,FN模型的传播速度并不依赖于连接结构,发现网络拓扑结构在其他神经系统的集体现象(如随机共振[140]或一致共振[141])中起关键作用.对一定的耦合强度和噪音水平来说,改进激发响应一致性可以通过增加网络连接的随机性和神经元参数的小的异质性而得到[142-144].
Zhou等[145-147]作了一系列大脑结构网络与动力学行为的研究,通过研究猫的皮层连接的真实结构网络上的同步动力学探讨结构和功能之间的关系,将脑区定义为具有动力学行为的强耦合振子,其同步性完全由网络中节点密度决定,而振子之间的耦合强度较弱时,结构对同步的影响则不同.
Honey等[148]研究猕猴的皮层结构网络研究结构和功能之间的联系,发现2个网络连接之间有很大程度的重叠.Greicius等[149]结合fMRI和DSI两种成像探讨结构与功能的相关时也验证了这一点.Park等[150]的研究揭示了功能网络与结构网络在拓扑性质上尤其是全局和局部效率以及度的匹配性存在差异.Honey等[151]在研究静息态成像数据同时分析结构和功能网络时,发现功能连接的强度、持续时间和空间分布受到结构网络的约束与限制.
另一方面,为了更深刻地理解复杂系统内部的工作方式和机理,研究复杂网络的演化机制及模型,来揭示实际系统的演化机制就非常有意义.正如Barabási所言,“无标度特性的意义之一在于认识到网络系统的结构和演化是不可分割的”[6],“为了解释系统的拓扑结构,我们必须得首先描述拓扑结构是如何产生的.”[152]
有研究发现神经突触连接强度也与空间联系有关,即强连接比弱连接在空间上更聚集,形成强连接框架[153].为了处理此问题,研究者提出了基于空间约束的空间增长算法进行大脑网络的演化模拟.Kaiser等[154-155]建立空间演化网络模型的过程如下:网络初始时,在二维空间的特定位置建立一个或2个节点;然后每一步向此二维空间的任意位置随机加入一个新节点,新节点与老节点之间连边的概率与两节点之间的空间距离有关:随距离的增加指数衰减或幂率衰减如果新节点没能与老节点建立连接,则新节点从网络中移除.这样一个程序将产生替代网络,分析得到:该网络的平均最短路径和集聚系数与实际的猫和猕猴的皮层连接类似,最终得到模型的结果在其他方面也与实际的猫和猕猴的大脑结构网络结果拟合得很好.另一种不同方法中,猫的脑皮层连接强度的有关信息转换成概率生成函数,然后利用函数来产生具有不同连接方案(局域的、长程的或两者混合)的替代连接矩阵[124].与空间增长算法相同,这种概率程序产生的图与脑皮层网络有相似的拓扑结构,但规模可以任意.笔者[156-157]根据实证过程中大脑功能网络度分布与空间距离的结果,在三维的大脑模板上进行了演化模型的尝试,在一定条件下重现了的大脑网络的小世界特性和无标度性质.
毋庸置疑,大脑在其演化历史、结构、功能和脑神经元的编码方式上都具有相当的复杂性.现阶段,人们对于少数几个神经元的动力学特征已经有了一定的了解,在脑神经元放电的时间编码方式及其相互之间的响应机制等方面的研究也已获得初步的进展.然而,大脑包含了诸多动态和精神的因素,具有非常丰富的信息含量,所以它作为一个独特的复杂适应性系统仍旧是难以分析的.但是,通过复杂性科学的研究,借助于复杂网络理论和一些相关概念,我们至少可以认识到大脑中复杂性的部分特点,并对于脑的记忆和学习、创造性思维的出现、意识流的形成等问题,实现了数理上的、具备一定科学性的探索.
5 结 论
到目前为止,复杂网络的研究状况仍然还是经验研究多于理论研究,计算机数值模拟方法多于数学分析,而且目前所提出的网络模型也只能控制一或2个拓扑特征量.对于大脑网络的结构和机理的探究方兴未艾,远未穷尽.
在探索未知网络结构时,复杂网络的拓扑结构如同一个黑匣子,我们只能通过网络的输出信息,得到拓扑结构的未知参数,重构系统结构.如何从海量的数据中构建出与实际系统更加符合的网络连接,建立符合实际系统工作机制的网络模型,是未来研究的很重要的一个方向.
Barabási[152]曾提出,“哺乳动物大脑的神经层次的结构仍然有待进一步的研究”,并指出发展的方向:“需要同时进行数据和模型的研究”.利用大规模的数据集合可以有利于识别网络中的统计规律,Schweitzer等[158]在研究经济网络就曾经提到“获得越多越好的数据,有利于从定性研究到定量研究的转变”.如何从大脑检测数据重构贴近实际、更为合理的复杂网络模型是一个重要的研究课题.
大脑影像数据在时间和空间上的特性是不同的,如给定的数据集是反映个体神经元活动、神经系统动力学,还是其他宏观(电、磁、血液动力学/代谢作用)大脑活动.由于PET成像速度以min为单位,只能对认知活动脑功能进行积分成像.fMRI虽可做到0.11s的时间分辨率;但对于某些瞬时变化的认知功能仍不得不借助减法法则和一致性分析的方法.对于精细而复杂的脑认知功能而言,目前脑功能成像技术仍是十分粗糙的工具,无论时间和空间分辨率都有待进一步提高.脑代谢功能成像(PET、SPECT和fMRI)与生理功能成像(高分辨率EEG、ERP和MEG等)综合运用的技术路线是一个较好的选择,这是由于前者空间分辨力高而后者时间分辨力高,取各自所长,可以较好地观察认知活动中脑功能的时空动态变化规律.由于fMRI等脑代谢成像的实验室环境和条件限制,目前所说的两类脑成像结合与互补,都不是同一时间同一场合的实时比较与对照.在时间和环境上不同的两类成像比较中,必然失掉某些重要特性.不管怎样,各种无损伤的脑成像技术的飞速发展为心理学、认知科学、神经科学的结合研究提供了很好的机遇和手段,为脑信息获取与处理方法的研究、为脑的高级认知功能的研究提供了一个广阔的空间.在重构网络模型时如何合理科学地进行数据挖掘是研究大脑网络的一个挑战.脑科学发展有一个显著特点,即对脑的研究很大程度上依赖于技术的发展和完善.分子生物学方法、神经电生物学方法、神经系统成像方法以及其它方法的联合应用是目前脑科学研究的最新趋势.因此,只是靠复杂网络对大脑研究有其局限性,必须和心理学、认知神经科学自身的生理规律相结合,与实验研究及各种新技术相结合,探索前进.
如何由数据挖掘的功能连接反映真实大脑的连通性.例如,由脑白质纤维素清楚连接的2个区域将展现高度的功能性连接,反之,则不一定成立.另外,构建网络连接很大程度受到研究者所采用的统计方法和识别技术的约束和限制.例如,利用功能相互关系来评价大脑连通模式可能存在一些障碍.首先,结果可能依赖于所用的相关性方法.神经振荡器本质上讲是复杂非线性系统,因此它们的相互作用也表现为非线性特征.因此需要适当的统计方法处理嵌入在时间序列内的可能的非线性特征.其次,功能性相互作用强烈依赖于时间,相关性方法需要抓住相互作用中的波动.例如功能性连接可能受局部强度影响而产生强烈偏倚(导致2个空间相邻的点显示正的偏相关).另外,大脑区域之间的功能性连接对低频(<0.1Hz)或生理学噪音源(如呼吸和心脏活动)很敏感.因此,为了评价大脑连接的复杂拓扑结构,构建网络连接时必须进行仔细的统计学研究.
以往的研究大多基于相互关系的连接模式得到无向无权图.而实际网络内的相互作用有时不是持续发生的,有的是在一定条件下才能出现的,建立无向无权的网络连接容易忽视这种条件限制.并且建立无向无权网络时需要人为给定相互作用的阈值,然而阈值的选取并没有定量或统计学上的检验优劣的标准,而阈值的不同对网络的拓扑结构特性有一定的影响,如Onnela等[159]研究的C.elegans的神经网络考虑神经连接强度使用不同的阈值会生成结构参数不同的网络.Faust等[160]指出阈值不同对网络性质的影响可能与选取阈值时导致的选择性断边有关,也可能是阈值不同引起网络密度改变间接导致的.
应用神经成像研究脑功能连通性的一个主要局限性是很难得出清楚的因果推论,因为远距神经系统的神经生理事件之间的时间相关(功能连接),可能并不是由一个神经系统对另一个神经系统的影响(有效连接)导致.因此,描述神经系统事件因果关系的有效连接,建立有向加权的大脑网络展示神经网络的新的拓扑属性,是未来大脑网络研究的发展方向.
认知神经科学强调多学科、多层次、多水平的交叉,研究的层次包括分子、突触、神经元、脑区、脑区回路、全脑及整体行为乃至环境、社会等;要确定和分析大脑在时间尺度和空间尺度的不同层次之间的关系以及系统复杂性的涌现机制,对人脑认知功能及其神经机制进行多层次、跨学科的综合研究已经成为当代科学发展的主流方向之一.
在复杂网络的应用领域中,目前大多数研究还停留于真实网络系统的结构分析和定性讨论,而真实网络系统中出现的一些复杂现象(如自组织临界性)的成因还缺少研究.此外,对于真实网络系统中的动力学过程的控制研究也有待加强.尽管生物网络作为复杂网络的一大类型已经累积了相当多的研究结果,从对网络的分析也揭示了大脑一些基本结构与动力学特征,但对大脑网络的研究仍处于起步阶段.网络中许多指标的实际生理意义是一直以来困扰我们的问题之一[152].如何分析理解大脑数据,从而获得对大脑大规模的复杂结构、动态活动及认知功能之间的关系,必将是未来研究大脑的新方向.
应用网络科学所分析的大脑网络结构拓扑特征有哪些生理学、心理学、认知神经科学的含义,是脑科学所关心的问题,否则数学家、物理学家对大脑数据的网络分析就成了自说自话.大量研究分析患病者与正常被试的大脑网络拓扑结构、统计参数上存在差异,给疾病的诊断提出了一个新的途径,有望取得长足发展,大脑网络的研究也必然会对心理学、认知神经科学、病理学等带来重要影响,但网络科学的研究结论离真正作为临床诊断还有很长的距离.首先,网络科学对此的研究结论多为定性结果;其次,不同研究者采用不同的实验数据以及不同重构连边的技术手段,可以得到不完全一致甚至矛盾的结果,所以网络科学真正对生理学、心理学和认知神经科学的研究做出贡献,就要加强和加深复杂网络理论的研究,包括网络拓扑结构和动力学行为,探索和深化对网络参量和新的统计规律的研究,进行严格的理论推理,从定性转移到定量研究,从网络科学的角度给出认知活动的判定依据和可靠有效的疾病诊断标志.
复杂网络的研究既方兴未艾,又在迅速发展.因此,许多的理论和方法还在探索与发展之中.目前关于复杂脑网络的研究刚刚起步,复杂网络的分析手段有待进一步扩展,寻找更加适用于人脑功能特点的有效分析方法是未来的研究方向.未来随着大脑海量数据不同角度、不同维度的数据分析,对大脑多角度、多层次的分析,对认知任务、疾病和遗传等问题的大脑机制,势必会有更全面的认识.
[1] 谭璐,姜璐.系统科学导论[M].北京:北京师范大学出版社,2009.
[2] Watts D J,Strogatz S H.Collective dynamics of“smallworld”networks[J].Nature,1998,393(6684):440-442.
[3] Latora V,Marchiori M.Efficient behavior of small-world networks[J].Phys Rev Lett,2001,87(19):198701.
[4] Latora V,Marchiori M.Economic small-world behavior in weighted networks[J].Eur Phys J B,2003,32(2):249-263.
[5] Albert R,Jeong H,Barabási A L.Diameter of the world wide web[J].Nature,1999,401(6749):130-131.
[6] Barabási A L,Albert R.Emergence of scaling in random networks[J].Science,1999,286(5439):509-512.
[7] Barabási A L.Linked:the new science of networks[M].Massachusetts:Persus Publishing,2002.
[8] Watts D J.The“new”science of networks[J].Annual Review of sociology,2004,30:243-270.
[9] Newman M E J.The structure and function of complex networks[J].SIAM Rev,2003,45(2):167-256.
[10] Bornholdt S,Schuster H G.Handbook of graphs and networks:from the genome to the internet[M].Germany:Wiley-VCH,2003.
[11] Pastor-Satorras R,Vespignani A.Evolution and structure of the internet:a statistical physics spproach[M].Cambridge:Cambridge University Press,2004.
[12] Pastor-Satorras R,Miguel R,Diaz-Guilera A.Statistical mechanics of complex networks[M].Springer:Berlin,2003.
[13] Ben-Naim E,Frauenfelder H,Toroczkai Z.Complex Networks[M].Springer:Berlin,2004.
[14] Rubinov M,Sporns O.Complex network measures of brain connectivity:uses and interpretations[J].NeuroImage,2010,52(3):1059-1069.
[15] Bassett D S,Bullmore E T.Human brain networks in health and disease[J].Curr Opin Neurol,2009,22(4):340-347.
[16] Bullmore E,Sporns O.Complex brain networks:graph theoretical analysis of structural and functional systems[J].Nat Rev Neurosci,2009,10(3):186-198.
[17] 梁夏,王金辉,贺永.人脑连接组研究:脑结构网络和脑功能网络[J],科学通报,2010,55(16):1565-1583.
[18] 蒋田仔,刘勇,李永辉.脑网络:从脑结构到脑功能[J],生命科学,2009,21(2):181-189.
[19] 梅镇彤.学习和记忆的神经生物学[M].上海:上海科技教育出版社,1997.
[20] 赫尔曼哈肯.大脑工作原理[M].郭治安,吕翎译.上海:上海科学技术出版社,2000.
[21] Koch C,Laurent G.Complexity and the nervous system[J].Science,1999,284(5411):96-98.
[22] Braitenberg V,Schüz A.Cortex:statistics and geometry of neuronal connectivity[M].Berlin:Springer,1998.
[23] Nicoll A,Blakemore C.Patterns of local connectivity in the neocortex[J].Neural Computation,1993,5(5):665-680.
[24] Varela F,Lachaux J P,Rodriguez E,et al.The brainweb:phase synchronization and large-scale integration[J].Nature Reviews Neuroscience,2001,2:229-239.
[25] Sporns O,Tononi G,Edelman G M.Theoretical neuroanatomy:relating anatomical and functional connectivity in graphs and cortical connection matrices[J].Cerebral Cortex Feb,2000,10(2):127-141.
[26] Friston K.Beyond phrenology:what can neuroimaging tell us about distributed circuitry?[J].Annu Rev Neurosci,2002,25:221-250.
[27] Friston K.Functional integration and inference in the brain[J].Prog Neurobiol,2002,68(2):113-143.
[28] Lee L,Harrison L M,Mechelli A.The functional brain connectivity workshop:report and commentary[J].Network:Computation in Neural Systems,2003,14(2):1-15.
[29] Horwitz B.The elusive concept of brain connectivity[J].Neuroimage,2003,19(2):466-470.
[30] Fingelkurts A A,Kähkönen S,Functional connectivity in the brain—is it an elusive concept?[J].Neurosci Behav Rev,2005,28(8):827-836.
[31] Scannell J W,Grant S,Payne B R,et al.On variability in the density of corticocortical and thalamocortical connections[J].Phil Trans R Soc Lond B,2000,355(1393):21-35.
[32] Friston K J,Holmes A P,Worsley K J,et al.Statistical parametric maps in functional imaging:a general linear approach[J].Human Brain Mapping,1994,2(4):189-210.
[33] Habib M K,Gerstein G L,Habib M K,et al.Dynamics of neuronal firing correlation:modulation of"effective connectivity"[J].J Neurophysiol,1989,61(5):900-917.
[34] Büchel C,Coull J T,Friston K J.The predictive value of changes in effective connectivity for human learning[J].Science,1999,283(5407):1538-1541.
[35] Kujala J,Gross J,Salmelin R.Localization of correlated network activity at the cortical level with MEG[J].NeuroImage,2008,39(4):1706-1720.
[36] Friston K J.Psychophysiological and modulatory interactions in neuroimaging[J].NeuroImage,1997,6(3):218-229.
[37] Stamatakis E A,Marslen-Wilson W D,Tyler L K,et al.Cingulate control of fronto-temporal integration reflects linguistic demands:a three-way interaction in functional connectivity.NeuroImage,2005,28(1):115-121.
[38] Felleman D J,Essen D C.Distributed hierarchical processing in the primate cerebral cortex[J].Cerebral Cortex,1991,1(1):1-47.
[39] Young M P,Scannell J W,O’Neill M A,et al.Nonmetric multidimensional scaling in the analysis of neuroanatomical connection data and the organization of the primate cortical visual system[J].Phil Trans R Soc Lond B,1995,348(1325):281-308.
[40] Burns G A P C,Young M P.Analysis of the connectional organization of neural systems associated with the hippocampus in rats[J].Phil Trans R Soc Lond B,2000,355(1393):55-70.
[41] Young M P,Scannell J W,Burns G A P C,et al.Analysis of connectivity:neural systems in the cerebral cortex[J].Review in the Neurosciences,1994,5(3):227-250.
[42] Scannell J W,Blakemore C,Young M P.Analysis of connectivity in the cat cerebral cortex[J].The Journal of Neuroscience,1995,15(2):1463-1483.
[43] Young M P,Scannell J W.Brain structure-function relationships:advances from neuroinformatics[J].Phil Trans R Soc Lond B,2000,355(1393):3-6.
[44] Sotelo C.Viewing the brain through the master hand of Ramóny Cajal[J].Nat Rev Neurosci,2003,4(1):71-77.
[45] Llinás R R.The contribution of Santiago Ramóny Cajal to functional neuroscience[J].Nat Rev Neurosci,2003,4(1):77-80.
[46] Varela F,Lachaux J P,Rodriguez E,et al.The brain web:phase synchronization and large-scale integration[J].Nat Rev Neurosci,2001,2(4):229-239.
[47] Koch C,Laurent G.Complexity and the nervous system[J].Science,1999,284(5411):96-98
[48] Schüz A.Neuroanatomy in a computational perspective[M]//Arbib M A.Handbook of brain theory and neural networks.MA:MIT Press Cambridge,1995.
[49] Cherniak C.Neural component placement[J].Trends in Neuroscience,1995,18(12):522-527.
[50] Kötter R,Sommer F T.Global relationship between structural connectivity and activity propagation in the cerebral cortex[J].Phil Trans R Soc Lond B,2000,355(1393):127-134.
[51] Klyachko V A,Stevens C F.Connectivity optimization and the positioning of cortical areas[J].Proc Natl Acad Sci USA,2003,100(13):7937-7941.
[52] Cherniak C,Mokhtarzada Z,Rodriguez-Esteban R,et al.Global optimization of cerebral cortex layout[J].Proc Natl Acad Sci USA,2004,101(4):1081-1086.
[53] Chklovskii D B,Koulakov A A.Maps in the brain:what can we learn from them?[J].Ann Rev B Neurosci,2004,27:369-392.
[54] Schnitzler A,Gross J.Normal and pathological oscillatory communication in the brain[J].Nat Rev Neurosci,2005,6(4):285-296.
[55] White J G,Southgate E,Thomson J N,et al.The structure of the ventral nerve cord of caenorhabditis elegans[J].Phil Trans R Soc Lond B,1976,275(983):327-348.
[56] Goodman M B,Hall D H,Avery L,et al.Active currents regulate sensitivity and dynamic range in C.elegans neurons[J].Neuron,1998,20(4):763-772.
[57] Ress G,Kreiman G,Koch C.Neural correlates of consciousness in humans[J].Nat Rev Neurosci,2002,3(4):261-270.
[58] Hilgetag C C,O’Neill M A,Young M P.Indeterminate organization of the visual system[J].Science,1996,271(5250):776-777.
[59] Scannell J W,Burns G A P C,Hilgetag C C,et al.The connectional organization of the cortico-thalamic system of the cat[J].Cerebral Cortex,1999,9(3):277-299.
[60] Young M P.Objective analysis of the topological organization of the primate cortical visual system[J].Nature,1992,358(6382):152-155.
[61] Young M P.The organization of neural systems in the primate cerebral cortex[J].Proc R Soc Lond B,1993,252(1333):13-8.
[62] Hilgetag C C,Burns G A P C,O’Neill M A,et al.Anatomical connectivity defines the organization of clusters of cortical areas in the macaque and the cat[J].Phil Trans R Soc Lond B,2000,355(1393):91-110.
[63] Sporns O,Zwi J D.The small world of the cerebral cortex[J].Neuroinformatics,2004,2(2):145-162.
[64] He Y,Chen Z J,Evans A C.Small-world anatomical networks in the human brain revealed by cortical thickness from MRI[J].Cereb Cortex,2007,17(10):2407-2419.
[65] He Y,Chen Z,Evans A C.Structural insights into aberrant topological patterns of large-scale cortical networks in Alzheimer’s disease[J].J Neurosci,2008,28(18):4756-4766.
[66] Chen Z J,He Y,Rosa-Neto P,et al.Revealing modular architecture of human brain structural networks by using cortical thickness from MRI[J].Cereb Cortex,2008,18(10):2374-2381.
[67] Schmitt J E,Lenroot R K,Wallace G L,et al.Identification of genetically mediated cortical networks:a multivariate study of pediatric twins and siblings[J].Cereb Cortex,2008,18(8):1737-1747.
[68] Lenroot R K,Bassett D S,Clasen L S,et al.Developmental changes in topographic properties of anatomical networks in children and adolescents[J].NeuroImage,2009,47(Supplement 1):S175.
[69] Mori S,van Zijl P C.Fiber tracking:principles and strategies—a technical review[J].NMR Biomed,2002,15(7/8):468-480.
[70] Hagmann P,Kurant M,Gigandet X,et al.Mapping human whole-brain structural networks with diffusion MRI[J].PLoS ONE,2007,2(7):e597.
[71] Hagmann P,Cammoun L,Gigandet X,et al.Mapping the structural core of human cerebral cortex[J].PLoS Biol,2008,6(7):e159.
[72] Iturria-Medina Y,Sotero R C,Canales-Rodriguez E J,et al.Studying the human brain anatomical network via diffusion-weighted MRI and graph theory[J].Neuroimage,2008,40(3):1064-1076.
[73] Gong G,He Y,Concha L,et al.Mapping anatomical connectivity patterns of human cerebral cortex using in vivo diffusion tensor imaging tractography[J].Cereb Cortex,2008,19(3):524-536.
[74] Li Y,Liu Y,Li J,et al.Brain anatomical network and intelligence[J].PLoS Comput Biol,2009,5(5):e1000395.
[75] Gong G,Rosa-Neto P,Carbonell F,et al.Age-and gender-related differences in the cortical anatomical network[J].J Neurosci,2009,29(50):15684-15693.
[76] Yan C G,Gong G L,Wang J H,et al.Anatomical connectivity patterns of human cerebral cortex are associated with brain size,sex and intelligence[J].NeuroImage,2009,47(Supplement 1):S128.
[77] Cammoun L,Gigandet X,Sporns O,et al.Connectome alterations in schizophrenia[J].NeuroImage,2009,47(Supplement 1):S157.
[78] Vaessen M J,Jansen J F,Hofman P A,et al.Impaired small-world structural brain networks in chronic epilepsy[J].NeuroImage,2009,47(Supplement 1):S113.
[79] Cherniak C,Changizi M,Kang D W.Large-scale optimization of neuron arbors[J].Phys Rev E,1999,59(5):6001-6009.
[80] Karbowski J.Optimal wiring principle and plateaus in the degree of separation for cortical neurons[J].Phys Rev Lett,2001,86(16):3674-3677.
[81] Chklovskii D B,Schikorski T,Stevens C F.Wiring optimization in cortical circuits[J].Neuron,2002,34(3):341-347.
[82] Destexhe A,Marder E.Plasticity in single neuron and circuit computations[J].Nature,2004,431(7010):789-795.
[83] Bressler S L.Large-scale cortical networks and cognition[J].Brain Res Rev,1995,20(3):288-304.
[84] Engel A K,Fries P,Singer W.Dynamic predictions:oscillations and synchrony in top-down processing[J].Nat Rev Neurosci,2001,2(10):704-716.
[85] Friston K J.Functional and effective connectivity in neuroimaging:a synthesis[J].Hum Brain Mapp,1994,2(1/2):56-78.
[86] McIntosh A R,Nyberg L,Bookstein F L,et al.Differential functional connectivity of prefrontal and medial temporal cortices during episodic memory retrieval[J].Human Brain Mapping,1997,5(4):323-327.
[87] McIntosh A R,Rajah M N,Lobaugh N J.Interactions of prefrontal cortex related to awareness in sensory learning[J].Science,1999,284(5419):1531-1533.
[88] Stephan K E,Hilgetag C C,Burns G A P C,et al.Computational analysis of functional connectivity between areas of primate cerebral cortex[J].Philos Trans R Soc Lond B,2000,355(1393):111-126.
[89] Stam C J.Functional connectivity patterns of human magnetoencephalographic recordings:a“small-world”network?[J].Neurosci Lett,2004,355(1/2):25-28.
[90] Micheloyannis S,Pachou E,Stam C J,et al.Using graph theoretical analysis of multi channel EEG to evaluate the neural efficiency hypothesis[J].Neurosci Lett,2006,402(3):273-277.
[91] Micheloyannis S,Vourkas M,Tsirka V,et al.The influence of ageing on complex brain networks:a graph theoretical analysis[J].Hum Brain Mapp,2009,30(1):200-208.
[92] Bassett D S,Meyer-Lindenberg A,Achard S,et al.Adaptive reconfiguration of fractal small-world human brain functional networks[J].Proc Natl Acad Sci USA,2006,103(51):19518-19523.
[93] Ferri R,Rundo F,Bruni O,et al.Small-world network organization of function connectivity of EEG slowwave activity during sleep[J].Clinical Neurophysiology,2007,118(2):449-456.
[94] Dimitriadis S I,Laskaris N A,Del Rio-Portilla Y,et al.Characterizing dynamic functional connectivity across sleep stages from EEG[J].Brain Topogr,2009,22(2):119-133.
[95] Salvador R,Suckling J,Schwarzbauer C,et al.Undirected graphs of frequency-dependent functional connectivity in whole brain networks[J].Phil Trans R Soc Lond B,2005,360(1457):937-946.
[96] Achard S,Salvador R,Whitcher B,et al.A resilient,low-frequency,small-world human brain functional network with highly connected association cortical hubs[J].J Neurosci,2006,26(1):63-72.
[97] Achard S,Bullmore E.Efficiency and cost of economical brain functional networks[J].PLoS Comput Biol,2007,3(2):17.
[98] Bassett D S,Bullmore E.Small-world brain networks[J].Neuroscientist,2006,12(6):512-523.
[99] Meunier D,Achard S,Morcom A,et al.Age-related changes in modular organization of human brain functional networks[J].NeuroImage,2009,44(3):715-723.
[100] He Y,Wang J H,Wang L,et al.Uncovering intrinsic modular organization of spontaneous brain activity in humans[J].PLoS One,2009,4(4):e5226.
[101] Laurienti P,Hugenschmidt C,Satoru H.Modularity maps reveal community structure in the resting human brain[EB/OL].(2009-04-15)[2012-03-10].http://hdl.handle.net/10101/npre.2009.3069.1.
[102] Chialvo D R.Critical brain network[J].Physica A,2004,340(4):756-765.
[103] Eguíluz V M,Chialvo D R,Cecchi G A,et al.Scalefree brain functional networks[J].Phys Rev Lett,2005,94(1):018102.1-018102.4.
[104] Zhang F F,Chen C H,Jiang L,et al.Brain functional networks involved in finger movement[C]//Proceedings of 2009 2nd international conference on biomedical engineering and informatics.New York:IEEE,2009,3:1640-1643.
[105] Zhang F F,Chen C H,Jiang L.Brain functional networks analysis and comparison[C]//Proceedings of 2010 3rd international conference on biomedical engineering and informatics.New York:IEEE,2010,3:1151-1155.
[106] 张方风,陈春辉,姜璐.基于复杂网络的大脑功能连接研究[J].复杂系统与复杂性科学,2011,8(2):18-24.
[107] 张方风,陈春辉,姜璐.数字背诵过程的大脑功能网络[J].中国医学物理学杂志,2006,23(6):419-422.
[108] Heuvel M P,Stam C J,Kahn R S,et al.Efficiency of functional brain networks and intellectual performance[J].J Neurosci,2009,29(23):7619-7624.
[109] Micheloyannis S,Pachou E,Stam C,et al.Small-world networks and disturbed functional connectivity in schizophrenia[J].Schizophr Res,2006,87(123):60-66.
[110] Pachou E,Vourkas M,Simos P,et al.Working memory in schizophrenia:an EEG study using power spectrum and coherence analysis to estimate cortical activation and network behavior[J].Brain Topogr,2008,21(2):128-137.
[111] Rubinov M,Knock S A,Stam C J,et al.Small-world properties of nonlinear brain activity in schizophrenia[J].Hum Brain Mapp,2009,30(2):403-416.
[112] Stam C J,De Haan W,Daffertshofer A,et al.Graph theoretical analysis of magnetoencephalographic functional connectivity in Alzheimer’s disease[J].Brain,2009,132(1):213-224.
[113] Stam C J,Jones B F,Nolte G,et al.Small-world networks and functional connectivity in Alzheimer’s disease[J].Cereb Cortex,2007,17(1):92-99.
[114] Buckner R L,Sepulcre J,Talukdar T,et al.Cortical hubs revealed by intrinsic functional connectivity:mapping,assessment of stability,and relation to Alzheimer’s disease[J].J Neurosci,2009,29(6):1860-1873.
[115] Supekar K,Menon V,Rubin D,et al.Network analysis of intrinsic functional brain connectivity in Alzheimer’s disease[J].PLoS Comput Biol,2008,4(6):e1000100.
[116] Ponten S C,Bartolomei F,Stam C J.Small-world networks and epilepsy:graph theoretical analysis of intracerebrally recorded mesial temporal lobe seizures[J].Clin Neurophysiol,2007,118(4):918-927.
[117] 蔡世民,洪磊,傅忠谦,等.基于复杂网络的脑电信号回归分析[J].中国科学技术大学学报,2011,41(4):331-337.
[118] Fallani F D V,Astolfi L,Cincotti F,et al.Cortical functional connectivity networks in normal and spinal cord injured patients:evaluation by graph analysis[J].Hum Brain Mapp,2007,28(12):1334-1346.
[119] Bartolomei F,Bosma I,Klein M,et al.Disturbed functional connectivity in brain tumour patients:evaluation by graph analysis of synchronization matrices[J].Clin Neurophysiol,2006,117(9):2039-2049.
[120] Wang L,Zhu C Z,He Y,et al.Altered small-world brain functional networks in children with attention deficit/hyperactivity disorder[J].Hum Brain Mapp,2007,30(2):638-649.
[121] 王亮,于春水.静息状态脑功能连接磁共振成像的分析方法及应用[J].中国医学影像技术,2008,24(8):1277-1280.
[122] 方小玲,姜宗来.基于脑电图的大脑功能性网络分析[J].物理学报,2007,56(12):7330-7339.
[123] Barahona M,Pecora L M.Synchronization in smallworld systems[J].Phys Rev Lett,2002,89(5):054101.
[124] Sporns O,Zwi J D.The small world of the cerebral cortex[J].Neuroinformatics,2004,2(2):145-162.
[125] Sporns O,Chialvo D R,Kaiser M,et al.Organization,development and function of complex brain networks[J].Trends Cogn Sci,2004,8(9):418-425.
[126] Sporns O,Honey C J.Small worlds inside big brains[J].Proc Natl Acad Sci USA,2006,103(51):19219-19220.
[127] Hasegawa H.Synchronizations in small-world networks of spiking neurons:diffusive versus sigmoid couplings[J].Physical Review E,2005,72(5):056139.
[128] Boccaletti S,Hwang D U,Chavez M,et al.Synchronization in dynamical networks:evolution along commutative graphs[J].Physical Review E,2006,74(1):016102.
[129] Jampa M P K,Sonawane A R,Gade P M,et al.Synchronization in a network of model neurons[J].Physical Review E,2007,75(2):026215.
[130] Motter A E,Zhou C S,Kurths J.Network synchronization,diffusion,and the paradox of heterogeneity[J].Physical Review E,2005,71(1):016116.
[131] Wang S J,Xu X J,Wu Z X,et al.Effects of degree distribution in mutual synchronization of neural networks[J].Physical Review E,2006,74(4):041915.
[132] McGraw P N,Menzinger M.Clustering and the synchronization of oscillator networks[J].Physical Review E,2005,72(1):015101.
[133] Lee L,Harrison L M,Mechelli A.A report of the functional connectivity workshop[J].Dusseldorf 2002,NeuroImage 2003,19(2):457-465.
[134] Tononi G,Edelman G M.Consciousness and Complexity[J].Science,1998,282(5395):1846-1851.
[135] Lago-Fernández L F,Huerta R,Corbacho F,et al.Fast response and temporal coherent oscillations in small-world networks[J].Physical Review Letters, 2000,84(12):2758-2761.
[136] Stam C J,Reijneveld J C.Graph theoretical analysis of complex networks in the brain[J].Nonlinear Biomedical Physics,2007,1(1):3.
[137] Hodgkin A L,Huxley A F.A quantitative description of membrane current and its application to conduction and excitation in nerve[J].Physiol J,1952,117(4):500-544.
[138] FitzHugh R.Impulses and physiological states in theoretical models of nerve membrane[J].Biophys J,1961,1(6):445-466.
[139] Nagumo J,Arimoto S,Yoshizawa S.An active pulse transmission line simulating nerve axon[J].Proc IRE,1962,50(10):2061-2070.
[140] Gammaitoni L,Hänggi P,Jung P,et al.Stochastic resonance[J].Rev Mod Phys,1998,70(1):223-287.
[141] Pikovsky A S,Kurths J.Coherence resonance in a noise-driven excitable system[J].Phys Rev Lett,1997,78(5):775-778.
[142] Gao Z,Hu B,Hu G.Stochastic resonance of smallworld networks[J].Phys Rev E,2001,65(1):016209.
[143] Li S H,Wang H L,Qi O Y.Frequency sensitivity of sub-excitable systems coupled with different topology[J].Chin Phys,2004,13(4):448-453.
[144] Fortuna L,Frasca M,Rosa M La,et al.Dynamics of neuron populations in noisy environments[J].Chaos,2005,15(1):014102.
[145] Zhou C S,Zemanova L,Zamora G,et al.Hierarchical organization unveiled by functional connectivity in complex brain networks[J].Phys Rev Lett,2006,97(23):238103.
[146] Zemanov’a L,Zhou C S,Kurths J.Structural and functional clusters of complex brain networks[J].Physica D,2006,224(1/2):202-212.
[147] Zhou C S,ZemanováL,Zamora-L’opez G,et al.Structure-function relationship in complex brain networks expressed by hierarchical synchronization[J].New Journal of Physics,2007,9(6):178.
[148] Honey C J,Kotter R,Breakspear M,et al.Network structure of cerebral cortex shapes functional connectivity on multiple time scales[J].Proc Natl Acad Sci,2007,104(24):10240-10245.
[149] Greicius M D,Supekar K,Menon V,et al.Restingstate functional connectivity reflects structural connectivity in the default mode network[J].Cereb Cortex,2009,19(1):72-78.
[150] Park C H,Kim S Y,Kim Y H,et al.Comparison of the small-world topology between anatomical and functional connectivity in the human brain[J].Physica A,2008,387(23):5958-5962.
[151] Honey C J,Sporns O,Cammoun L,et al.Predicting human resting-state functional connectivity from structural connectivity[J].Proc Natl Acad Sci,2009,106(6):2035-2040.
[152] Barabási A L.Scale-free networks:a decade and beyond[J].Science,2009,325(5939):412-413.
[153] Song S,Sjöström P J,Reigl M,et al.Highly nonrandom features of synaptic connectivity in local cortical circuits[J].PLoS Biol,2005,3(3):e68.
[154] Kaiser M,Hilgetag C C.Spatial growth of real-world networks[J].Physical Review E,2004,69(2):036103.
[155] Kaiser M,C.Modeling the development of cortical systems networks[J].Neurocomputing,2004,58-60:297-302.
[156] Zhang F F,Chen C H.Evolution modeling of complex network base on spatial structure[C]//Proceedings of 2010 6th international conference of natural computation.New York:IEEE,2010:884-887.
[157] Zhang F F,Liu J,Zuo C L.Research of complex network dynamics evolution[J].Lecture Notes in Electrical Engineering,2012,100:806-815.
[158] Schweitzer F,Fagiolo G,Sornette D,et al.Economic networks:the new challenges[J].Science,2009,325(5939):422-424.
[159] Onnela J P,Saramäki J,Hyvönen J,et al.Structure and tie strengths in mobile communication networks[J].PNAS,2007,104(18):7332-7336.
[160] Faust K.Very local structure in social networks[J].Sociological Methodology,2007,37(1):209-256.
