BIT1基因在伴淋巴结转移的食管鳞癌中的表达
2012-03-17范天黎程道博赵立群
柯 洋,范天黎,高 峰,程道博,赵立群
(1.郑州大学第一附属医院消化内科 河南 郑州 450052;2.郑州大学基础医学院药理学教研室 河南郑州 450001;3.郑州大学医药科学研究院 河南郑州 450052;4.郑州市中心医院消化内科 河南郑州 450007)
食管癌是人类常见的恶性肿瘤之一,食管癌的发生、发展及转移是一个多因素、多步骤的过程,与细胞凋亡—抗凋亡机制调控失衡密切相关。BIT1(Bcl-2 inhibitor of transcription1)是2004年由Jan等[1]报道并发现的一个蛋白质,该研究认为生理状态下BIT1蛋白定位于线粒体,当其释放到胞浆中,则和AES(amino-terminal enhancer of split,AES)[2]结合并诱导了由细胞脱粘附诱发的离巢凋亡,其正常的生理功能尚不清楚。但最新研究表明BIT1蛋白定位于高尔基体[3],具有抗凋亡功能[4]。目前仅有少量文献报道BIT1与肿瘤的关系,且结果不尽相同,而BIT1与食管鳞癌的关系,国内外未见报道。
为探讨BIT1与食管鳞癌的关系,尤其是与其转移的关系,本研究采用逆转录多聚酶链反应技术(reverse trancriptase polymerase chain reaction,RT-PCR)对30个病例90个组织标本(每个食管鳞癌组织中都有相应的癌旁不典型增生组织及正常食管粘膜组织)中BIT1的基因表达进行PCR扩增及半定量分析,揭示BIT1基因的表达与食管鳞癌转移的关系,以期为食管鳞癌的治疗提供一个新的思路和靶点。
1 材料和方法
1.1 材料
1.1.1 研究对象:30例标本均取自安阳市肿瘤医院胸外科2010年10月~11月行手术切除的食管癌住院患者。患者术前均未接受化、放疗,肿瘤组织经病理学检查均确诊为鳞状细胞癌。患者中男18例,女12例。年龄45~76岁,平均年龄62.27岁。伴淋巴结转移10例,无淋巴结转移20例。6例(浅层组)肿瘤浸润粘膜层、粘膜下层或浅肌层;24例(深层组)肿瘤浸润深肌层或外膜层。
1.1.2 组织标本采集:每例标本于离体30 min内分别在无坏死区癌灶、癌旁3 cm以内及远端正常食管粘膜取材。取材后迅速冻于液氮中,-80℃超低温冰箱中贮存备用。
1.1.3 引物设计:BIT1引物和内参β-actin引物序列均由北京赛百盛基因技术有限公司合成。BIT1上游引物序列为:5’-ATGCCCTCCAAATCCTT-3’,下游引物序列为5’-ATTAAACTTACAGTCAGTCCC-3’,预期扩增片段大小为428 bp。内参β-actin上游引物为5’-TCCTGTGGCATCCACGAAACT-3’,下游序列为 5’-GAAGCATTTGCGGTGGACGAT-3’,预期扩增片段大小为315 bp。
1.2 方法
1.2.1 总RNA的提取:采用TRIZOL试剂,按照说明提取总RNA,RNA沉淀用20 μl DEPC水溶解。总RNA经紫外分光光度仪检测260 nm和280 nm的吸光度(A)值,取A260/A280为1.8~2.0者用于RT反应。
1.2.2 半定量RT-PCR反应:以提取的总RNA为模板,按照逆转录试剂盒说明书将其逆转录成cDNA,以β-actin为内参照行PCR扩增反应,反应条件为:94℃预变性2 min;95℃变性1 min,46℃退火1 min,72℃延伸1 min;经30个循环周期后,72℃5 min,取出,4℃贮存备用。PCR产物经1.8%琼脂糖凝胶电泳(溴化乙锭染色),用凝胶成像系统分析结果,计算BIT1扩增条带与β-actin扩增条带吸光度比值,以其作为BIT1基因的相对表达量。
1.3 统计学分析 采用SPSS13.0分析软件处理,根据资料类型采用ANOVA、LSD检验和t检验。检验水准α=0.05。
2 结果
2.1 RT-PCR检测BIT1基因在食管组织中的表达
BIT1及内参β-actin的PCR产物琼脂糖凝胶电泳大小与预先设计引物大小一致,其片段大小分别为428 bp、315 bp。凝胶灰度扫描扩增的结果,对BIT1基因的阳性表达进行相对定量,BIT1基因在癌组织、癌旁不典型增生组织及正常食管粘膜组织中的含量依次为1.747±0.243、0.941±0.178、1.242±0.261,经ANOVA检验,组间比较差异有统计学意义(F=3.526,P<0.044),经LSD检验两两比较,BIT1基因的表达在癌组织中不典型增生及正常食管粘膜高(均P<0.05),BIT1基因的表达在不典型增生及正常食管粘膜中著差无统计学意义(P>0.05)。见图1,表1。
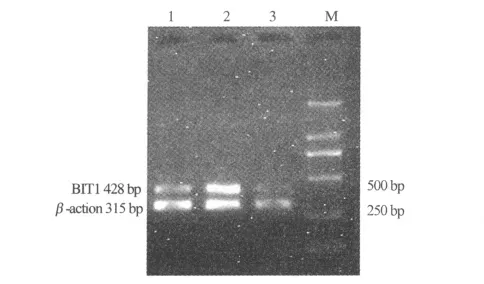
图1 RT-PCR检测BIT1的表达
表1 BIT1在各种食管组织中的表达(±s)
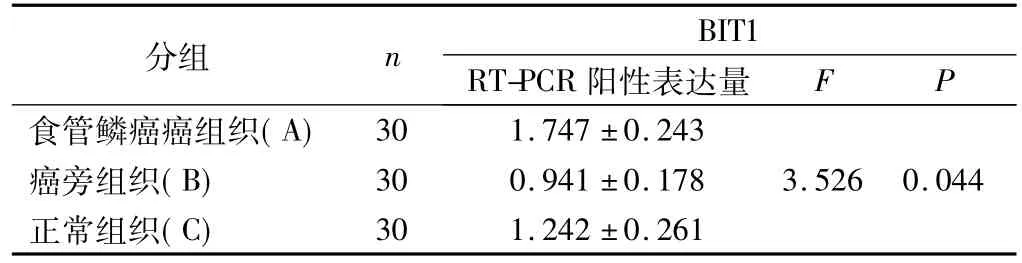
表1 BIT1在各种食管组织中的表达(±s)
注:A与B相比P=0.020,A与C相比P=0.047,B与C相比P=0.699。
?
2.2 食管鳞癌组织中BIT1基因表达与临床病理学参数的关系 统计学分析表明,在食管鳞癌组织中,BIT1基因的表达水平与患者的性别无明显相关(P>0.05),与肿瘤浸润深度无明显相关(P>0.05),但BIT1基因的表达水平在淋巴结转移组明显高于无淋巴结转移组,组间差异有统计学意义(P<0.001);且在TNM分期中差异有显著的统计学意义,在TNMⅢ/Ⅳ期组中的表达高于Ⅰ/Ⅱ期组(P<0.05),见表2。
3 讨论
BIT1是2004年Jan等[1]在研究细胞凋亡机制时发现的一种新基因,定位于人17q23.2,其mRNA长度约为1 kb,编码179aa,BIT1蛋白分子量约为27 kDa。其研究表明,生理状态下,BIT1蛋白定位于线粒体膜间隙,当BIT1从线粒体释放到胞浆,或者在胞浆中表达BIT1蛋白时,BIT1与AES结合,共同介导整合素依赖的失巢凋亡。但也有研究表明,BIT1蛋白定位于高尔基体[3],在粘附细胞中BIT1可通过激活FAK-P13KAFK-NFkB信号通路,上调Bcl-2的转录和表达,促进细胞生存,下调内源性的BIT1,则会增强粘附细胞的凋亡[4]。从目前的研究推测,BIT1可能是转换细胞存活和死亡纽带的关键分子。
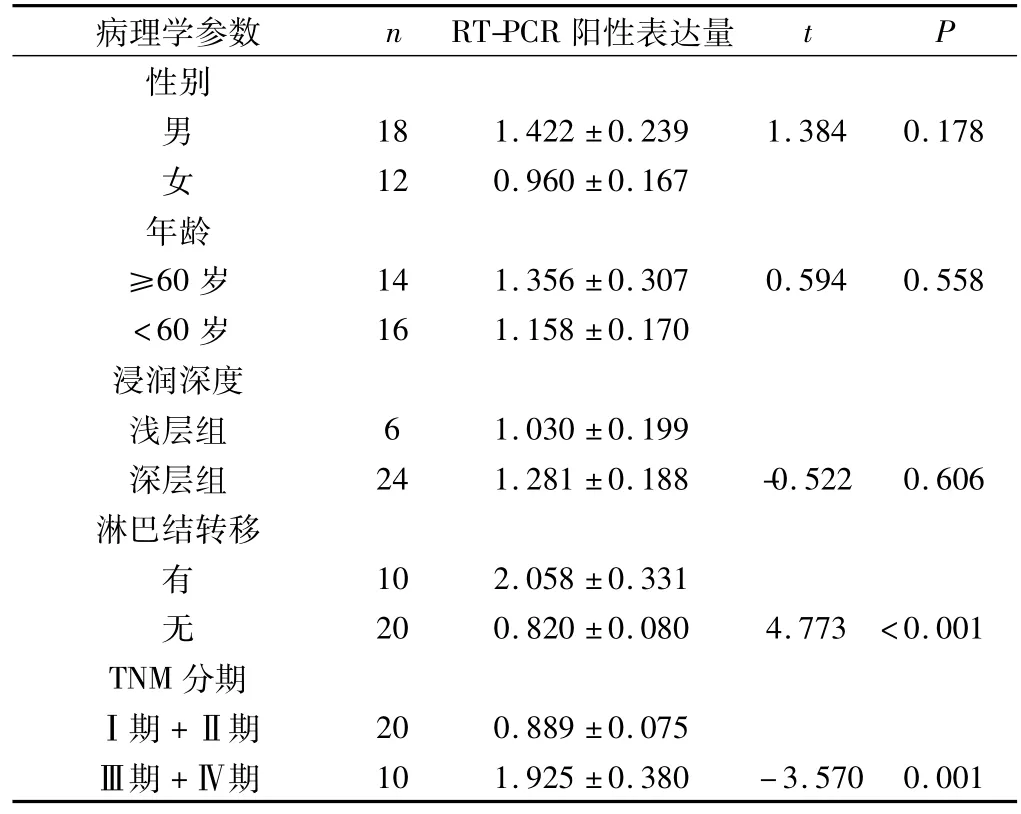
表2 食管鳞癌组织中BIT1表达与临床病理学参数的关系
本研究结果显示:BIT1基因在癌组织中的表达水平比在癌旁组织、正常食管组织均高,而癌旁组织、正常食管组织相比无统计学意义。BIT1基因表达水平和淋巴结转移、TNM分期有关,淋巴结转移组表达水平高于无淋巴结转移组,Ⅲ/Ⅳ期组表达水平高于Ⅰ/Ⅱ期组,而与患者的性别、年龄、浸润深度无明显相关。提示BIT1在淋巴结转移组中的过表达与食管鳞癌的发展及转移有关。这一结果可能与BIT1增强整合素α5β1 FAK的活化,通过激活FAK-P13K-AFK-NFkB信号通路上调NFkB的活性,随之上调Bcl-2的表达有关[4],从而促进转移的癌细胞克服离巢凋亡而存活。已有研究表明,Bcl-2和FAK的过表达会增加肿瘤的转移效率[5];BIT1在卵巢癌组织中的表达明显高于正常卵巢组织,卵巢癌组织中BIT1的表达与病理分级密切相关[6]。但也有研究与之相反,例如Karmal等[7]认为在晚期乳腺癌组织中BIT1表达下调,下调BIT1可降低细胞失巢凋亡的敏感性,增强细胞粘附,增强转移和高水平的ErK活化,促进细胞抗凋亡及转移能力;滑玮[8]等认为BIT1在宫颈癌组织中的表达明显低于正常宫颈组织,宫颈癌组织中BIT1的表达与分化程度密切相关。这些研究与本实验结果存在差异,其原因可能与取材和检测水平有关。
综上所述,BIT1在伴淋巴结转移食管鳞癌组织中的高表达提示BIT1在食管鳞癌的转移中可能起一定作用。而二者之间的确切关系有待于进一步研究。
[1] Jan Y W,Matter M,Pai J T,et al.A mitochondrial protein,BIT1,mediates apoptosis regulated by integrins and Groucho/TLE corepressors[J].Cell,2004,116(5):751-762.
[2] Paroush Z,Finley R J,Kidd T,et al.Groucho is required for Drosophila neurogenesis,segmentation,and sex determination and interacts diretly with hairy-related bHLH proteins[J].Cell,1994,79(5): 805-815.
[3] Yi P,Nguyen D T,Higa-Nishiyama A,et al.MAPK scaffolding by BIT1 in the Golgi complex modulates stress resistance[J].Journal of Cell Science,2010,123(7):1067-1072.
[4] Griffiths G S,Grundl M,Leychenko A,et al.Bit-1 mediates integrindependent cell survival through activation of the NFkappaB pathway[J].Journal of Biological Chemistry,2011,86(16):14713-14723.
[5] Townson J L,Naumov G N,Chambers A F,et al.The role of apoptosis in tumor progression and metastasis[J].Curr Mol Med,2003,3(7): 631-642.
[6] 滑玮,辛晓燕,张伟,等.应用组织芯片技术分析卵巢癌组织中BIT1基因的表达[J].现代妇科肿瘤,2006,15(3):181-183.
[7] Karmali P P,Brunquell C,Tram H,et al.Metastasis of tumor cells is enhanced by downregulation of BIT1[J].PloS one,2011,6 (8):23840.
[8] 滑玮,吕海鹏,辛晓燕,等.应用组织芯片技术分析宫颈癌组织中Bit 1基因的表达[J].现代肿瘤医学,2007,15(6):832-834.
