灵芝对肝癌干细胞糖代谢和标志物蛋白的影响
2012-03-17安玉会王洁琼崔海涛马乾坤李芳芳何一昕
安玉会,王洁琼,徐 衍,崔海涛,马乾坤,李芳芳,何一昕
(郑州大学基础医学院生物化学与分子生物学教研室 河南郑州 450001)
1980年至2005年,全球癌症的年发病人数增加了1倍,从600万人上升到1 200万人[1]。据1999年的统计,肝癌的病死率在各种癌症中排第4位,在男性则为第3位,共有42.7万人死于肝癌[2]。肝癌在世界人口的标化死亡率为17.72/10万,在中国人口的标化死亡率为13.45/10万[3]。
尽管化疗药物可以快速缩小肿瘤的体积,但治疗后的复发仍高比率的出现于肿瘤病人中。其根本原因是这些化疗药物在根除癌干细胞方面是低效率的。新的研究发现,天然存在的营养性化合物为癌的化学预防提供了可能[4],因为它们能直接或间接地影响癌干细胞的增殖途径[5]。对灵芝的抗癌作用研究表明,灵芝能抑制癌的侵润和转移,具有良好的肿瘤化学防治作用[6],但抑制机理不明,是否是灵芝对癌干细胞发挥了作用,尚未见到相关报道。本文报告灵芝对人肝癌细胞中己糖激酶活性和肝癌干细胞中CD133蛋白的抑制作用。
1 材料与方法
1.1 细胞分组并进行药物处理 取对数生长期的肝癌SMMC7721细胞进行96孔铺板,每孔接种细胞104个。细胞贴壁后,分别用不同浓度(100、200、300、400、500 μg/ml)的灵芝L08处理24 h、48 h、72 h。其中每种药物每个浓度做3个平行实验,设置一个对照组和100、200、300、400、500 μg/ml的阳性对照组(环磷酰胺组)。
1.2 肿瘤细胞抑制率的测定 将加药处理24 h、48 h、72 h后的肝癌SMMC7721细胞培养液中加入MTT (5 mg/ml),每孔20 μl,孵育4 h。终止孵育时,小心弃去孔内液体,每孔加入150 μl的DMSO,利用酶标仪在450 nm测定其OD值。抑制率(%)=(对照组OD值-加药处理组OD值)/对照组OD值×100%。
1.3 己糖激酶活性测定的测定 处理细胞后终止培养,破裂细胞。按照己糖激酶试剂盒操作流程进行加样,混匀,记录30 s时340 nm波长处的吸光度(A1值),将比色皿中的反应液倒入预先编号的试管中,放入37℃水浴20 min,测定20 min30 s的吸光度(A2值)。HK活性(U/g protein)=(A2-A1)/毫摩尔消光系数×1/(反应时间×比色光径)×反应体系中样本稀释倍数×1 000。
1.4 CD133蛋白的测定方法 收集处理24 h后的细胞反复冻融并离心。收集上清液测定蛋白含量。取蛋白样品,加入等量的loading buffer。振荡混匀,煮沸5 min,离心后110 V电泳至胶下缘。取胶,转膜,室温封闭2 h。洗膜3次后加入一抗(1 μg/ml)。洗膜后加入辣根过氧化物酶标记的羊抗兔抗体(即二抗),室温孵育1 h。洗膜并用辣根过氧化酶-DAB法染色。出现明显的棕色蛋白条带停止染色。用灰度仪扫描棕色蛋白条带。
1.5 统计学分析 MTT和己糖激酶活性测定所得的数据利用SPSS 17.0进行数据分析,各组分别同阴性对照组、阳性对照组进行t检验分析。不同药物浓度的组内进行F检验分析,数据用±s表示。组间数据比较用t检验。检验水准α=0.05。
2 结果
2.1 灵芝L08对细胞增殖的抑制 灵芝L08对人肝癌SMMC7721细胞的增殖具有明显的抑制作用。与化疗药物环磷酰胺比,200 μg/ml以下浓度的灵芝L08作用人肝癌SMMC7721细胞24 h,其抑制率低于环磷酰胺。但作用时间超过48 h以上,200 μg/ml的灵芝L08均比同样浓度的环磷酰胺对人肝癌SMMC7721细胞的增殖具有更强的抑制作用。并且,随着灵芝L08浓度和作用时间的增加,其抑制率更高。不同浓度的灵芝L08和环磷酰胺对细胞增殖作用的抑制率,见表1~3。
表1 灵芝L08和环磷酰胺对肝癌SMMC7721细胞处理24 h增殖的影响(±s)
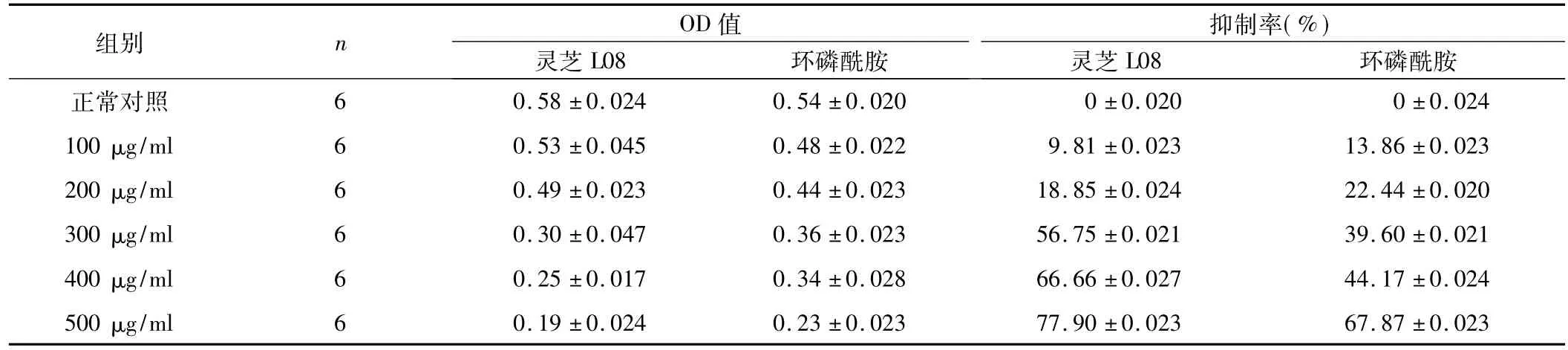
表1 灵芝L08和环磷酰胺对肝癌SMMC7721细胞处理24 h增殖的影响(±s)
灵芝L08组总F=25.41,P<0.05;环磷酰胺组总F=22.45,P<0.05。
?
表2 灵芝L08和环磷酰胺对肝癌SMMC7721细胞处理48 h增殖的影响(±s)
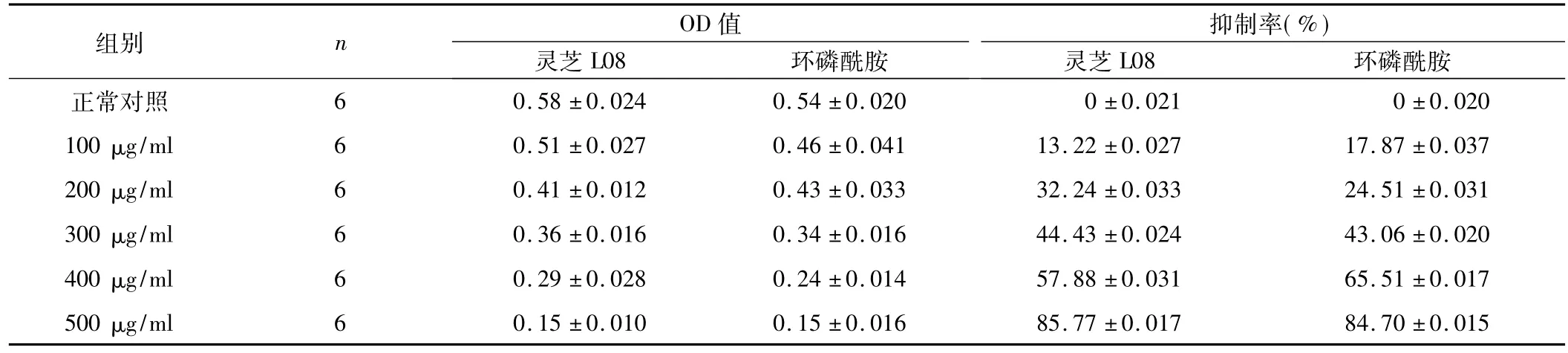
表2 灵芝L08和环磷酰胺对肝癌SMMC7721细胞处理48 h增殖的影响(±s)
灵芝L08组总F=53.37,P<0.05;环磷酰胺组总F=32.11,P<0.05。
?
表3 灵芝L08和环磷酰胺对肝癌SMMC7721细胞处理72 h增殖的影响(±s)
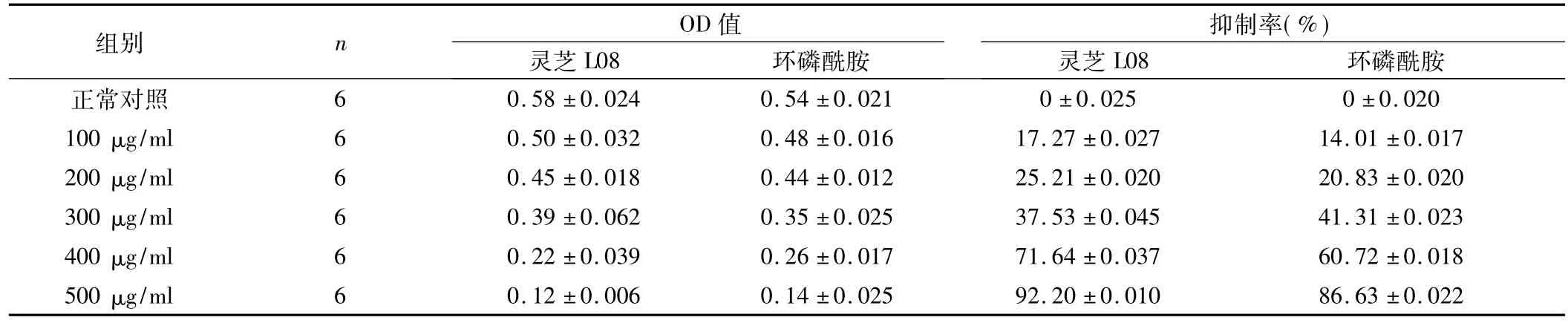
表3 灵芝L08和环磷酰胺对肝癌SMMC7721细胞处理72 h增殖的影响(±s)
灵芝L08组总F=24.28,P<0.05;环磷酰胺组总F=57.16,P<0.05。
抑制率(%)组别 n OD值0.58±0.024 0.54±0.021 0±0.025 0±0.020 100 μg/ml 6 0.50±0.032 0.48±0.016 17.27±0.027 14.01±0.017 200 μg/ml 6 0.45±0.018 0.44±0.012 25.21±0.020 20.83±0.020 300 μg/ml 6 0.39±0.062 0.35±0.025 37.53±0.045 41.31±0.023 400 μg/ml 6 0.22±0.039 0.26±0.017 71.64±0.037 60.72±0.018 500 μg/ml 6 0.12±0.006 0.14±0.025 92.20±0.010 86.环磷酰胺正常对照灵芝L08环磷酰胺 灵芝L08 6 63±0.022
2.2 灵芝L08对己糖激酶活性的抑制 灵芝L08和环磷酰胺均能降低人肝癌SMMC7721细胞己糖激酶的活性。随着灵芝L08和环磷酰胺浓度的增加,它们对己糖激酶的抑制率也逐步增加。但随着它们对细胞作用时间的增加,各浓度对应组的抑制作用则逐步降低。不同浓度的灵芝L08和环磷酰胺对细胞中己糖激酶的抑制率,见表4~6。
表4 灵芝L08和环磷酰胺处理肝癌SMMC7721细胞24 h对己糖激酶活性的影响(±s)
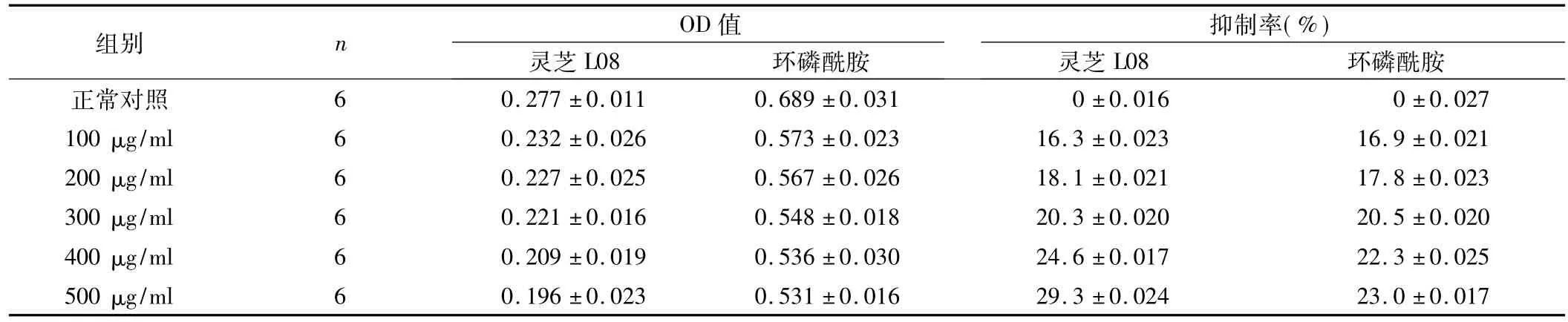
表4 灵芝L08和环磷酰胺处理肝癌SMMC7721细胞24 h对己糖激酶活性的影响(±s)
抑制率(%)组别 n OD值0.277±0.011 0.689±0.031 0±0.016 0±0.027 100 μg/ml 6 0.232±0.026 0.573±0.023 16.3±0.023 16.9±0.021 200 μg/ml 6 0.227±0.025 0.567±0.026 18.1±0.021 17.8±0.023 300 μg/ml 6 0.221±0.016 0.548±0.018 20.3±0.020 20.5±0.020 400 μg/ml 6 0.209±0.019 0.536±0.030 24.6±0.017 22.3±0.025 500 μg/ml 6 0.196±0.023 0.531±0.016 29.3±0.024 23环磷酰胺正常对照灵芝L08环磷酰胺 灵芝L08 6.0±0.017
灵芝L08组总F=27.89,P<0.05;环磷酰胺组总F=45.31,P<0.05。
表5 灵芝L08和环磷酰胺处理肝癌SMMC7721细胞48 h对己糖激酶活性的影响(±s)
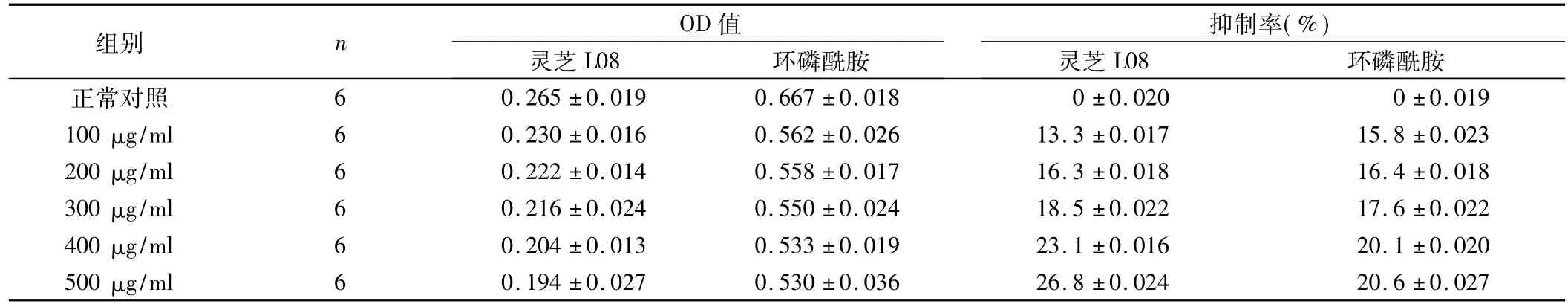
表5 灵芝L08和环磷酰胺处理肝癌SMMC7721细胞48 h对己糖激酶活性的影响(±s)
灵芝L08组总F=32.36,P<0.05;环磷酰胺组总F=27.03,P<0.05。
抑制率(%)组别 n OD值0.265±0.019 0.667±0.018 0±0.020 0±0.019 100 μg/ml 6 0.230±0.016 0.562±0.026 13.3±0.017 15.8±0.023 200 μg/ml 6 0.222±0.014 0.558±0.017 16.3±0.018 16.4±0.018 300 μg/ml 6 0.216±0.024 0.550±0.024 18.5±0.022 17.6±0.022 400 μg/ml 6 0.204±0.013 0.533±0.019 23.1±0.016 20.1±0.020 500 μg/ml 6 0.194±0.027 0.530±0.036 26.8±0.024 20环磷酰胺正常对照灵芝L08环磷酰胺 灵芝L08 6.6±0.027
表6 灵芝L08和环磷酰胺处理肝癌SMMC7721细胞48 h对己糖激酶活性的影响(±s)
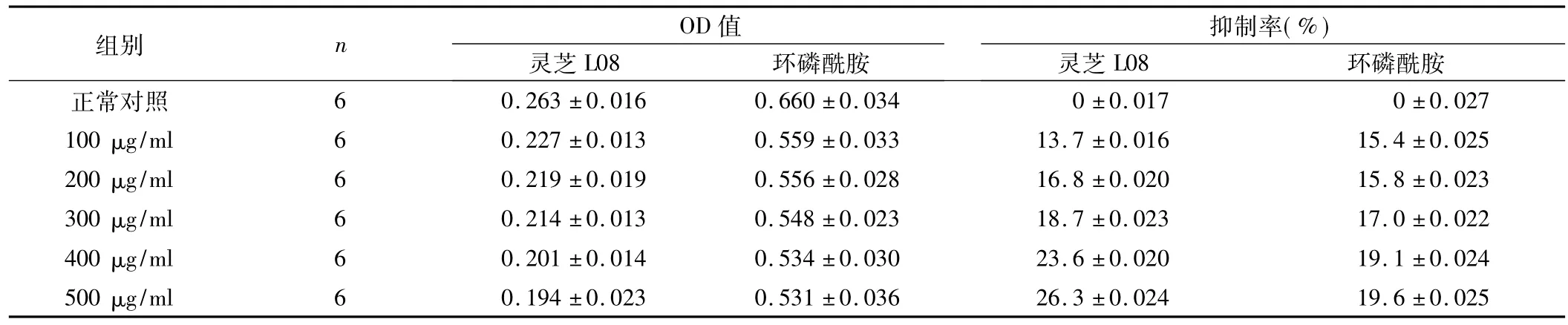
表6 灵芝L08和环磷酰胺处理肝癌SMMC7721细胞48 h对己糖激酶活性的影响(±s)
灵芝L08组总F=25.75,P<0.05;环磷酰胺组总F=35.38,P<0.05。
抑制率(%)组别 n OD值0.263±0.016 0.660±0.034 0±0.017 0±0.027 100 μg/ml 6 0.227±0.013 0.559±0.033 13.7±0.016 15.4±0.025 200 μg/ml 6 0.219±0.019 0.556±0.028 16.8±0.020 15.8±0.023 300 μg/ml 6 0.214±0.013 0.548±0.023 18.7±0.023 17.0±0.022 400 μg/ml 6 0.201±0.014 0.534±0.030 23.6±0.020 19.1±0.024 500 μg/ml 6 0.194±0.023 0.531±0.036 26.3±0.024 19环磷酰胺正常对照灵芝L08环磷酰胺 灵芝L08 6.6±0.025
2.3 灵芝L08对SMMC772细胞CD133蛋白水平的影响 灵芝L08能降低癌干细胞的标志物蛋白CD133的水平,并且随着灵芝浓度的增加,CD133蛋白的水平显著降低。环磷酰胺也能少量降低CD133蛋白的水平,但随着环磷酰胺浓度的增加,CD133蛋白的水平并没有明显的改变。不同浓度的灵芝L08和环磷酰胺对肝癌干细胞中CD133蛋白水平的影响见图1、图2和表7。
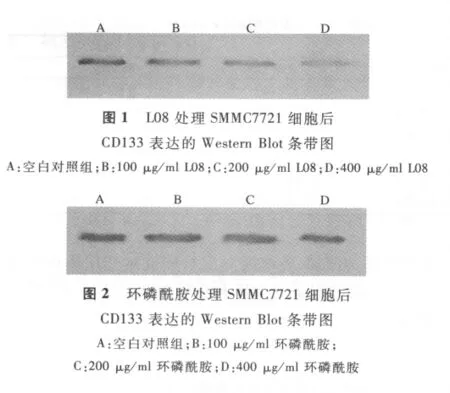
表7 灵芝L08和环磷酰胺处理SMMC772细胞后CD133蛋白条带的灰度值(±s)
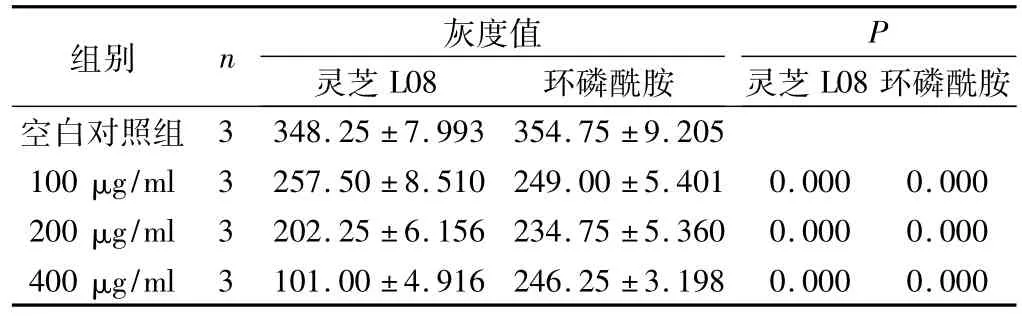
表7 灵芝L08和环磷酰胺处理SMMC772细胞后CD133蛋白条带的灰度值(±s)
灵芝L08组总F=215.88,P<0.05;环磷酰胺组总F=82.21,P<0.05。
P组别 n 环磷酰胺空白对照组灰度值灵芝L08环磷酰胺 灵芝L08 3 348.25±7.993 354.75±9.205 100 μg/ml 3 257.50±8.510 249.00±5.401 0.000 0.000 200 μg/ml 3 202.25±6.156 234.75±5.360 0.000 0.000 400 μg/ml 3 101.00±4.916 246.25±3.198 0.000 0.000
3 讨论
实验结果显示,灵芝 L08能抑制人肝癌SMMC7721细胞的增殖。随着浓度和时间的增加,灵芝L08比同样浓度的环磷酰胺对细胞的抑制率更高。肿瘤组织即使在氧供应充分的条件下也主要以无氧糖酵解获取能量[7],而己糖激酶是催化无氧糖酵解第一步反应的关键酶[8]。灵芝L08能抑制人肝癌细胞己糖激酶的活性,从而可抑制癌细胞通过无氧糖酵解获取增殖的能量,阻止人肝癌细胞的增殖。
Suetsugu等[9]证实,CD133蛋白阳性的肝癌细胞具有癌干细胞样的性质。Lingala等[10]证明在肝细胞癌表面存在着CD133蛋白。在先前的研究中,作者也证实人肝癌SMMC7721细胞系中存在着CD133阳性的癌干细胞[11]。灵芝 L08降低人肝癌干细胞的CD133蛋白的水平,一方面表明灵芝L08抑制了人肝癌干细胞的CD133基因的表达,因此降低了CD133蛋白水平。可能灵芝L08抑制了人肝癌干细胞的增殖,减少了人肝癌干细胞数,因此CD133蛋白水平有了明显降低。但是,灵芝是因为抑制了CD133基因的表达才阻止了肝癌干细胞的增殖,还是抑制了肝癌干细胞增殖才降低了CD133蛋白的水平,须要进一步研究。但可以肯定肝癌干细胞增殖的抑制和减少,阻止了癌细胞的增殖、浸润、转移和复发可能。
在中国、日本、朝鲜和亚洲许多国家,灵芝曾被用作传统药物治疗多种疾病[12]。对灵芝的抗癌作用研究表明,灵芝能抑制癌细胞的侵润和转移,具有良好的肿瘤化学预防作用[6]。本研究的结果表明,灵芝可抑制肝癌细胞己糖激酶的活性,因而也就抑制了肝癌细胞和癌干细胞增殖的能量来源。同时,灵芝也降低了CD133蛋白的水平,抑制了癌干细胞的增殖。灵芝作为公认的传统草药在癌的预防和治疗中必将发挥更大的作用。
[1] Sasco A J.Cancer and globalization[J].Biomedicine and Pharmacotherapy,2008,62(2):110-121.
[2] 张思维,雷正龙,李光琳,等.中国肿瘤登记地区2006年肿瘤发病和死亡资料分析[J].中国肿瘤,2010,19(6):356-365.
[3] 毛锁宝.2003年-2007年原发性肝癌的发病率及相关因素分析[J].中外医学研究,2009,7(14):170-171.
[4] Koch U,Krause M,Baumann M.Cancer Stem cells at the crossroads of current cancer therapy failure-Radiation oncology perspective[J].Seminars in Cancer Biology,2010,20(2):116-124.
[5] Li Y Y,Wicha M S,Schwartz S J,et al.Implications of cancer stem cell theory for cancer chemoprevention by natural dietary compounds[J].Journal of Nutritional Biochemistry,2011,22(9):799-806.
[6] Weng C J,Yen G C.The in vitro and in vivo experimental evidences disclose the chemopreventive effects of Ganoderma lucidum on cancer invasion and metastasis[J].Clin Exp Metastasis,2010,27(5):361-369.
[7] 赵迎超,伍钢.己糖激酶与恶性肿瘤的关系研究进展[J].肿瘤防治研究,2006,33(9):694-696.
[8] Miller S,Ross-Inta C,Giulivi C.Kinetic and proteomic analyses of S-nitrosoglutathione-treated hexokinase A:consequences for cancer energy metabolism[J].Amino Acids,2007,32(4):593-602.
[9] Suetsugu A,Nagaki M.Characterization of CD133+hepatocellular carcinoma cells as cancer stem/progenitor cells[J].Biochem and Biophys Res Comm,2006,351(4):820-824.
[10]Lingala S,Cui Y Y,Chen X L,et al.Immumohistochemical staining of cancer cell markers in hepatocellular carcinoma[J].Experimental and Molecular Pathology.2010,89(1):27-35.
[11]安玉会,宋丹,杨丽君,等.大豆黄酮对肝癌SMMC7721细胞和CD133肿瘤干细胞增殖的影响[J].河南医学研究,2010,19 (4):385-388.
[12]Li Y Q,Wang S F.Anti-hepatitis B activities of ganoderic acid from Ganoderma lucidum[J].Biotechnol Lett,2006,28(11):837-841.
