不同水分生境中空心莲子草自然种群的表型可塑性
2012-03-14曹裕松肖宜安胡文杰
曹裕松,肖宜安,周 兵,胡文杰
不同水分生境中空心莲子草自然种群的表型可塑性
曹裕松1, 2,肖宜安1, 2,周 兵1, 2,*胡文杰1, 2
(1. 井冈山大学生命科学学院,江西,吉安 343009;2. 江西省生物多样性与生态工程重点实验室,江西,吉安 343009)
入侵植物对环境表现出较强的表型可塑性,研究外来入侵植物对不同生境的形态适应性可以为合理防治生物入侵的提供理论依据。本研究对3不同水分条件的生境中空心莲子草的表型特征和生物量分配以及叶绿素含量进行了研究,结果表明:旱生生境中空心莲子草叶片长度和叶生物量以及茎生物量均极显著地低于湿生和水生生境中的相应的指标;3生境中,茎生物量大小依次为旱生<湿生<水生,其中水生生境中与湿生生境中差异不显著;地下生物量大小依次为旱生> 湿生> 水生,各生境中差异达到显著水平;根/冠比以旱生生境中为最高,湿生生境中次之,水生生境中最低;叶片中总叶绿素含量以旱生生境中最低,水生生境中次之,湿生生境中最高,但是旱生生境中空心莲子草叶绿素a (Chl a)的含量却为最高,水生生境中为最低。
生物入侵;空心莲子草;表型可塑性;生境
空心莲子草 ()又称喜旱莲子草、水花生,原产美洲的巴西、乌拉圭、阿根廷等国[1],由于其生命力强、适应性广、生长与繁殖速度快,迅速传播到亚洲、澳洲、非洲与北美洲的许多国家,并逐渐逃逸为害草,目前已经在热带、亚热带和暖温带地区(包括美国、澳大利亚、新西兰、东南亚各国、印度和中国等多个国家)广泛归化[2]。空心莲子草能适应多种生境,且难以清除,常常排挤本地植物而形成单一的优势群落,对入侵地的生物多样性、生态系统以及社会经济造成很大的威胁,是世界公认的恶性杂草之一[2-5]。并且,目前喜旱莲子草的扩散并没有出现减缓的迹象,在全国范围来看还没有进入饱和期,在一段时期内仍呈持续较快的扩散趋势[6]。
关于空心莲子草的研究主要集中于其生物学特征[7-9]、对环境因子的生理生态适应[9-11]、入侵机制[8, 12]以及生物、化学防治[2, 8, 13-14]等方面。目前已有研究开始关注空心莲子草对环境非生物因素的可塑性反应,如生长性状[9]和生物量分配[10]。外来物种的入侵成败取决于它与新生境的相互作用和适应。空心莲子草能适应不同水分条件下的生境,根据空心莲子草与水环境的关系及其形态结构特点,将其划分为旱生型、挺水型和漂浮型3生境类型[15]。但是有关空心莲子草适应水分条件变化的研究主要侧重于其不定根和茎的解剖结构上的可塑性[15],对于叶片及其叶绿素含量的研究较少。空心莲子草之所以能够成功入侵不同水分条件的生境,是因为它具有极强的表型可塑性,要想控制空心莲子草的扩散必须清楚地了解其如何适应不同水分条件的生境。本文以在野外生长于3种不同水分生境(水生、湿生和旱生)的空心莲子草为对象,从叶片长度、地下和地上生物量分配以及叶绿素含量研究其对水分生境的适应策略,以期为控制该物种的蔓延提供生态学资料和依据。
1 材料与方法
研究地位于江西省吉安市青原区井冈山大学校园内(N27°06′45.58″, E115°01′11.35″)。选择池塘作为水生生境,以池塘漫滩作为湿生生境(在湿生生境中根系能接触到土壤),以邻近有空心莲子草生长的陆地作为旱生生境。在3种生境中,随机选取5株代表性的空心莲子草植株,测量从顶芽以下6节的节间距,摘取整株的叶片、茎和根系,于80 ℃烘箱中烘至恒重,称重,根冠比以叶片和茎质量各除以根质量计算。在3种生境中分别选择3株生长良好的植株,在每一植株上选择健康的叶片3片,用毛笔或毛刷清除叶片表面的灰尘,用打孔器从绿叶和黄叶上各打取0.25 dm-2的叶圆片,立即称重,剪碎后放入研钵中。采用丙酮提取法测定叶绿素含量。
所有数据分析运用Excel 2003进行整理与处理,运用SPSS 15.0进行One-way ANOVA分析。
2 结果分析
2.1 表型特性
3生境下空心莲子草的表型特征如图1所示,结果显示空心莲子草的叶片长度在湿生生境下最长,达到5.96 cm;旱生生境下最短,仅为4.22cm。空心莲子草叶片长度在旱生与水生两种生境中差异显著 (< 0.05,= 3),在旱生与湿生两种生境中差异达到极显示水平 (< 0.001,= 3)。
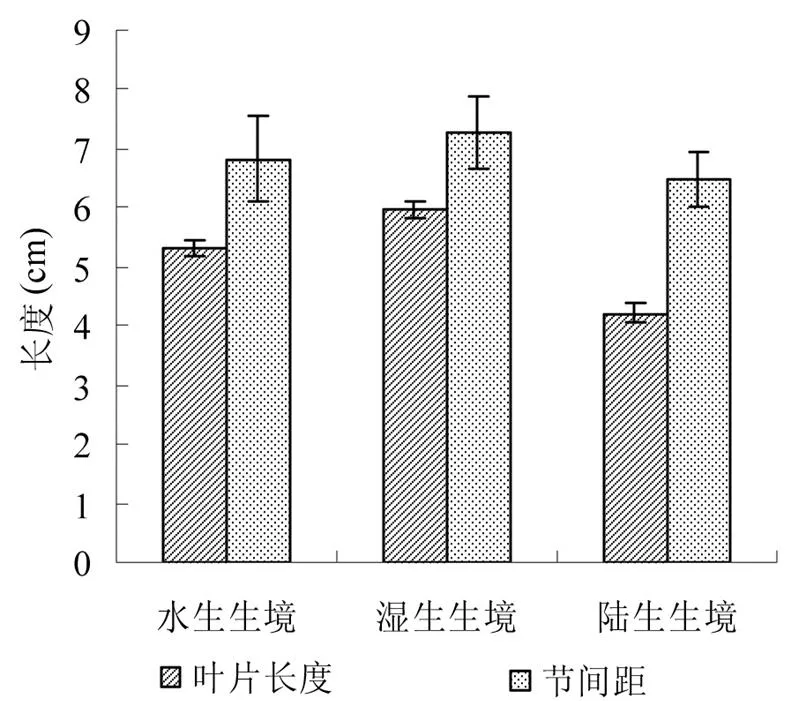
图1 不同生境下空心莲子草叶片长度与节间距
2.2 生物量分配
空心莲子草叶片生物量在湿生条件下最高(1.408 ± 0.011)g,水生生境次之(0.924 ± 0.014) g,旱生生境下叶片生物量最低(0.413 ± 0.036)g (Fig. 2)。并且,各生境条件下空心莲子草叶生物量的差异均达极显著水平(< 0.001,= 3)。
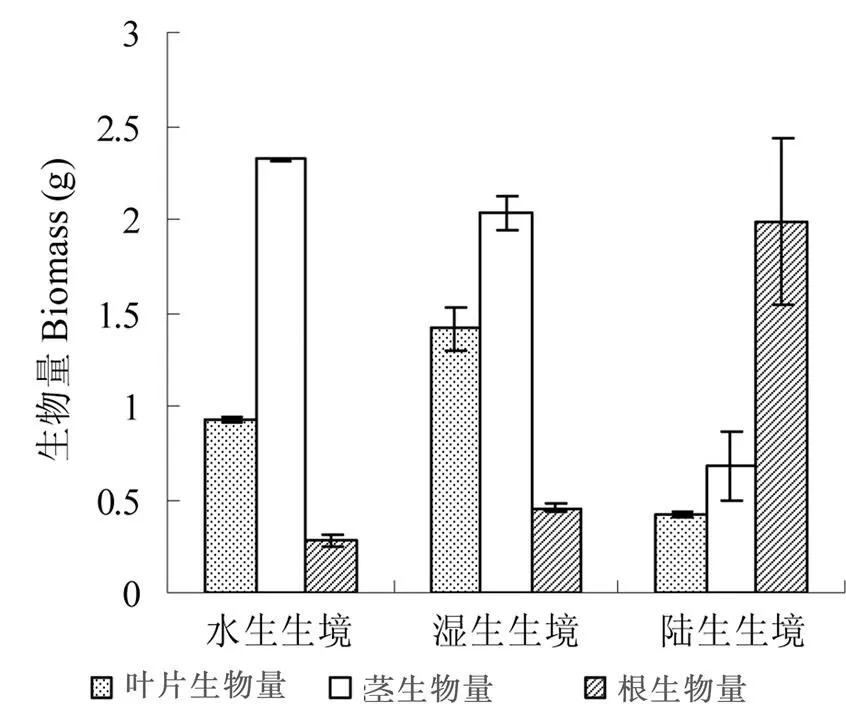
图2 不同生境下空心莲子草生物量分配
与叶生物量稍有不同,3生境下空心莲子草茎生物量大小依次为旱生< 湿生< 水生(Fig.2),水生条件下茎生物量高于湿生条件下的茎生物量,但是差异不显著(= 0.051)。旱生生境中茎生物量极显著地低于湿生和水生生境中茎生物量(< 0.001,= 3)。
3生境下空心莲子草地下生物量大小依次为旱生> 湿生> 水生,正好与茎生物量相反(Fig.2),旱生生境中空心莲子草地下生物量显著高于湿生和水生生境中的地上生物量(< 0.05,=3 ),但是,湿生生境中空心莲子草地上生物量与水生生境中的地上生物量差异不显著(= 0.679)。
旱生生境中空心莲子草的根冠比最高(1.836 ± 0.425)(Fig.3),显著高于湿生和水生生境中的根冠比(< 0.05),湿生生境中次之(0.131 ± 0.053),水生生境中最低(0.086 ± 0.004),但是,湿生与水生生境中空心莲子草的根冠比差异不显著(= 0.903)。

图3 不同生境下空心莲子草根冠比
3.3 叶绿素含量
3种生境中空心莲子草叶片的总叶绿素含量以旱生生境中最低,水生生境中次之,湿生生境中最高(Fig. 4);同时,旱生生境中空心莲子草叶片的叶绿素b (Chl b)的含量也最低(0.778 ± 0.066) mg·g-1,湿生和水生两种生境中Chl b的含量非常接近,各种生境中空心莲子草叶片Chl b含量差异不显著。但是,空心莲子草叶片叶绿素 a (Chl a)的含量却以旱生生境中为最高(0.743 ± 0.036) mg·g-1,水生生境中最低(0.704 ± 0.029) mg·g-1,各生境下空心莲子草叶片Chl a的含量未检测到显示差异。
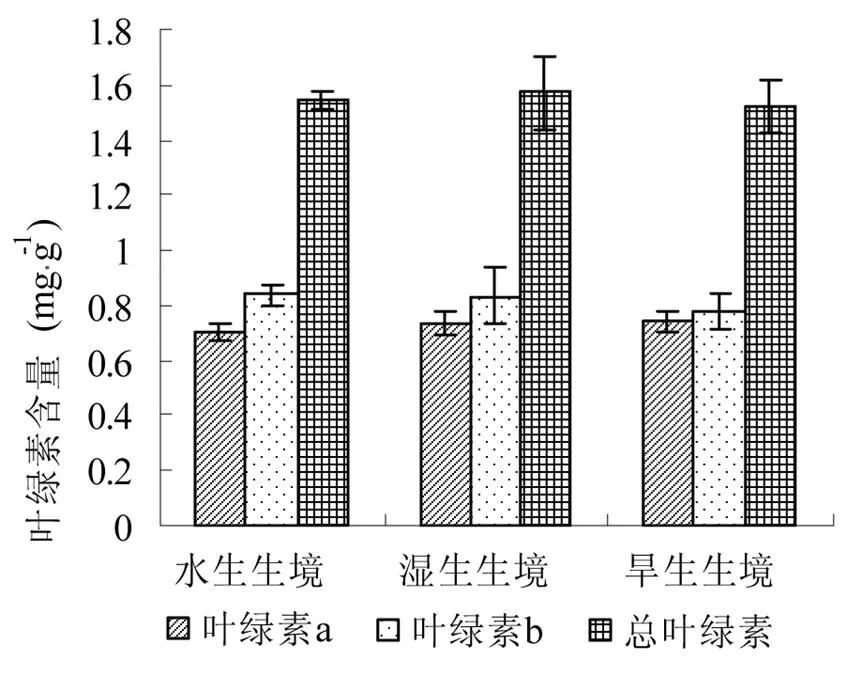
图4 不同生境下空心莲子草叶绿素含量
3 讨论
空心莲子草是偏湿生的两栖类植物,其生长和种群更新在很大程度上受到水分条件的影响[16],对水因子变化具有丰富的表型可塑性反应[9-11],甚至能够针对不同的水分环境产生相应的生态类型[15]。陶勇等[15]在人工栽培空心莲子草并控制其立地水分条件,使之形成旱生型、挺水型和漂浮型等3种生境类型,结果表明旱生型空心莲子草以地上部迅速占有空间的生长为主,其次是地下部生长;与旱生型空心莲子草相比,漂浮型的生长趋势中茎的增粗生长和根的数量生长上升到重要位置,然后才是茎与根的伸长生长;挺水型的第一位生长具有旱生型与漂浮型的双重特点。本研究的结果显示3生境中空心莲子草叶片长度、叶生物量和茎生物量均以旱生生境中为最低,表明旱生生境中空心莲子草地上生物量明显低于水生和湿生生境中的地上生物量。这与陶勇等[15]的结果不一致。一方面可能是因为在实验室控制条件下光照和土壤养分条件均一致,人工栽培的空心莲子草种群内部不存在资源的竞争,所以旱生型空心莲子草以地上部迅速占有空间的生长为主,地上生物量较大。而在野外生长的自然种群,空心莲子草的生长受到多种生态因子的综合影响,必然存在种间和种内竞争,旱生生境中由于资源的竞争,地上生物量会减少。有研究[17-18]表明空心莲子草的地上部生物量在含水量比较适宜的湿地中高于含水量比较较低(如旱地),这与本文的研究结果是一致的。另一方面可能是实验取样时间不同植物所处的生长期也不同,使得生物量分配出现差异。陶勇等[15]的实验是在冬季枯水季节进行的,而自然条件下很多草本植物在冬季均枯死,由于上层没有遮荫,空心莲子草会再次萌芽,从而增加地上生物量。
林金成和强胜[18]指出,湿地中生长的空心莲子草地上部生物量高于含水量比较高的生境(如水塘)。而本文的结果还表明空心莲子草叶片长度、叶生物量和茎生物量在水生生境中均高于湿生生境中,这与前人的研究结果不太一致。可能的原因是本研究选择的湿生生境是池塘的边缘,池塘岸边种植了大量的绿化植物,对空心莲子草有一定的遮荫作用,光照变弱,空心莲子草为了竞争光照,植株变高,叶面积变大[19],增加了对叶片和茎生物量的分配。同时,在湿生生境中空心莲子草叶片的叶绿素含量高于水生生境中的叶绿素含量,这也是因为在光照强度较弱的湿生生境中,空心莲子草叶绿素含量上升,这与前人的研究是一致的,陈银华和蒋健葴[19]的研究发现随着光照强度的减弱,植物叶片中叶绿素和类胡萝卜素的含量均显著增加。
3生境中空心莲子草的根冠比以旱生生境中为最高,湿生生境中次之,水生生境中最低,表明空心莲子草在水分可利用率低的生境中将生物量主要分配到地下根系,这一点与前人的研究结果相一致[17-18]。林金成和强胜[18]认为空心莲子草在土壤含水量较高的环境主要是通过地上部的分枝迅速达到种群的蔓延和扩散,而在比较干旱的环境中匍匐茎的分枝没有在含水量高的环境中那么旺盛,主要是通过地下根状茎及肉质状根发芽并长成植株来扩散种群。
综上所述,不同水分生境中空心莲子草自然种群的叶片长度、地上和地下生物量分配均不同,湿生生境中空心莲子草地上生物量明显高于旱生生境,水生生境又高于湿生生境。而空心莲子草地上匍匐茎是其营养繁殖的重要器官,一节根茎或是一小段肉质状根都可以发育成一棵完整的植株[16],所以水分对其入侵与扩散起了关键作用,潘晓云等[11]指出河流网络系统是空心莲子草传播扩散的重要载体,其生长和扩散都依赖流动水体。因此,用机械防除和人工防除不但不能控制空心莲子草蔓延扩散,反而助长了它大量繁殖。防除空心莲子草应该加强流域管理以控制空心莲子草的扩散,加强对空心莲子草繁殖特性的认识,尽量避免机械防除,减少人为传播[20]。
[1] Madhusoodanan P V, Kumar K G A.(Mart.) Griseb. - ‘alligator weed’ - a fast spreading weed in Kerala, south India[J]. Journal of Economic and Taxonomic Botany, 1993, 17(3):651-654.
[2] Julien M H, Skarratt B, Maywald G F. Potential geographical distribution of alligator weed and its biological control by Agasicles hygrophila[J]. Journal of Aquatic Plant Management, 1995, 33: 55-60.
[3] 林冠伦, 杨益众. 空心莲子草生物学及防治研究[J]. 扬州大学学报:农业与生命科学版, 1990, 11(2):57-62.
[4] 张格成, 李继祥, 陈秀华. 空心莲子草主要生物学特性研究[J]. 杂草科学, 1993, (2):10-12.
[5] 李振宇, 解焱. 中国外来入侵种[M]. 北京:中国林业出版社, 2002:50-53.
[6] 陈立立, 余岩. 何兴金喜旱莲子草在中国的入侵和扩散动态及其潜在分布区预测[J]. 生物多样性, 2008, 16 (6): 578-585.
[7] Kay S H, Haller W T. Evidence for the existence of distinct alligator weed biotypes[J]. Journal of Aquatic Plant Management, 1982, 20:37-41.
[8] Sosa A J, Julien M, Cordo H A. New research on alligator weed () in its South American native range. In: Proceedings of the XI International Symposium on Biological Control of Weeds [M]. CSIRO Canberra: Entomology, 2004, 180–185.
[9] 潘晓云, 梁汉钊, Sosa AJ, et al. 喜旱莲子草茎叶解剖结构从原产地到入侵地的变异式样[J]. 生物多样性, 2006, 14:232-240.
[10] Geng Y P, Pan X Y, Xu C Y, et al. Phenotypic plasticity rather than locally adapted ecotypes allows invasive alligator weed to colonize a wide range of habitats[J]. Biological Invasions, 2007, 9:245-256.
[11] Li J, Ye W H. Genetic diversity of alligator weed ecotypes is not the reason for their different responses to biological control[J]. Aquatic Botany, 2006,85:155-158.
[12] 潘晓云, 耿宇鹏, Sosa A J, et al. 入侵植物喜旱莲子草——生物学、生态学及管理[J]. 植物分类学报, 2007, 45(6):884-900.
[13] Julien M H, Broadbent J E. The biology of Australian weeds: Alternanthera philoxeroides (Mart.) Griseb[J]. Journal of the Australian Institute of Agricultural Science, 1980, 46:150-155.
[14] Buckingham G R. Biological control of alligator weed () - the world’s first aquatic weed success story[J]. Castanea, 1996, 61:232-243.
[15] 陶勇,陈少风,江明喜.空心莲子草对水分变化的形态适应研究[J]. 长江流域资源与环境, 2004, 13(5):454-459.
[16] Shen J Y, Shen M Q, Wang X H, et al. Effect of environmental factors on shoot emergence and vegetative growth of alligator weed ()[J]. Weed Science, 2005, 53: 471-478.
[17] 许凯扬, 叶万辉, 李静, 等. 入侵种喜旱莲子草对土壤水分的表型可塑性反应[J]. 华中师范大学学报:自然科学版, 2005, 39(1):100-103.
[18] 林金成, 强胜. 空心莲子草营养繁殖特性研究[J]. 上海农业学报, 2004, 20(4):96-101.
[19] 陈银华, 蒋健葴. 光照强度对辣椒光合特性与生长发育的影响[J].上海农业学报, 1998, 14(3): 46-50.
[20] 徐汝梅, 叶万辉. 生物入侵——理论与实践[M].北京: 科学出版社, 2003: 76-101.
A The phenotypic plasticity of Alternanthera philoxeroides to different water habitats
CAO Yu-song1, 2, XIAO Yi-an1, 2, ZHOU Bing1, 2,*HU Wen-jie1, 2
(1. School of Life Sciences, Jinggangshan University, Ji’an, Jiangxi 343009, China; 2. The Key Laboratory for Biodiversity Science and Ecological Engineering of Jiangxi Province, Ji’an, Jiangxi 343009, China)
Invasive plants showed strong phenotypic plasticity to the environmental factors. In the present paper, the phenotypic characteristics and the allocation of biomass and chlorophyll content ofin three habitats with different moisture conditions were studied. The results showed that the leaf length and leaf biomass and stem biomass ofin arid habitat were lower very significantly with the ground than that in the acquitic habitat and wetland habitat, respectively. The stem biomass was lowest in arid habitats following with that in wetland habitat and highest in aquatic habitat. The differences of the stem biomass between each habitat were not significant. The underground biomass was lowest in aquatic habitats following with that in wetland habitat and highest in arid habitat, and the differences between each habitat were very significant. Accordingly, the rates of root to crown were highest in arid habitats following with that in wetland habitat and highest in aquatic habitat. The contents of total chlorophyll in leaves were lowest in arid habitats following with that in aquatic habitat and highest in wetland habitat. However, the contents of chlorophyll a in leaves were highest in arid habitats and lowest in in aquatic habitat. And the differences between each habitat were not significant.
biological invasions;; phenotypic plasticity; habitat.
1674-8085(2012)03-0102-05
S555+.2
A
10.3969/j.issn.1674-8085.2012.03.023
2012-03-30;
2012-04-12
井冈山大学博士启动基金项目(JZ10041);江西省生物学高水平学科建设资助项目
曹裕松(1978-),男,江西瑞昌人,讲师,博士,主要从事保护生物学、恢复生态学研究(E-mail: caoyusongrc@yahoo.cn );
肖宜安(1968-),男,江西永丰人,教授,博士,硕士生导师,主要从事生物多样性研究(E-mail: iyanxiao@yahoo.cn );
周 兵(1977-),男,湖北黄梅人,副教授,博士,主要从事外来生物入侵研究(E-mail:zhoubing113@yahoo.com.cn)
*胡文杰(1974-),男,江西吉安人,讲师,博士,主要从事植物资源开发研究(E-mail: huwenjie2008@126.com )
