重组抗菌肽海藻酸钠微囊制备与体外释放特征研究
2012-03-14张守庆王宝杰姜蒋克勇刘梅王
张守庆,王宝杰姜 珊,蒋克勇刘 梅王 雷
(1.中国科学院 海洋研究所,山东 青岛 266071;2.中国科学院 研究生院 北京 100049)
抗菌肽(Antimicrobial peptides,AMP)是生物体免疫系统产生的一类小分子生物活性物质,对真菌、细菌、病毒等病原微生物具有非特异性抑制或杀灭作用,广泛存在于生物体中。随着对水产动物抗菌肽的分离、结构与功能的研究[1-4],利用水产动物抗病功能基因构建相应的表达载体,实现重组抗菌肽的高效表达,克服了天然抗菌肽来源有限、化学合成成本高、批量生产困难等不足。然而,直接口服抗菌肽极易被生物体内的酶分解,其生物活性也随之消失,使其在水产养殖疾病预防和治疗领域受到很大程度的限制[5-6]。
建立蛋白类药物的有效经口导入途径成为研究热点,通过可生物降解的微囊系统给药,不仅可以防止药物在体内很快降解,还可以达到缓释/控释目的[7]。肖东等[8]研制的肠溶微囊式鲤鱼生长激素(rcGH)促生长剂投喂胡子鲶,采用酶联免疫吸附测定法和酶联免疫吸附受体测定法检测,结果发现肠溶胶囊对rcGH起到保护作用;余俊红等[9]制备的全细胞疫苗和微胶囊疫苗口服免疫鲈鱼鱼苗,攻毒后,微囊组的死亡率较低;Romalde等[10]对非胶囊和微囊化的口服疫苗对虹鳟格氏乳球菌病的免疫保护作用进行了评价,结果表明微囊化的疫苗具有较好的保护作用。
抗菌肽作为饲料添加剂在畜禽和水产养殖中取得了一定的成果,但直接口服抗菌肽其生物利用度低。本研究是将基因工程发酵生产的海洋生物重组抗菌肽——对虾素 3-2,亲和层析分离纯化后,以乳化凝聚法制备重组抗菌肽海藻酸钠肠溶性微囊,不仅能够提高抗菌肽的稳定性,有效的防止胃液对重组抗菌肽的破坏,而且能够实现控制释放,使重组抗菌肽长效的发挥作用,为抗菌肽类制剂通过口服途径应用于养殖中的疾病防治提供了可能。
1 材料与方法
1.1 材料及主要试剂配制
重组抗菌肽发酵液,本实验室制备的毕赤酵母表达的对虾素3-2(GenBank登录号为DQ308408)。
分离纯化平衡缓冲液:20 mmol/L磷酸盐缓冲液,500 mmol/L NaCl,20 mmol/L咪唑,使用0.45 μm滤膜真空抽滤,pH7.4。
分离纯化洗脱缓冲液:20 mmol/L磷酸盐缓冲液,500 mmol/L咪唑,使用 0.45 μm 滤膜真空抽滤,pH 7.4。
模拟胃液:取稀盐酸 16.4 mL,加超纯水约 800 mL,再加入胃蛋白酶 10 g,搅拌均匀后调节 pH至2.0,然后容量瓶定容至1000 mL。
模拟肠液:取磷酸二氢钾6.8g加超纯水500 mL溶解,另外将 10 g胰蛋白酶溶解与适量超纯水中,将两者混匀后,用0.1mol/L的氢氧化钠溶液调节pH值至7.8,容量瓶定容至1 000 mL。
1.2 重组抗菌肽的分离纯化与纯度检测
重组抗菌肽在毕赤酵母表达体系中大量发酵表达,发酵液经4℃,12 000 r/min,离心20 min后取上清,上清液经过0.22 μm的滤膜过滤。根据重组抗菌肽含有His标签选用Ni2+亲和层析进行分离纯化。先用平衡缓冲液饱和,将重组抗菌肽上清液上柱吸附,再用洗脱缓冲液洗涤,收集合并活性峰组分。纯化的重组抗菌肽样品,通过考马斯亮蓝试剂盒测定浓度,上样量20 μL,Tricine-SDS-PAGE(15.5%)40V冰浴电泳过夜,考马斯亮蓝染色,检测纯化后重组抗菌肽的纯度。
1.3 微囊的制备方法
在室温(25℃±1℃)下,取氯化钙溶液在磁力搅拌器上搅拌,用注射器逐滴滴入含重组抗菌肽(总量为G)的海藻酸钠溶液,即可得到白色凝胶状固体,继续在溶液中孵育(室温)15 min左右,将微囊用纯水洗涤后过滤分离,冷冻干燥48 h[11]。
1.4 微囊粒径的测定与形态表征
随机选取制备好的微囊(n>30)紧密排成一排,用游标卡尺测量[12],重复 3次,求其平均值作为每粒粒径,同时观察和记录肠溶性微囊的形状及其圆整度。粒径计算公式为D=∑Di/n。
1.5 微囊包封率的测定
按照1.3方法制备好微囊后,将反应剩余液倒入量筒,量其体积V,再用Bradford法测定蛋白质浓度C。按照公式:包封率E= (G-CV)/G×100%计算微囊包封率。式中G代表制备微囊时加入的重组抗菌肽的总量,CV代表制备微囊时未被包封的重组抗菌肽的量。
1.6 微囊制备工艺的研究
考察氯化钙的浓度、海藻酸钠的浓度对制备微囊影响。选取氯化钙浓度的三个水平(1.0%,1.5%,2.0%)和海藻酸钠的3个水平(1.0%,1.5%,2.0%),每个试验处理重复 3次,分别制备重组抗菌肽海藻酸钠微囊,观察不同水平对微囊成型的影响,选择微囊成型速度快,粒径圆整,包封率较高的为最优制备工艺。
1.7 重组抗菌肽海藻酸钠微囊的体外释放
采用最佳工艺制备的抗菌肽海藻酸钠微囊,等比例分为两份,分别置于盛有 30 mL的模拟胃液(pH 2.0)和模拟肠液(pH 7.8)的三角瓶中,于 28.0℃±0.5℃恒温摇床中震荡,震荡速度为90 r/min,定时取出一定量的释放液样品,再补加入等量的模拟胃液和模拟肠液。Bradford法测定样品中的重组抗菌肽含量,从而绘出释放曲线。
2 结果与分析
2.1 重组抗菌肽的纯化结果
重组抗菌肽纯化样品电泳结果见图1。在 5.8 kDa处,纯化前后的重组抗菌肽样品都有一条比较清楚的带,与重组抗菌肽的分子质量一致。同等上样量和电泳条件下,纯化后的重组抗菌肽较纯化前杂带减少,表明其纯度有所提高;但其蛋白浓度也相对降低,表明在纯化过程中重组抗菌肽部分损失。

图1 重组抗菌肽纯化样品的Tricine-SDS-PAGE电泳图Fig.1 Tricine-SDS-PAGE profile of purified recombinant AMP
2.2 重组抗菌肽海藻酸钠微囊的制备工艺
根据实验结果,当氯化钙的浓度低于 1.5%时,形成的微囊凝胶膜较薄,硬度较低,冷冻干燥后圆整度较低;但随着氯化钙浓度的增大,包封率逐渐降低,同时考虑到高浓度的氯化钙会对固定生物分子有破坏作用,因此氯化钙的浓度在 1.5%为宜。而海藻酸钠浓度低于 1.0%时微囊的成型性能差;当浓度提高到 1.5%时,可以得到圆整光滑的微囊;海藻酸钠的浓度增大,得到的海藻酸钠微囊的包封率越高,故选取海藻酸钠的浓度为2.0%。如表1所示。
根据上述实验结果,选取氯化钙的浓度 1.5%和海藻酸钠的浓度2.0%作为重组抗菌肽海藻酸钠微囊的最优制备条件。

表1 氯化钙浓度和海藻酸钠浓度对微囊的形态和包封率的影响(平均值±标准误差,n=3)Tab.1 Effects of calcium chloride concentration and sodium alginate concentration on the morphology and encapsulation rate of microcapsules(mean±SD,n=3)
2.3 微囊的包封率和粒径
在所选取的最优制备条件下,可得到光滑圆整的重组抗菌肽海藻酸钠微囊,冷冻干燥后的微囊直径约为1.1 mm,包封率为83.87%。

图2 重组抗菌肽海藻酸钠微囊的粒径Fig.2 The size of recombinant AMP sodium alginate microcapsules
2.4 微囊的体外释放情况
随着重组抗菌肽在模拟胃液中的释放,溶出液中的重组抗菌肽的浓度逐渐升高,大约2 h之后趋于稳定,约为14%,如图3所示。说明重组抗菌肽在模拟胃液中的溶出程度很小,表明重组抗菌肽海藻酸钠微胶囊对酸性环境不敏感(pH 2.0),可以耐受胃酸的破坏。

图3 海藻酸钠微囊在模拟胃液中的释放曲线(pH 2.0)Fig.3 In vitro releasing curve of sodium alginate microcapsules in simulated gastric fluid (pH 2.0)
重组抗菌肽海藻酸钠微囊在模拟肠液中的释放速度和释放量明显增大,5 h时重组抗菌肽释放量达到98%,如图4所示。比较图3和图4可知,重组抗菌肽在模拟肠液中的释放速度和释放量远远大于在模拟胃液中。因此可认为采用海藻酸钠为肠溶性壁材制得的微囊确实具有肠溶性,使重组抗菌肽在口服时可以减少胃液中胃酸的破坏。
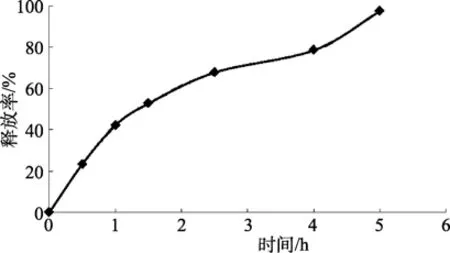
图4 海藻酸钠微囊在模拟肠液中的释放曲线(pH 7.8)Fig.4 In vitro releasing curve of sodium alginate microcapsules in simulated intestinal fluid (pH 7.8)
3 讨论
近年来,水产品安全问题备受关注。然而,由于高密度、工厂化、集约化养殖模式的建立和推广,盲目追求产量效益的同时导致病害问题逐年增加,抗生素等药物的过度使用,不仅造成水环境的污染,而且导致部分水产动物耐药性增加并在其体内残留,严重影响了水产品安全和出口,给我国的水产养殖业造成了巨大的经济损失[13]。因此开发和研究环境友好型、无公害新型渔药成为发展趋势。
抗菌肽具有广谱抗菌活性。重组抗菌肽作为饲料添加剂对肉鸡生长[14]、仔猪腹泻[15]有较好的效果。目前,抗菌肽用于水产养殖生产的应用研究较少。姜兰等[16]将重组酵母表达的重组抗菌肽浓缩干燥后,添加到饲料中,对中华鳖红鼻子病、赤斑病、穿孔病等一些常见病害具有一定的防治效果;陈冰等[17]通过 8周的生长实验研究了在饲料中添加家蝇幼虫抗菌肽提取物对凡纳滨对虾的影响,结果表明,添加适量的抗菌肽对其具有一定的促生长作用,并能提高对虾的免疫相关指标;王广军等[18]研究了抗菌肽在南美白对虾养殖中的应用效果,结果表明,在饲料中添加抗菌蛋白,无论是日生长速度、相对增重率、饲料系数、成活率,还是抗病力方面均显著提高;黄自然等[19]研究抗菌肽饲养南美白对虾的效果,在饲料中添加抗菌肽,结果表明抗菌肽有利于对虾的孵化。抗菌肽对水产动物具有促生长、保健和治疗疾病的功能,属于无毒副作用、无残留、无致细菌耐药性的一类环保型制剂。本研究中通过亲和层析对重组抗菌肽进行分离纯化,获得高纯度的重组抗菌肽,为进一步研究抗菌肽的抗菌活性奠定了基础。
目前,由于海藻酸钠凝胶具有良好的生物相容性、对生物组织无免疫原性、可生物降解等优点可用作新型药物的载体,既能保证抗菌肽的活性又能实现控制释放[20-21]。在制备重组抗菌肽海藻酸钠微囊的过程中,氯化钙的浓度和海藻酸钠的浓度对微囊的包封率有显著影响。当海藻酸钠与 Ca2+反应形成微囊时,随着海藻酸钠的浓度的增加,其包封率逐渐增大,与高春凤等[22]的研究结果一致;当氯化钙的浓度过低,钙离子与海藻酸钠交联不完全,成囊效果差,影响了包封率,随着氯化钙浓度的增加,包封率先变大后变小[23],本研究中随着氯化钙的浓度增加,包封率降低,说明钙离子与海藻酸钠交联完全。海藻酸钠还可以与氯化钡、聚赖氨酸、壳聚糖等为壁材[24],采用膜乳化等新型技术制备复合型微囊[25],通过方法的改进和各项参数的优化进一步提高微囊的稳定性,最大限度的保持生物活性物质的活性。
本研究利用海藻酸钠制备了具有肠溶性的重组抗菌肽海藻酸钠微囊,能够使重组抗菌肽在水产动物的胃中释放较少,并在其肠道中大量释放,从而起到抑菌杀毒的作用。目前多肽和蛋白类药物常用的给药途径通常是注射或浸泡,但在水产养殖中浸泡法免疫有效期较短,往往需同时提高渗透压或使用各种佐剂等;而注射法仅适用于较大规格的养殖动物且工作量大,不适应大规模使用[26];而口服给药是最简单和最方便的给药方式,对水产动物无损伤,操作方便,不受时间、地点、生长阶段的限制,但由于多肽和蛋白质自身特性,直接口服后会被胃蛋白酶、胰蛋白酶等降解成小分子氨基酸,其生物活性也随之消失,而将多肽和蛋白类药物制成微粒系统给药,不仅能有效的防止药物在体内很快降解,提高其生物利用度,还能将药物缓慢释放并靶向给药。肠溶性微囊的研究为以后抗菌肽在水产动物疾病预防与治疗方面实现口服给药提供了实验基础。
[1]于道德,宁璇璇,任贵如,等.贻贝抗菌肽的研究进展[J].海洋科学,2009,33(11):95-99.
[2]Munoz M,Vandenbulcke F,Gueguen Y,et al.Expression of penaeidin antimicrobial peptides in early larval stages of the shrimp Penaeus vannamei[J].Developmental and Comparative Immunology,2003,27(4):283-289.
[3]Destoumieux D,Munoz M,Cosseau C,et al.Penaeidins,antimicrobial peptides with chitin-binding activity,are produced and stored in shrimp granulocytes and released after microbial challenge[J].Journal of Cell Science,2000,113(3):461-469.
[4]Destoumieux D,Bulet P,Loew D,et al.Penaeidins,a new family of antimicrobial peptides isolated from the shrimp Penaeus vannamei (decapoda)[J].Journal of Biological Chemistry,1997,272(45):28398-28406.
[5]Schep L J,Tucker I G,Young G,et al.Controlled release opportunities for oral peptide delivery in aquaculture[J].Journal of Controlled Release,1999,59(1):1-14.
[6]Sarmento B,Ribeiro A,Veiga F,et al.Oral bioavailability of insulin contained in polysaccharide nanoparticles[J].Biomacromolecules,2007,8(10):3054-3060
[7]王丹.多肽及蛋白类药物微球的载体材料、制备以及突释现象[J].中国组织工程研究与临床康复, 2008,12(10):1931-1934.
[8]肖东,陈松林.肠溶微囊式重组鲤生长激素促生长剂的研制[J].动物学研究,2002,23(6):449-455.
[9]余俊红,沈继红.鳗弧菌口服微胶囊疫苗的制备及其对鲈鱼的免疫效果[J].中国水产科学,2001,8(2):76-79.
[10]Romalde J L,Luzardo-Alvarez A,Ravelo C,et al.Oral immunization using alginate microparticles as a useful strategy for booster vaccination against fish lactoccocosis[J].Aquaculture,2004,236(1-4):119-129.
[11]石晓丽,徐军,张雪梅,等.干扰素壳聚糖/海藻酸钠微囊控释制剂载体的初步研究[J].中国生物制品学杂志,2007(2):117-118.
[12]吕慧侠,周建平,戴影秋,等.海藻酸钙掩味微囊的制备[J].中国药科大学学报,2007,38(2):125-128.
[13]吴淑勤.加强水产养殖病害防治保障水产养殖业可持续发展[J].中国水产,2006(1):13-14.
[14]温刘发,何丹林,张常明,等.抗菌肽酵母制剂的生产及其作饲料添加剂应用价值的探讨[J].广东蚕业,2001(2):34-36.
[15]温刘发,张常明,付林,等.抗菌肽制剂代替抗生素在断奶仔猪饲粮中的应用效果[J].中国饲料,2001(18):13-14.
[16]姜兰,黄自然.重组抗菌肽的制备及其对水产养殖中常见病原菌的抑菌效果[J].中国水产科学,2002,9(2):152-156.
[17]陈冰,曹俊明,陈平洁,等.家蝇抗菌肽对凡纳滨对虾生长性能及免疫相关指标的影响[J].中国水产科学,2010,17(2):258-266.
[18]王广军,谢骏,余德光.抗菌蛋白在南美白对虾养殖中的应用试验[J].饲料工业,2005,26(8):33-34.
[19]黄自然,黄亚东,温刘发,等.抗菌肽生物工程及其应用[J].蚕业科学,2005(4):375-381.
[20]王丹.多肽及蛋白类药物微球的载体材料、制备以及突释现象[J].中国组织工程研究与临床康复,2008,12(10):1931-1934.
[21]付加雷,宋长征,张更林.干扰素-tau微囊的制备工艺优化[J].中国生化药物杂志,2007(6):378-381.
[22]高春凤,赵秀丽,李新刚,等.雷公藤多苷提取物壳聚糖-海藻酸钠缓释微球的制备及体外释放研究[J].中国药剂学杂志(网络版),2009(5):382-390.
[23]刘欣,郭星尧,韩亚,等.海藻酸钠为囊材锐孔法制备铁叶绿酸钠微囊[J].现代食品科技,2009(9):1043-1045.
[24]孙雪,奚廷斐.海藻酸钠微囊制备方法及应用的研究[J].生物医学工程与临床,2005,9(6):369-376.
[25]Zhang Y,Wei W,Lv P,et al.Preparation and evaluation of alginate-chitosan microspheres for oral delivery of insulin[J].European Journal of Pharmaceutics and Biopharmaceutics,2011,77(1):11-19.
[26]李珊珊,黄倢,田黎.鱼类口服疫苗的研究进展[J].海洋湖沼通报,2007(B12):189-194.
