刺参肠道与养殖池塘环境中异养细菌和弧菌数量周年变化
2012-03-14荣小军廖梅杰王印庚刘智超薛太山
李 彬,荣小军,廖梅杰,张 正,王印庚,王 岚,刘智超,3,薛太山
(1.中国水产科学研究院 黄海水产研究所,青岛市海水鱼类种子工程与生物技术重点实验室,山东青岛266071;2 .青岛瑞滋海珍品发展有限公司,山东青岛266409;3.中国海洋大学,山东青岛 266100)
近年来,刺参养殖业发展迅速,成为中国北方主要的养殖品种之一,随着刺参养殖规模的不断增加,各种病害接踵而至,严重制约了该产业的健康和持续发展[1],其中“腐皮综合征”最为严重,死亡率可达90%以上[2],该病的发生具有季节性,一般在冬、春低温季节爆发[3],低温季节刺参处于冬眠时期,很难用药物投喂的方式进行疾病的预防和治疗,从生态学角度入手,掌握该病发病原因是进行预防的关键。
刺参属底栖食性生物,主要以栖息环境中微生物、原生动物、微藻、大型藻类碎片、有机碎片、海泥等为食[4],摄入的食物复杂,其中也包括一些病原微生物。养殖环境中菌群变化直接影响着刺参肠道内细菌群落组成,与疾病的发生密切相关。因此,研究刺参肠道与养殖池塘环境中细菌数量的周年变化,掌握细菌数量的变化规律对疾病的预防尤为重要。迄今尚未见刺参肠道与养殖池塘环境中细菌数量周年变化的报道。本文通过对刺参肠道和养殖环境异养细菌和弧菌数量的周年变化及刺参疾病多发季节优势菌的鉴定,为刺参肠道与养殖环境细菌的相关性分析和病害防控提供有益参考。
1 材料和方法
1.1 采样时间及地点
2008年9月~2009年9月,每个月定期对青岛胶南市室外刺参肠道与养殖池塘环境中细菌数量进行调查,采样坐标北纬 35°39′,东经 119°50′,采样选 3个池塘,池塘长400 m、宽100 m、水深1.8 m,每个池塘设立3个采样点。
1.2 样品采集
利用调查船驶到池塘中预先标记好的采样点,按照《国家海洋调查规范》海洋生物调查中规定的方法进行采样,使用击开式采水器(2.5 L)采集水体表层(距水面约5cm)、水体底层(距底表5cm)水样;用采泥器采集池塘表层底泥,每个池塘取 9片瓦状附着基(每个采样点3片),用无菌勺刮取刺参附着基上的沉积物,放入无菌袋中,每个池塘采集9头刺参(每个采样点 3头),无菌操作下取完整肠道用镊子轻轻挤出内容物,样品采集后4℃保存,在12 h内处理。
1.3 细菌计数方法
1.3.1 可培养异养细菌总数(HPC)
对样品进行梯度稀释,取 0.1 mL直接涂布于TSB海水培养基上,28℃培养2 d计数,选取平均菌落数在 30~300之间的平板计数,计数菌落形成单位数(Colony Forming Units ,CFU)。
TSB培养基:胰蛋白胨大豆肉汤(TSB) 30 g,NaCl 15 g,琼脂 15 g,海水 1 000 mL,pH 7.4~7.6,121℃,20 min灭菌。
1.3.2 弧菌总数(VBC)
对样品进行梯度稀释,取 0.1 mL直接涂布于TCBS弧菌培养基上,28℃培养2 d计数,计数方法与异养细菌总数计数方法相同。
1.4 细菌鉴定
1.4.1 细菌基因组DNA提取方法
将细菌接种在 TSB平板培养基上,28℃培养过夜。取单菌落悬浮于50 μL 无菌生理盐水(1.5%)中,100 °C水浴5 min,12 000 r/min离心5 min,取上清备用。
1.4.2 16S rDNA序列的克隆与测序
用细菌通用引物 27F(5’-AGAGTTTGATCATGGCTCAG-3’)和 1492R(5’-AAGGAGGTGATCCAGCCGCA-3’)对纯培养细菌16S rDNA序列进行PCR扩增,并对扩增产物进行克隆测序。
1.4.3 序列的分析和系统发育树的构建
16S rDNA序列在NCBI中用BLAST进行同源性比较,从中选取与其相似性最高的细菌16S rDNA序列,采用Clustalw软件进行多序列匹配排序,用系统发生推断软件包PHYLP 3.67进行聚类分析。采用邻位相连法获得系统发育树,通过自举进行系统进化树的评估,自举的数据集为1 000次。
2 结果
2.1 刺参肠道与养殖池塘环境中细菌数量周年变化
刺参肠道与养殖池塘环境中异养细菌数量同期差异较大如图1,水体表层异养细菌为 90~4.1×104CFU/mL,水体底层异养细菌为 1.04×102~1.37×105CFU/mL,底泥异养细菌为 9.80×104~6.72×106CFU/g,附着基异养细菌为 2.78×105~2.57×107CFU/g,肠道中异养细菌为 1.85×105~2.17×109CFU/g,同期水体中水底异养细菌数量高于水表,但差异不大。水体与底泥、附着基、肠道中异养细菌数量差异显著,最高可达3个数量级,其中,肠道内异养细菌数量最高,其次是附着基、底泥。从时间分布上,刺参肠道与养殖环境中异养细菌数量的变化趋势基本相同,秋季、夏季异养细菌数量较高,冬、春季较低。在 10月份、7月份分别达到高峰,水体中6月份、7月份细菌数量有下降趋势。随着季节的变化,底泥中异养细菌数量变化幅度较小,水体、附着基、刺参肠道中异养细菌的数量变化幅度较大。

图1 刺参肠道与养殖池塘环境中异养细菌数量周年变化Fig.1 Annual changes of heterotrophic bacteria in the intestine and cultured environment of A.japonicus
2.2 刺参肠道与养殖池塘环境中弧菌数量周年变化
刺参肠道与养殖池塘环境中弧菌数量同期差异较大如图2,养殖水体表层弧菌数量为 11~2.4×103CFU/mL,水体底层弧菌数量为19~5.3×103CFU/mL,底泥中弧菌数量为 1.01×104~5.75×105CFU/g,附着基弧菌数量为 4.6×104~1.31×107CFU/g,刺参肠道中弧菌数量为 4.1×104~2.2×108CFU/g。刺参肠道与养殖池塘环境中弧菌数量同期比较与异养细菌一致:肠道>附着基>底泥>水底>水表。从时间分布上看,弧菌数量的周年变化趋势和异养细菌的变化趋势相似。在1~4月份,水体和刺参肠道中弧菌数量开始急剧上升,刺参肠道和附着基弧菌数量在 7月份达到最高值,水体和底泥中弧菌数量在10月份达到最高值。底泥中弧菌数量季节变化幅度较小,水体、附着基、刺参肠道中弧菌数量变化幅度较大。
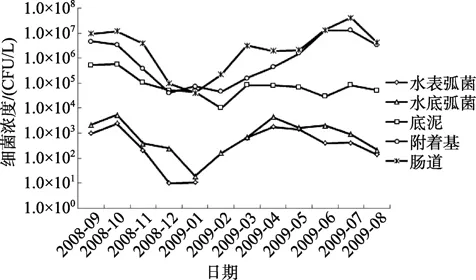
图2 刺参肠道与养殖池塘环境中弧菌数量周年变化Fig.2 Annual changes of vibrio bacteria in the intestine of A.japonicus and cultured environment
2.3 刺参肠道与养殖环境中弧菌占异养了细菌比例的周年变化
由刺参肠道与养殖环境(水体、底泥、附着基)中弧菌与异养细菌数量的比值可以看出,底泥、附着基、肠道中弧菌与异养细菌数量的比例平均水平高于水体。冬季和春季细菌总数较低,而弧菌与异养细菌的比值一直处于较高的水平,其中底泥1月份和4月份最高可达43.8%、43.2%,9月份、10月份虽然细菌总数较高,而弧菌与异养细菌的比值处于较低的水平,如图3。

图3 养殖肠道与环境中弧菌与异养细菌数量的比值Fig.3 The ratio of vibrio to heterotrophic bacteria in the cultured environment and intestinal tract
2.4 冬、春季节优势细菌 16S rDNA分子鉴定
利用平板培养的方法从弧菌比值较高的冬、春季节分离了 8株优势菌,并进行16S rDNA测序,8株菌所测得的序列结果通过互联网 NCBI,在Genbank采用BLAST程序与其他细菌的16S rDNA序列进行比对,找出相似性高的序列构建系统进化树(图4),优势菌鉴定为:施氏假单胞菌(Pseudomonas stutzeri)、门多萨假单胞菌(P.mendocina)、蜡状芽孢杆菌(Bacillus cereus)、灿烂弧菌(Vibrio splendidus)、Shewanella affinis、杀鲑弧菌(V.salmonicida)、S.kaireitica,同源性在 99%以上。所测得的8株优势菌其中有7株菌属于变形菌门的γ-变形菌纲,1株为芽孢杆菌。冬、春两季优势菌均发现有灿烂弧菌。

图4 优势菌16S rDNA基因序列聚类分析结果Fig.4 Results of 16S rDNA cluster analysis
3 讨论
3.1 刺参肠道与养殖环境(水体、底泥、附着基)中细菌数量周年变化
刺参养殖塘营养结构简单、食物链短,养殖过程中投饵、养殖动物排泄物和有机生物残体等物质的分解容易造成水体污染[5],为了保持刺参养殖塘中良好的水质条件,养殖期间定时的大量换水,水体透明度比较高,水体表层有机物质含量较少,细菌总数也相对较少,底层水体中细菌总量还受底泥表层细菌的影响,水体底层细菌数量显著高于表层,与张振飞等[6]锯缘青蟹养殖环境中细菌数量和类群变化的结果一致,底层与表层水温的差异也是底层细菌数量高于表层的原因之一。
附着基是细菌繁殖的有利场所,在附着基上有大量的底栖生物附着,生物量非常丰富,因此,本研究结果表明,附着基细菌量比较丰富,细菌数量在105~108CFU/g,李筠等[7]对海湾扇贝附着基异养细菌的数量进行了研究,其海湾扇贝附着基异养细菌数量与本研究有一定的差异,可能是海湾扇贝幼虫在附着基上的代谢产物或者分泌的特殊物质有利于细菌的大量生长和繁殖。刺参养殖池塘底泥中含有大量的刺参排泄物、残饵以及一些大型藻类的残体,这种环境非常适宜细菌的生长繁殖,因此在底泥中滋生大量细菌。刺参摄食无选择性[8],在池塘底层摄入大量的底泥、有机物质以及大量的细菌,加之刺参的肠道中有稳定的细菌菌群辅助消化[9],肠道中细菌数量较多。
影响刺参肠道与养殖环境中菌群变化的因素有水温、无机营养盐、水体中浮游生物及其刺参的摄食活动情况。细菌数量的变化趋势和水温的变化一致,温度对大多数异养细菌的新陈代谢能力产生一定影响,是造成细菌季节变化的主要因素[10],水温还能影响刺参摄食和生理活动,间接影响刺参肠道与养殖环境中菌群的变化。秋季9月份水温20℃左右,刺参结束夏蛰开始活动摄食,10月份水温18 ℃左右,刺参摄食、活动活跃,池塘沉积物中有大量的刺参排泄物,为细菌的增长提供了营养物质,此时期还是投饵的主要时段,未被摄食的残饵也促进了细菌的增殖,细菌数量较多。11月份水温较低,刺参开始冬眠,细菌代谢活动、繁殖能力较弱,细菌数量开始下降,冬季 12月份水温在 6℃左右,刺参处于冬眠时期,低温条件抑制了细菌的生长和有机物质的分解,细菌的含量显著低于11月,1月份水温2 ℃,细菌数量达到最低。3月份或4月份随着温度的回升,细菌数量增加较显著,6月份、7月份水体表层中细菌数量有所下降,可能是受水温或者水体有机物的影响。
3.2 刺参疾病多发季节(冬、春季)优势菌分析
冬、春季弧菌数量与异养细菌数量比例较高,特别是在3、4月份比例显著增高,说明刺参池塘部分弧菌具有耐受低温能力,通过优势菌的鉴定,冬、春季节均发现有灿烂弧菌,灿烂弧菌是引起养殖刺参“腐皮综合征”的主要病原菌,该株细菌能够在温度较低的环境中生长,与王印庚等[3]养殖刺参腐皮综合征病原菌的分离与鉴定的研究结果一致。冬、春季节养殖环境与肠道中优势菌还存在假单胞菌、芽孢杆菌,其分析结果与近年来国内外有关海洋微生物多样性的报道一致[11-12]。正常情况下,刺参肠道中的灿烂弧菌与芽孢杆菌等处于一种平衡状态,在低温状态下,刺参抵抗力较弱,环境变化容易使细菌菌群平衡遭到破坏,部分低温致病菌繁殖迅速,从而引发疾病[13]。
生态养殖是渔业可持续发展的重要保证[14],利用益生菌来改善养殖环境、调节养殖动物肠道中菌群组成[15-16],从生态学角度入手,预防疾病的发生,为水产养殖业朝着绿色健康养殖的方向发展提供新的途径[17]。冬、春低温季节是刺参疾病的多发季节,多数水产微生态是从陆生动物养殖环境和肠道中分离获得[18],不耐受低温,不适于刺参养殖环境,因此,从刺参疾病多发的低温季节筛选土著益生菌,更有利于疾病的防控。本研究在冬、春季节发现有蜡状芽孢杆菌,有报道蜡状芽孢杆菌可以维持动物肠道中微生态平衡和恢复肠道正常菌群的作用[19-20],该菌能够耐受低温,并且是刺参肠道和养殖环境中的土著菌,能够更好地适应低温刺参养殖环境,可以作为潜在的益生菌应用于低温疾病多发季节的疾病预防。
[1]张春云,王印庚,荣小军,等.国内外海参自然资源、养殖状况及存在问题[J].海洋水产研究,2004,25(3):89-97.
[2]孟庆国,吴刘记,吴信忠,等.养殖刺参溃疡病病原学研究[J].水产科学,2006,25(12):635-639.
[3]张春云,王印庚,荣小军.养殖刺参腐皮综合征病原菌的分离与鉴定[J].水产学报,2006,30(1):119-122.
[4]田传远,李琪,梁英.刺参健康养殖技术[M].青岛:中国海洋大学出版社,2008:20-21.
[5]王印庚,荣小军.我国刺参养殖存在的主要问题与疾病综合防治技术要点[J].齐鲁渔业,2004,21(10):29-31.
[6]冯振飞,王国良,钱冬,等.锯缘青蟹养殖环境中细菌类群及其数量分布[J].水产科学,2008,27(11):564-577.
[7]李筠,纪伟尚,等.海湾扇贝附着基异养细菌区系初探[J].青岛海洋大学学报,2001,31(1):69-74.
[8]于东祥,孙惠玲,陈四清,等.海参健康养殖技术[M].北京:海洋出版社,2005:152-153.
[9]Clifford C,Walsh J,Reidy N,et al.Digestive enzymes and subcellular localization of disaccharidases in some echinoderms[J].Comp Biochem Physiol,1982,71B:105-110.
[10]姚雪梅,王红勇,邢少雷,等.不同水温和水质理化因子对糙海参摄食、生长影响研究[J].水产科学,2007,26(5):292-295.
[11]Li L.Kato C.Horikoshi K.Microbial diversity in sediments collected from the deepest cold—seep area,the Japan Trench[J]. Biodivers Conserv,1999,8:659-677.
[12]王鹏,李涛,等.南海北部陆坡深水区沉积物细菌多样性调查[J].海洋科学,2008,32(4):36-39.
[13]李彬,荣小军,廖梅杰,等.冬季刺参养殖环境与肠道内细菌菌群的研究[J].海洋科学,2010,34(4):64-69.
[14]李维炯,倪永珍,李翎,等.微生态制剂的应用研究[M].北京:化学工业出版社,2007:90-127.
[15]李海兵,宋晓玲,李赟,等.水产动物益生菌研究进展[J].动物医学进展,2008,29(5):94-99.
[16]张汉华,李卓佳,郭志勋,等.益生菌对海水虾池浮游生物的生态调控效果研究[J].海洋科学,2009,33(1):12-20.
[17]闫茂仓,林志华,刘连生,等.枯草芽孢杆菌对泥蚶及养殖底泥中细菌总数和弧菌总数的影响[J].海洋科学,2009,33(10):36-39.
[18]Gatesoupe F J.The use of probiotics in aquaculture[J].Aquaculture,1999,180:147-165.
[19]陈顺,徐国华,张翠霞,等.腊状芽孢杆菌 LW9809芽孢生成条件及发酵代谢产物研究[J],微生物学杂志,2004,24(3):60-61.
[20]王福强,李坤,邵占涛,等.产蛋白酶益生菌Y2-2和Y1-13对牙鲆幼鱼生长促进作用的研究[J].海洋科学,2005,29(1):29-33.
