干旱胁迫下4种委陵菜属植物叶片的超微结构
2012-03-13吴建慧崔艳桃赵倩竹
吴建慧,崔艳桃,赵倩竹
(东北林业大学园林学院,黑龙江 哈尔滨 150040)
委陵菜属(Potentilla)植物是蔷薇科一年生或多年生植物,花色艳丽、枝条鞣韧、株型美观,具有一定的观赏价值,并且具有较强的抗旱、抗寒性,容易栽培和管理,生态适应性较强,是退化草地或次生演替地的先锋物种之一[1]。近年来,委陵菜属植物因其具有自然性、原生性、抗逆性强、可粗放管理等特点[2],在城市的环境绿化和美化中开始广泛应用。
水分是影响植物生长、发育和分布的主要环境因子之一,所以干旱对植物的危害程度在诸多非生物胁迫中占首位。植物的耐旱性是指植物通过一定的抗旱方式在长期干旱胁迫下的生存能力[3],对干旱胁迫条件下植物的形态结构、生理特性以及遗传规律的研究表明,干旱胁迫会降低植物的光合作用、破坏呼吸链、降低碳代谢途径中一些酶的活性,也会改变植物组织器官的超微结构[4]。目前,对委陵菜属植物的研究主要集中在园林应用价值[5]、引种驯化[6]、花粉形态[7]以及药用价值[8]等方面,耐旱性[9]的研究相对较少,多见于绢毛委陵菜(P.sericea)、鹅绒委陵菜(P.anserina)等。本研究以委陵菜(P.chinensis)、翻白委陵菜(P.discolor)、白叶委陵菜(P.leucophylla)、轮叶委陵菜(P.verticillaris)为试验材料,在干旱胁迫条件下,比较叶肉细胞中叶绿体、线粒体等超微结构的变化,以期从细胞器超微结构方面来了解其耐旱机制并比较不同委陵菜属植物的耐旱能力,为耐旱品种的筛选与培育提供理论依据,也为干旱地区绿化建设的植物选材提供依据。
1 材料与方法
试验材料为4种野生委陵菜属植物,分别是委陵菜、翻白委陵菜、白叶委陵菜、轮叶委陵菜。2010年8月在大庆草原采集野生种子,2011年3月播种,将幼苗移栽至直径为9 cm的小盆里,统一管理。
2011年7月选取生长一致、发育正常的植株,提供充足的阳光、水分和营养,保证其正常生长。开始胁迫试验后停止供水,使其自然失水,以土壤含水量作为干旱胁迫梯度的标准,土壤含水量为35%~40%是正常状态、25%~30%是轻度干旱胁迫、15%~20%是中度干旱胁迫、5%~10%是重度干旱胁迫,用称重法补充水分以维持土壤含水量,直至胁迫结束,每组处理重复3次。
样品的制备:在叶片中脉附近切取1 mm×1 mm的材料,用3%戊二醛固定24 h以上,磷酸缓冲液(pH值为7.2)漂洗3次,每次约20 min,然后在4 ℃条件下用1%锇酸固定4 h,用去离子水漂洗3次,每次20 min,再用乙醇系列进行脱水,丙酮过渡,随后用环氧树脂812渗透包埋,LKB5切片机切片,醋酸双氧铀和柠檬酸铅双染,用H7650透射电镜进行观察,随机选择含有叶肉细胞的不同视野照相。
每个处理随机选取10个视野,测量叶绿体大小(以面积表示),取平均值,重复3次;每个处理随机观察10个细胞,计数统计叶绿体的数量,取平均值,重复3次。试验数据采用SPSS 19.0软件进行分析。
2 结果与分析
2.1干旱胁迫对叶肉细胞的影响 在自然状态下,4种委陵菜属植物的叶肉细胞结构基本相同(图1-A,图1-E,图1-I,图1-M);在轻度胁迫状态下,4种委陵菜属植物的叶肉细胞的内部结构发生轻微变化(图1-B,图1-F,图1-J,图1-N);在中度胁迫状态下,委陵菜和翻白委陵菜质壁分离明显,局部细胞膜破裂,叶绿体内部结构混乱(图1-C,图1-G),白叶委陵菜和轮叶委陵菜的结构基本完整(图1-K,图1-O);在重度胁迫状态下,委陵菜的细胞膜破裂,内含物外流,叶绿体解体(图1-D),翻白委陵菜的叶绿体有团聚现象出现(图1-H),白叶委陵菜和轮叶委陵菜的细胞膜基本完整,叶绿体结构散乱,白叶委陵菜叶绿体被膜破裂,有内含物外流(图1-L,图1-P)。
随着干旱胁迫程度的加强,叶肉细胞的受损程度逐渐加强,叶绿体发生了明显的变化,受损越来越严重,而且不同的植物在相同的胁迫条件下叶肉细胞的受损程度也不同。在相同的干旱条件下,委陵菜的叶肉细胞受损最重,轮叶委陵菜的叶肉细胞受损最轻(图1)。

图1 干旱胁迫对4种委陵菜叶肉细胞的影响Fig.1 Drought stress on the cell of four Potentilla species
2.2干旱胁迫对叶肉细胞叶绿体结构的影响 自然状态下4种委陵菜属植物的叶肉细胞结构基本相同,没有明显差异。细胞质壁结合紧密,叶绿体数量多,基粒片层和基质类囊体膜结构清晰、排列整齐,具有少量的嗜锇颗粒(图2-A,图2-E,图2-I,图2-M)。
在轻度胁迫时,细胞壁稍变厚,叶绿体体积增大,外被膜仍然清晰且基本完整。委陵菜的叶绿体不贴壁分布,叶绿体类囊体片层膨胀明显,嗜锇颗粒明显增多(图2-B);翻白委陵菜、白叶委陵菜和轮叶委陵菜的叶绿体及其他细胞器局部贴壁分布,叶绿体基粒片层轻微扭曲,嗜锇颗粒数量变化不明显(图2-F,图2-J,图2-N)。
在中度胁迫时,细胞壁厚度增加,细胞质壁分离明显,叶绿体拉长或变成近球状,嗜锇颗粒数量增多,且有大的嗜锇颗粒出现。委陵菜的叶绿体外被膜局部破裂,基粒和基质类囊体膜结构模糊,呈波浪状,基粒出现膨胀且排列混乱(图2-C);翻白委陵菜的叶绿体类囊体片层扩张,外膜消失,基粒片层膨胀、溶解或空泡化、破裂,基粒垛叠程度下降(图2-G);白叶委陵菜的叶绿体被膜仍然清晰但不完整,局部出现断裂,基粒和基质类囊体膜结构模糊,但仍排列有序(图2-K);轮叶委陵菜的叶绿体受损相对较轻,结构基本完整(图2-O)。

图2 干旱胁迫对4种委陵菜叶肉细胞叶绿体结构的影响Fig.2 Drought stress on the chloroplast of four Potentilla species
在重度胁迫时,委陵菜的叶绿体被膜破裂,甚至完全解体,内含物外流,片层结构排列紊乱(图2-D);翻白委陵菜的叶绿体出现团聚现象(图2-H);白叶委陵菜的叶绿体被膜破裂,有内含物外流(图2-L);轮叶委陵菜的叶绿体基粒和基质类囊体膜结构呈波浪状,有较宽的间距出现,基粒出现弯曲以及膨胀(图2-P)。
在相同的干旱胁迫条件下,委陵菜的叶绿体破损最严重,轮叶委陵菜叶绿体的破损程度相对较轻。
2.3干旱胁迫对4种委陵菜属植物叶绿体大小和数量的影响 随着干旱胁迫程度的加强,4种植物的叶绿体大小呈逐渐减小的趋势,叶绿体数量呈逐渐增多的趋势(表1,图1)。委陵菜、翻白委陵菜、白叶委陵菜、轮叶委陵菜叶绿体变化率分别为77.19%、71.22%、70.52%、62.01%。
2.4干旱胁迫对叶肉细胞线粒体结构的影响 正常条件下委陵菜属植物叶片细胞中线粒体多呈较规则的椭圆形或长椭圆形,双层被膜结构完整,脊较丰富,内嵴小而少,细胞质浓(图3-A,图3-E,图3-I,图3-M)。

表1 干旱胁迫对4种委陵菜叶绿体大小和数量的影响Table 1 Effects of drought stress on chloroplast size and number of four Potentilla species
轻度胁迫条件下,线粒体数量增多,线粒体膨胀,拉长或变圆,委陵菜的部分线粒体内外膜和嵴变模糊,嵴数量变少(图3-B);翻白委陵菜的线粒体结构保持完整,但脊的数目增加,并略微肿胀(图3-F);白叶委陵菜的线粒体外膜受到破坏,内部无明显变化(图3-J);轮叶委陵菜的线粒体结构保持完整,没有明显变化(图3-N)。
中度胁迫条件下,委陵菜的线粒体外膜出现降解现象,内部脊变少(图3-C);翻白委陵菜的线粒体局部外膜破裂(图3-G);白叶委陵菜的部分线粒体内外膜和嵴变模糊,嵴数量变少,细胞质变浅(图3-K);轮叶委陵菜的线粒体外膜清楚,但内部结构模糊不清(图3-O)。
重度胁迫条件下,委陵菜的线粒体开始降解,内含物流出(图3-D);翻白委陵菜的线粒体内外膜破裂,嵴消失,线粒体出现空泡化(图3-H);白叶委陵菜的线粒体内外膜膨大或破裂,内含物流出(图3-L);轮叶委陵菜线粒体外膜清楚,但内部结构模糊不清(图3-P)。
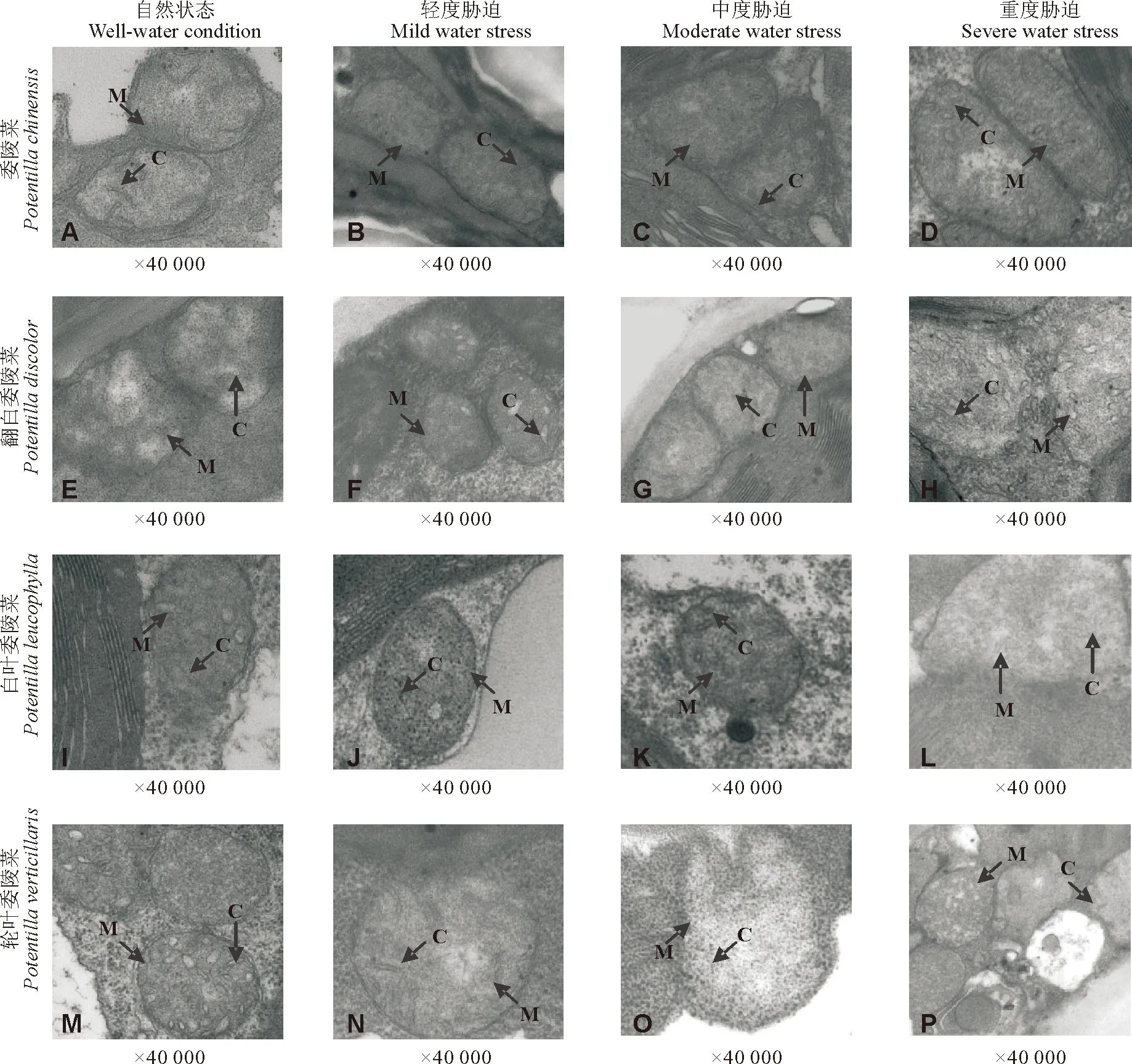
图3 干旱胁迫对轮叶委陵菜叶肉细胞线粒体结构的影响Fig.3 Drought stress on the mitochondria of four Potentilla species
在相同的干旱胁迫条件下,委陵菜的线粒体被破坏得最严重,轮叶委陵菜的线粒体损坏程度相对最轻。
3 讨论
植物暴露在自然环境中最多的是叶片,叶片对外界环境的变化很敏感,也比较容易适应环境,因而形态和结构易随环境改变[10-12]。叶肉细胞中叶绿体和线粒体是植物光合作用、能量流动的细胞器,也是对环境反应很敏感的细胞器[13]。因此,在干旱胁迫条件下,比较观察4种委陵菜属植物的叶绿体、线粒体等细胞器超微结构的变化规律,是判断其耐旱能力的方法之一。
在叶肉细胞中,叶绿体和线粒体的形态结构、大小、数目和分布常因植物所处的环境条件不同而发生相应变化[14],尤其在逆境胁迫下其结构和生理功能的变化更为显著[15]。本试验中,在轻度胁迫下,4种植物叶肉细胞均轻微受损,区别不太明显;在中度胁迫下,委陵菜和翻白委陵菜的叶肉细胞受损程度相对较重,白叶委陵菜和轮叶委陵菜的受损程度相对较轻;在重度胁迫时,委陵菜的叶肉细胞被破坏的最严重,轮叶委陵菜的受损程度最轻。说明随着干旱胁迫程度的加强,4种植物叶肉细胞的受损程度均逐渐加强,而且不同的植物在相同的胁迫条件下叶肉细胞的受损程度不同。
叶绿体是植物光合作用的场所,对水分的亏缺较敏感,它的正常与否是判断植物细胞活性的一个重要指标[16]。本试验中,在轻度胁迫时,委陵菜叶绿体受损相对严重,翻白委陵菜、白叶委陵菜和轮叶委陵菜的叶绿体受损相对较轻;在中度胁迫时,白叶委陵菜和轮叶委陵菜的叶绿体受损较轻,翻白委陵菜和委陵菜的叶绿体受损相对较重;在重度胁迫时,叶绿体受损程度为轮叶委陵菜<白叶委陵菜<翻白委陵菜<委陵菜,而且委陵菜、翻白委陵菜、白叶委陵菜和轮叶委陵菜4种植物的叶绿体的变化率分别为77.19%、71.22%、70.52%和62.01%,呈逐渐减小的趋势,说明随着干旱胁迫程度的增加,叶绿体的受损越严重,且不同植物的叶绿体对干旱胁迫的反应不同,因此在干旱胁迫中叶绿体的受损程度可以作为判断植物耐旱性强弱的依据之一。陈建辉等[17]研究表明,叶绿体结构的变化可以作为评价大麦(Hordeumsativum)耐旱性强弱的形态结构指标。郁慧等[18]研究发现,干旱胁迫下不同植物的叶绿体结构的受损程度与其抗旱性强弱相对应。郑敏娜等[19]研究指出,水分胁迫下6种牧草叶肉细胞叶绿体结构的受损程度与各牧草抗旱性强弱相对应。本研究中,干旱胁迫条件下,耐旱性强的叶绿体受损较轻,耐旱性弱的叶绿体受损较重,此结果与前人的研究结果一致。
线粒体是动力工厂,是进行呼吸作用的主要场所,为植物的生命活动提供能量。细胞中线粒体的数目,以及线粒体中嵴的多少,与细胞的生理状态有关。当代谢旺盛、能量消耗多时,细胞就具有较多的线粒体,其内有较密的嵴;反之,代谢较弱的细胞,线粒体较少,内部嵴也较疏。当植物受到干旱胁迫时,线粒体膜的破坏、嵴的减少甚至消失必将影响到叶绿素合成、贮藏及光合作用的主要器官。本试验中,在轻度胁迫时,委陵菜的线粒体受损相对严重,其他3种植物的线粒体损坏不明显;在中度胁迫时,白叶委陵菜和轮叶委陵菜的线粒体受损较轻,委陵菜最严重;在重度胁迫时,委陵菜的线粒体被破坏得最严重,轮叶委陵菜的线粒体损坏程度相对最轻。说明随着干旱胁迫程度的增加,线粒体的受损越严重,且不同植物的线粒体对干旱胁迫的反应不同,但是线粒体结构的变化与叶绿体相比,表现较为迟钝。陈燕等[20]研究表明,线粒体结构的变化比叶绿体略迟钝,但随着叶绿体的伤害加重,线粒体脊也迅速断裂、解体并空泡化而丧失功能。黑麦草(Loliumperenne)[21]和绢毛委陵菜[22]线粒体对干旱胁迫的耐受力要比叶绿体的强,且不同植物的线粒体结构受损程度与其抗旱性强弱相对应。本研究中,干旱胁迫条件下,耐旱性强的委陵菜属植物的线粒体受损害较轻,耐旱性弱的线粒体受损害较重,此结果与前人的研究结果一致。
综上所述,通过对4种委陵菜属植物叶肉细胞超微结构的研究发现,在同一干旱胁迫条件下,不同植物的叶肉细胞受损程度不同,而且随着干旱胁迫的加强,植物叶肉细胞受损越严重。依据植物在干旱胁迫时发生的变化和试验结果的分析表明,4种委陵菜属植物耐旱能力的大小依次为:轮叶委陵菜>白叶委陵菜>翻白委陵菜>委陵菜。
[1] 李季军.青海省野生资源植物——鹅绒委陵菜(Potentillaanserina)的应用研究[J].生物学杂志,2003,20(5):34-36.
[2] 卞勇,吕冬霞,张玉泉,等.扁蓄和叉叶委陵菜的草坪利用研究[J].草业科学,2004,21(7):66-68.
[3] 山仑,陈陪元.旱地农业生理生态基础[M].北京:科学出版社,1998:100-121.
[4] 吴凯,周晓阳.环境胁迫对植物超微结构的影响[J].山东林业科技,2007(3):80-83.
[5] 张庆良,陈秀红,张仁富,等.匍枝委陵菜的园林应用研究[J].山东林业科技,2006(2):25-26.
[6] 李军乔.鹅绒委陵菜的生态适应性及栽培技术研究[J].中国野生植物资源,2005,24(4):36-37.
[7] 尤凤丽,梁彦涛,曲丽娜,等.大庆地区委陵菜属植物花粉形态研究[J].中国农学通报,2010,26(16):337-340.
[8] 张勇,李鹏,李彩霞,等.委陵菜属药用植物[J].中兽医医药杂志,2005,21(2):60.
[9] 吴建慧,郭瑶,崔艳桃.水分胁迫对绢毛委陵菜叶绿体超微结构及光合生理因子的影响[J].草业科学,2012,29(3):434-439.
[10] 朱青,王兆骞,尹迪信.贵州坡耕地水土保持措施效益研究[J].自然资源学报,2008,23(2):219-220.
[11] Thomas M L,Logan T,Fausey N R.Land use and management effects on nonpoint loading from Mianian soil[J].Soil Science Society of America Journal,1992,56(6):1871-1875.
[12] 高凤杰,张柏,王宗明,等.牡丹江市退耕还林前后自然状态下土壤侵蚀敏感性变化研究[J].水土保持通报,2010,30(5):5-6.
[13] Endress A G,Sjoloud R D.Ultrastructural cytology of callus cultures ofStrepanthustortuosusas affect by temperature[J].American Journal of Botany,1976,63(9):1213-1224.
[14] 翟中和,王喜忠,丁明孝.细胞生物学[M].北京:高等教育出版社,2000,207-245.
[15] Vani B,Saradhi P P,Mohanty P.Alteration in chloroplast structure and thylakoid membrane composition due to invivoheat treatment of rice seedlings:correlation with the functional changes[J].Journal of Plant Physiology,2001,158(5):583-592.
[16] 刘洪波,林思祖,丁国昌,等.不同低温处理对三种相思树种叶片细胞超微结构影响的比较研究[J].江西农业大学学报,2005,27(5):735-739.
[17] 陈建辉,李荣华,郭培国,等.干旱胁迫对不同耐旱性大麦品种叶片超微结构的影响[J].植物学报,2011,46(1):28-36.
[18] 郁慧,刘中亮,胡宏亮,等.干旱胁迫对5种植物叶绿体和线粒体超微结构的影响[J].植物研究,2011,31(2):152-158.
[19] 郑敏娜,李向林,万里强,等.水分胁迫对6种禾草叶绿体、线粒体超微结构及光合作用的影响[J].草地学报,2009,17(5):643-649.
[20] 陈燕,郑小林,曾富华,等.高温干旱下两种冷季型草坪草叶片细胞超微结构的变化[J].西北植物学报,2003,23(2):304-108.
[21] 万里强,石永红,李向林,等.高温干旱胁迫下三个多年生黑麦草品种叶绿体和线粒体超微结构的变化[J].草业学报,2009,18(1):25-31.
[22] 吴建慧,郭瑶,崔艳桃.自然失水胁迫对绢毛委陵菜叶片超微结构的影响[J].东北林业大学学报,2011,39(11):53-55.
