植物药物中抗肿瘤成分研究
2012-03-12邓玲玲李政政黄胜阳
王 珊,邓玲玲,李政政,黄胜阳
(1.北京工业大学生命科学与生物工程学院,北京100124;2.北京工业大学医院,北京100124)
恶性肿瘤是严重威胁人类健康的主要疾病,而许多化学抗癌药物在临床上都表现出不同程度的致突变遗传毒性.近年来,一些从天然植物中提取的具有一定活性、作用机制独特、毒副作用低的抗肿瘤植物药及其衍生物在临床上得到了广泛的应用.本文按化学结构类型进行归纳,现将国内外植物药物中抗肿瘤活性成分的研究综述如下.
1 生物碱类
吴茱萸碱(evodiamine,1)是从芸香科植物吴茱萸、石虎果实中提取的一种半萜吲哚类生物碱,作用于血管内皮生长因子VEGF的表达和ERK的磷酸化,从而抑制细胞增殖和浸润转移,使癌细胞停止分裂而死亡[1].从白花蛇舌草分离出的化合物10(S)-hydroxypheophytina(2)能够有效抑制肿瘤细胞增殖,相比从中分离得到的另一种生物碱6-O-(E)-p-coumaroylscandoside methyl ester (3)而言,其对前列腺癌细胞株LNCaP的IC50值可降低到20 μmol/L[2].
石蒜碱(lycorine,4)是从石蒜中提取的一种生物碱,它能够下调骨髓瘤细胞周期蛋白 D1和CDK4,阻滞细胞周期于G0/G1期,诱导癌细胞凋亡[3].苦参碱(matrine,5)来源于豆科植物苦参苦豆子、广豆根等,其作用机理是通过提高凋亡因子基因Fas与FasL的表达,从而活化caspase-3酶,以致促使细胞凋亡[4].LingdiMa等报告了其对于肺腺癌细胞株A549的生物活性,它的IC50值为0.5~0.8 mg/mL[5].
从楝属植物Aglaiaelliptica(Meliace)中提取的楝酰胺(rocaglamide,6)可以诱导活化有丝裂解原蛋白激酶p38,长时间抑制细胞外信号调节激酶,从而影响凋亡蛋白Bcl-2,导致线粒体膜电位去极化,促使细胞凋亡[6].值得注意的是该生物碱对正常细胞的蛋白激酶不会产生影响,2007年Frank I.Bohnenstengel等研究了楝酰胺对癌细胞株MONO-MAC-6和MEL-JUSO的抑制率,IC50值分别为0.004和0.013μmol/L[7].
粉防己碱(tetrandrine,7),又名汉防己甲素,是从防己科植物粉防己的块根中提取的一种双苄基异喹啉类生物碱,其抗肿瘤机制是下调蛋白基因MRP表达,抑制端粒酶活性,破坏端粒稳定性[8].据Lien-Chai Chiang等报告,它对肝癌细胞株HepG2、PLC/PRF/5和 Hep3B均有明显的抑制率[9].
2 黄酮类
曾秋红等[10]从半枝莲中得到五种黄酮类化合物,分别是野黄芩苷(scutel larin,8)、芹菜素(baicalein,9)、木犀草素(luteolin,10)、4'-羟基汉黄芩素(4'-hydroxyw ogonin,11)和黄芩素(apigenin,12).并测定了在体外对肝癌、结肠癌、胃癌的细胞毒活性,发现黄芩素的3'位被羟基取代后,其活性会明显增加,这表明木犀草素中有更多的亲水性基团与靶细胞结合.另外两种与野黄芩苷和芹菜素结构相似的黄酮,黄芩苷(baicalin,13)与汉黄芩素(wogonin,14)存在于唇形科植物黄芩的根中,可通过抑制肿瘤新生血管生成,产生对肿瘤细胞抑制侵袭和转移等作用[11].
勒奇黄烷酮 A(leachianone A,15)和 sophoraflavone J(16)是从苦参的根中分离得到的两种结构相差较大的化合物,因此它们表现出不同的活性.勒奇黄烷酮A主要通过细胞内外途径诱导细胞凋亡,它对肝癌细胞具有毒性作用,其IC50值为3.4 μg/mL[12].而sophoraflavone J却是通过引起细胞内营养消耗和活性氧簇ROS的生成,从而导致线粒体功能产生障碍与细胞凋亡[13].
甘草属植物Glycyrrhiza L.中的抗肿瘤活性成分主要是异甘草素(Isoliquiritigenin,17)、异甘草苷(Isoliquiritin,18)、甘草查耳酮A(licochalcone A,19)、甘草查耳酮 E(licochalcone E,20)、甘草素(Liquiritigenin,21)、光甘草定(Glabridin,22)、光甘草素(Glabrene,23)和甘草醇(glycyrol,24).这些甘草黄酮具有广泛的生理、药理活性,尤其对肿瘤细胞具有显著的抑制作用.其中甘草查耳酮A可阻滞细胞周期于G2/M期,分别提高Rb和降低cyclin A、cyclin B、MDM2的表达,同时作用于 PARP、caspase-3、Bcl-2和Bax来诱使细胞凋亡[14].异甘草素则可阻滞细胞周期于S、G2/M期,抑制细胞周期蛋白B1和mRNA表达,提高磷酸化p34cdc2蛋白水平[15].另外,Raj等[16]研究表明,与甘草醇结构类似的补骨脂定(psoralidin,25)可以抑制磷脂酰肌醇激酶3和核转录因子κB及其靶基因的激活,从而促进细胞凋亡.
Song等[17]从豆科植物Millettia reticulata Benth的根中得到六种的黄酮类化合物:(-)-epicatechin(26)、naringenin(27)、5,7,3',5'-tetrahydroxyflavanone(28)、formononetin(29)、isoliquiritigenin (17)和genistein(30),还测定了这些化合物的体外抗肝癌活性,发现其中的黄酮genistein具有最强的抑制细胞增殖能力,并能提高Fas、FasL和p53的蛋白表达和促进PARP裂解.与黄酮formononetin的结构相比,它们活性的差异正是由于苯环所在的取代基位置不同所致,这表明黄酮中3位上的取代基是抗瘤的分子活性中心.
从朝鲜盐土植物Salicorniaherbacea中分离得到的两种黄酮类单糖isorhamnetin 3-O-b-D-glucoside(31)和quercetin 3-O-b-D-glucoside (32),可降低基质金属蛋白酶MMP-9与MMP-2表达,提高基质金属蛋白酶抑制因子TIMP-1水平,从而能显著抑制肿瘤细胞[18].Wang等[19]从淫羊藿中分出了一种黄酮类低聚糖化合物淫羊藿苷(icariin,33),发现它对胃癌细胞的抑制效果明显,其作用机制是通过siRNA降低磷蛋白VASP与Rac1表达,来抑制细胞增殖,见图1.
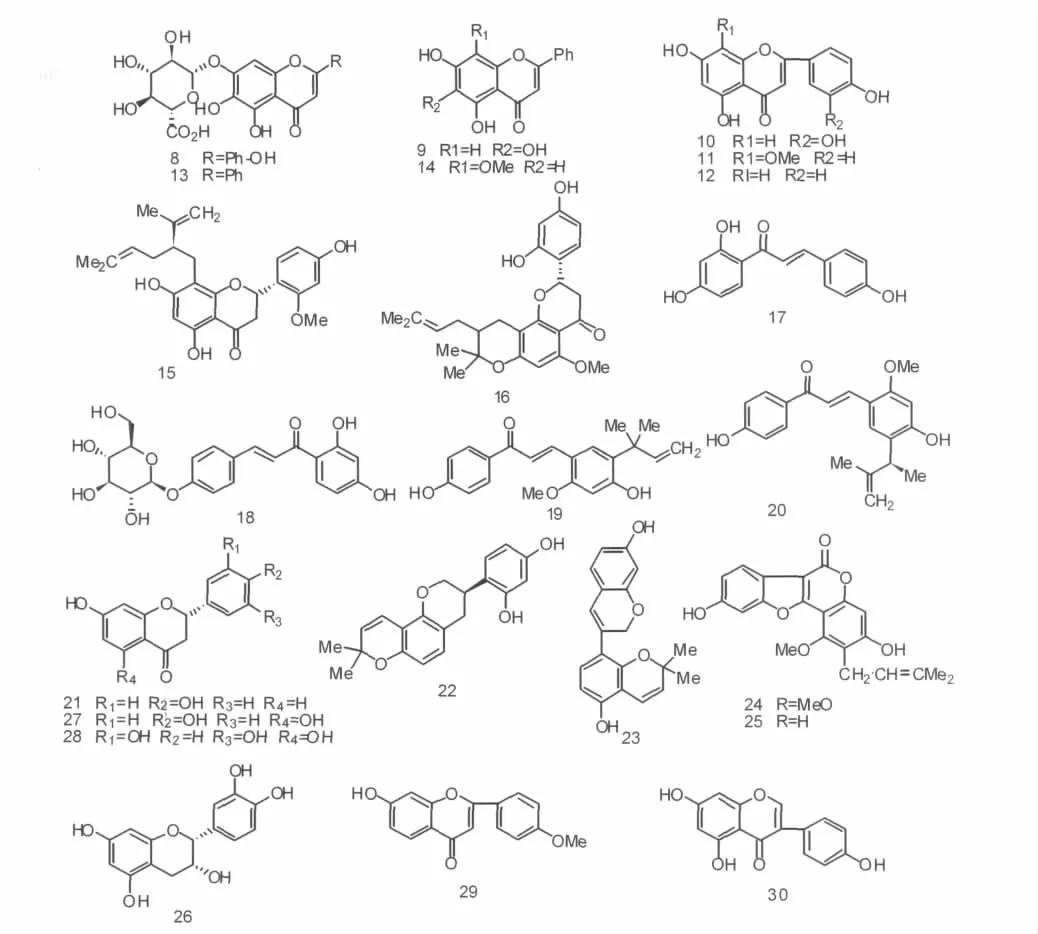
图1 黄酮类化合物的化学结构
3 萜类
3.1 倍半萜
去氢木香内酯(dehydrocostuslactone,34)是一种从云木香属植物木香中得到的倍半萜内酯化合物,其作用机制是活化caspases-8、9、7、3,促进DNA修复酶PARP裂解,促进凋亡基因的水平,降低基因Bcl-xL的表达,从而导致细胞凋亡[20],Choi等[21]报道去氢木香内酯在体外对乳腺肿瘤和子房肿瘤细胞均有显著的生长抑制作用.
从传统中药姜科植物温郁金中分离的两种倍半萜烯类化合物δ-榄香烯(δ-elemene,35)和γ-榄香烯(γ-elemene,36),它们互为双键位置异构体,并且均无细胞毒性,能够活化caspase信号通路,裂解DNA修复酶,转移基因Bax,减少细胞色素c与线粒体跨膜电位,从而促使肿瘤细胞凋亡[22],见图2.
3.2 二萜
土槿皮乙酸(pseudolaric acid B,37)是从松科植物金钱松的根皮中分离得到的双环二萜类化合物.它不仅是土槿皮抗真菌的主要成分,而且在体外实验中显示出抗肿瘤作用.可阻滞细胞于G2/M期,调节细胞周期蛋白表达,下调原癌基因 cmyc,并且它能够抑制基因Bcl-xL表达,诱导酶原procaspase-3与DNA修复酶PARP裂解,从而导致DNA片段化和染色质凝聚[23].Meng等[24]的实验结果显示,土槿皮乙酸在体外作用于黑素瘤细胞株A372,SK-28和624 mel的IC50值分别为1.93、 1.12、2.86 μmol/L.
雷公藤甲素(triptolide,38)是从雷公藤中提取分离到的环氧化二萜内酯化合物.这类物质不仅能诱导肿瘤细胞凋亡,干预细胞周期,抑制新生血管形成等,而且具有下调促进血管生成基因Tie2、VEGFR-2表达的作用[25].
冬凌草素(oridonin,39)属于贝壳杉烯骨架四环二萜类化合物,为唇形科香茶菜属植物冬凌草的主要抗癌活性成分.它能够活化蛋白酶caspase-3,减少抗细胞凋亡蛋白Bcl-2和Bcl-xL,增加促进细胞凋亡蛋白Bax和Bid[26].Liu等[27]从中提取的另外一种二萜冬凌草乙素(ponicidin,40)也能够起到活化蛋白酶caspase-3、caspase-8和caspase-9,下调抗凋亡蛋白Bcl-2,上调促进凋亡蛋白Bax等作用.
3.3 三萜
在巴西生长的鼠李科植物Ampelozizyphusamazonicus Ducke的树干中分出一系列羽扇豆烷型三萜,其中化合物3β-hydroxylup-20(29)-ene-27,28-dioicacid(41)的质量浓度在1~10 mg/mL之间时对腺癌细胞具有一定的抗肿瘤活性.其作用机制在于通过减少Bcl-2促使线粒体酶的损失,同时释放细胞色素c,活化蛋白酶caspase-3和促进DNA修复酶PARP裂解,从而导致DNA的片段化,引起细胞凋亡[28].在结构中引入羟基后,生成的2α,3β-dihydroxylup-20(29)-ene-27,28-dioic acid(42)对腺癌和黑素癌细胞均表现出更强的抑制作用[29].
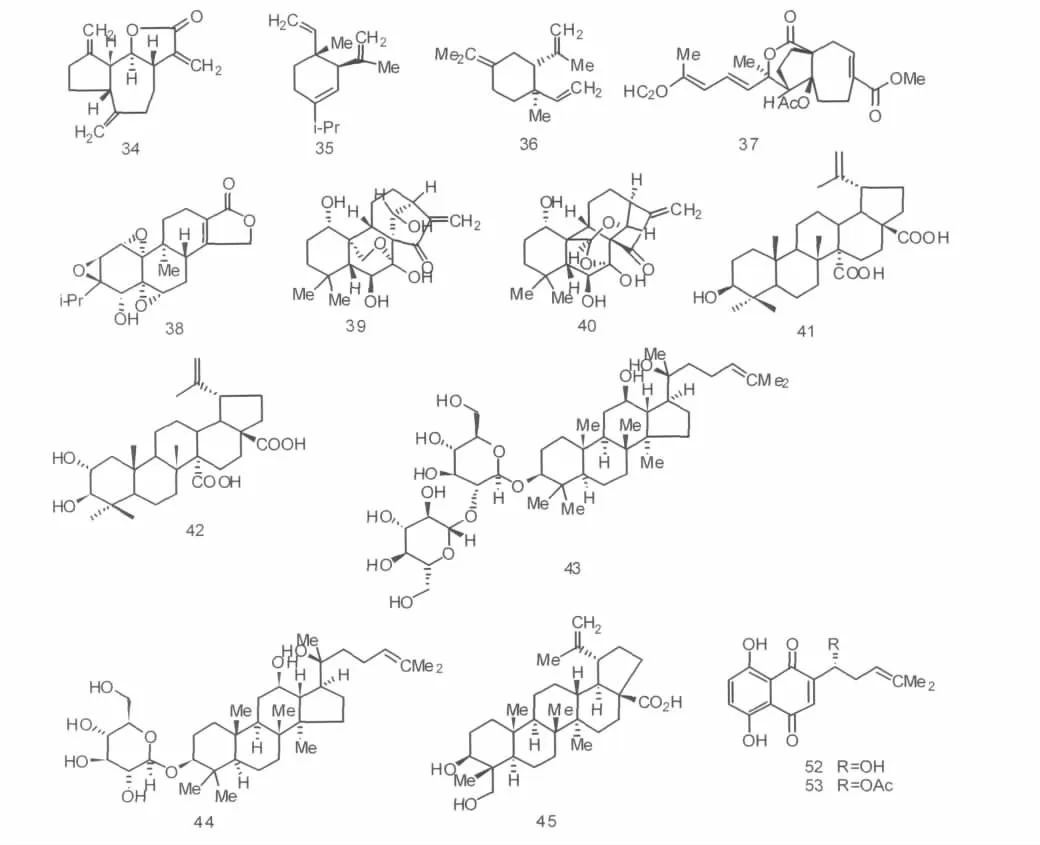
图2 萜类及其他类化合物的化学结构
从五加科Araliaxeae植物中得到两种达玛烷型四环三萜人参皂甙Rg3(ginsenosideRg3,43)与 Rh2(ginsenosideRh2,44).在抗肿瘤试验中,人参皂甙Rg3对乳腺肿瘤细胞的IC50值为200 μg/mL,而人参皂甙Rh2却对马立克氏病肿瘤细胞的IC50值为0.65 mg/L[30-31].它们通过抑制肿瘤细胞的粘附、浸润、增殖以及阻碍肿瘤新生血管的形成作用,发挥抑制癌细胞增殖的能力.
蒋孟军等[32]报道,从传统中药白头翁中提取的三萜皂苷元2,3-羟基白桦酸(23-Hydroxybetulinicacid,45),对毛细血管内皮细胞增殖、迁移和小血管的形成有一定影响,从而抑制癌细胞的生成.Xu等[33]从土贝母中得到同类三萜皂苷元土贝母苷甲(tubeimoside-1,46),它能诱导线粒体跨膜电位衰竭,促进caspase依赖细胞凋亡.灰毡毛忍冬次皂苷乙(macranthoside B,47)则可以通过蛋白酶介导的通路,来活化蛋白酶caspase-3,并且与胆固醇的相互作用导致细胞膜的损伤,促使癌细胞凋亡[34].
4 苯丙素类
阿克替苷(acteoside,48)是一种来源于马鞭草科植物Clerodendrontrichotomum的苯丙素类皂苷元化合物,可以下调细胞周期蛋白,抑制激酶p21CIP1/WAF1和p27KIP1,降低蛋白激酶CDK2、CDK4和CDK6的活性,从而诱导在细胞周期G0/ G1期停滞[35].
从菊科鹿角草属植物Glossogynetenuifolia中分离得到一个新的具有抗肿瘤活性的苯丙素类化合物1'-acetoxy-4-O-isovalyryleugenol(49),它通过释放细胞色素 C,活化蛋白酶 caspase-9和caspase-3,以及降低抗凋亡蛋白Bcl-2和BclxL水平,并增加促进凋亡蛋白Bad表达,从而促使细胞凋亡.对A549肺肿瘤细胞的IC50值范围为47.28~49.7 μg/mL[36].
5 醌类
Xiong等[37]从鹅掌柴属植物中分出两个醌类化合物大黄酚(Chrysophanol,50)和2,6-二甲氧基对苯醌(2,6-Dimethoxy-ρ-benzoquinone,51).这些化合物抑制K562细胞周期的IC50值分别为52.50和25.50 μg/mL.Min等[38]研究表明,紫草素(shikonin,52)是一种可以活化蛋白酶caspase-8、caspase-9、caspase-3的醌类化合物,通过抗凋亡蛋白Bcl-2的表达和阻碍转录因子NF-κB通路,从而发挥细胞凋亡作用.与紫草素结构类似的乙酰紫草素(Acetylshikonin,53)是另一个从紫草中分离的醌类化合物,它能活化抗凋亡蛋白bcl-2和蛋白酶caspase-3,释放细胞色素c,从而抑制肿瘤生长.该药抑制肺腺癌、肝癌、乳腺癌和小鼠Lewis肺癌的IC50值范围分别为4.74~6.46、5.32~8.32、2.6~3.48、2.34~3.1 μg/mL[39].
6 其他类化合物
除了上述几类较为集中的成分外,其他天然产物如烷烃、脂肪酸等成分的抗癌活性也有报道.
桤木酮(alnustone,54)是从草豆蔻中得到的二苯庚烷类化合物.实验证明,此药在浓度为25 μmol/L时,对癌细胞的抑制率可达60%以上[40].Jiang等[41]从绿藻植物Tydemaniaexpeditionis中分离出的几种不饱和脂肪酸3(ξ)-hydroxy-octadeca-4(E),6(Z),15(Z)-trienoic acid(55)、3(ξ)-hydroxy-Hexadeca-4(E),6(Z)-dienoic acid (56)和3(ξ)-hydroxy-octadeca-4(E),6(Z)-dienoic acid(57),均有较强的细胞毒性,其IC50范围为1.3~14.4 μmol/L.
在七叶莲中分出一个正十六烷酸(Palmitic Acid,58),它在30 μg/mL的低质量浓度时可引起tsFT210细胞周期G2/M期阻滞,而在100 μg/mL的高质量浓度时却呈现显著的细胞凋亡诱导活性[42].
7 结语
天然植物药物的骨架一直以来被认为是上市药物的有利基础.我国的植物资源极为丰富,并且具有应用植物药防治疾病的悠久历史.现已发现大量的植物药物成分具有抗肿瘤活性,其中主要为生物碱类、黄酮类、萜类、苯丙素类、醌类、多糖类等化合物.我们相信,随着植物药物抗癌机制、药物代谢途径和构效关系的研究不断深入,将能更好的确定它们与药物靶点的三维药效关系,从而合成高药效、低毒性的新抗肿瘤药物.
[1] SHYU K G,LIN S K,LEE C C,et al.Evodiamine inhibits in vitro angiogenesis:Implication for antitumor genicity[J].Life Sciences,2006,78(19):2234-2243.
[2] LI M,JIANG R W,HON P M,et al.Authentication of the anti-tumor herb Baihuasheshecao with bioactive marker compounds and molecular sequences[J].Food Chemistry,2010,119(3): 1239-1245.
[3] LI Y,LIU J,LI J T,et al.Apoptosis induced by lycorine in KM3 cells is associated with the G0/G1 cell cycle arrest[J].ONCOLOGY REPORTS,2007,17(2):377-384.
[4] DAI Z J,GAO J,JI Z Z,et al.Matrine induces apoptosis in gastric carcinoma cells via alteration of Fas/FasL and activation of caspase-3[J].Journal of Ethno pharmacology,2009,123 (1):91-96.
[5] MA L D,JIANG L J,WANG D Q,et al.Matrine:A novel inhibitor of growth and proliferation of lung adenocarcinoma cells[J].Journal of Medicinal Plants Research,2010,4(5):375-386.
[6] ZHU J Y,LAVRIK I N,MAHLKNECHT U,et al.The traditional Chinese herbal compound rocaglamide preferentially induces apoptosis in leukemia cells by modulation of mitogen-activated protein kinase activities[J].Int.J.Cancer,2007,121 (8):1839-1846.
[7] BOHNENSTENGEL F I,STEUBE K G,MEYER C,et al.Structure Activity Relationships of Anti-proliferative Rocaglamide Derivatives from Aglaia Species(Meliaceae)[J].Zeitschriftfuer Naturforschung,C:Biosciences,1999,54(1/2): 55-60.
[8] 王丽敏,吕宏彦,李庆勇,等.粉防己碱的抗肿瘤药理研究新进展[J].时珍国医国药,2008,19(10):2558-2559.
[9] CHIANG L C,LIN Y T,Lin C C.Anti-proliferative and Apoptotic Effects of Tetrandrine on Different Human Hepatoma Cell Lines[J].The American Journal of Chinese Medicine,2006,34,(1):125-135.
[10] 曾秋红.半枝莲黄酮类化合物体外抗肿瘤活性的研究[J].海峡药学,2011,23(1):137-139.
[11] GAO J Y,ZHAO H Y,HYLANDS P J,et al.Secondary metabolite mapping identifies Scutellaria inhibitors of human lung cancer cells[J].Journal of Pharmaceutical and Biomedical Analysis,2010,53(3):723-728.
[12] CHEUNG C S,CHUNG K K,LUI J C,et al.Leachianone A as a potential anti-cancer drug by induction of apoptosis in human hepatoma HepG2 cells[J].Cancer Letters,2007,253(2):224-235.
[13] CHEUNG C S,HON P M,FUNG K P,et al.Proteomic characterization of Sophoraflavone J-induced apoptosis in HepG2 cells[J].Proteomics Clin.Appl.,2007,1(12):1532-1544.
[14] XIAO X Y,HAO M,YANG X Y,et al.Licochalcone A inhibits growth of gastric cancer cells by arresting cell cycle progression and inducing apoptosis[J].Cancer Letters,2011,302(1): 69-75.
[15] 张 晶,杨 静,汤宏斌.异甘草素对人宫颈癌细胞增殖的抑制作用[J],中国药理学与毒理学杂志,2005,19(6):436-442.
[16] KUMAR R,SRINIVASAN S,KODURU S,et al.Psoralidin,an Herbal Molecule,Inhibits Phosphatidylinositol3-Kinase-Mediated Akt Signaling in Androgen-Independent Prostate Cancer Cells[J].Cancer Prevention Research,2009,2(3):234-243.
[17] FANG S C,HSU C L,LIN H T,et al.Anticancer Effects of Flavonoid Derivatives Isolated from Millettia reticulata Benth in SK-Hep-1 Human Hepatocellular Carcinoma Cells[J].Journal of Agriculture and Food Chemistry,2010,58(2):814-820.
[18] KONG C S,KIM Y A,KIM M M,et al.Flavonoid glycosides isolated from Salicornia herbacea inhibit matrix metalloproteinase in HT1080 cells[J].Toxicology in Vitro,2008,22(7):1742-1748.
[19] WANG Y P,DONG H M,ZHU M,et al.Icariin exterts negative effects on human gastric cancer cell invasion and migration by vasodilator-stimulated phosphoprotein via Rac1 pathway[J].European Journal of Pharmacology,2010,635(1-3):40-48.
[20] KIM E J,LIM S S,PARK S Y,et al.Apoptosis of DU145 human prostate cancer cells induced by dehydrocostuslactone isolated from the root of Saussurea lappa[J].Food and Chemical Toxicology,2008,46(12):3651-3658.
[21] CHOI E J,KIM G H.Evaluation of anticancer activity of dehydrocostus lactone in vitro[J].Molecular Medicine Reports,2010,3(1):185-188.
[22] XIE C Y,YANG W,LI M,et al.Cell Apoptosis Induced by δ-Elemenein Colorectal Adenocarcinoma Cells via a Mitochondrial-mediated Pathway[J].YAKUGAKU ZASSHI,2009,129 (11):1403-1413.
[23] KO J K S,LEUNG W C,HO W K,et al.Herbal diterpenoids induce growth arrest and apoptosis in colon cancer cells with increased expression of the nonsteroidal anti-inflammatory drugactivated gene[J].European Journal of Pharmacology,2007,559 (1):1-13.
[24] MENG A G,JIANG L L.Induction of G2/M arrest by pseudolaric acid B is mediated by activation of the ATM signaling pathway[J].Acta Pharmacol Sin,2009,30(4):442-450.
[25] HE M F,HUANG Y H,WU L W,et al.Triptolide functions as a potent angiogenesis inhibitor[J].International Journal of Cancer,2010,126(1):266-278.
[26] LIU J J,HUANG R W,LIN D J,et al.Antiproliferation Effects of Oridonin on HPB-ALL Cells and Its Mechanisms of Action[J].American Journal of Hematology,2006,81(2):86-94.
[27] LIU J J,HUANG R W,LIN D J,et al.Ponicidin,an Ent-Kaurane Diterpenoid Derived from a Constituent of the Herbal Supplement PC-SPES,Rabdosia rubescens,Induces Apoptosis by Activation of Caspase-3 and Mitochondrial Events in Lung Cancer Cells In Vitro[J].Cancer Investigation,2006,24(2): 136-148.
[28] SHANMUGARAJ S,SELVARAJ S,MURUGANA V P,et al.3β-hydroxylup-20(29)-ene-27,28-dioicacid dimethyl ester,a novel natural product from Plumbago zeylanica inhibits the proliferation and migration ofMDA-MB-231 cells[J].Chemico-Biological Interactions,2010,188(3):412-420.
[29] ROSAS L V,CORDEIRO M S C,CAMPOS F R,et al.In vitro evaluation of the cytotoxicand trypanocidal activities of Ampelozizyphus amazonicus(Rhamnaceae)[J].Brazilian Journal of Medical and Biological Research,2007,40(5):663-670.
[30] 马利军,王伏生.人参皂甙Rg3上调FAS表达诱导乳腺癌MCF-7细胞的凋亡[J].中国医疗前沿,2009,20(4):11-12.
[31] 王帅玉,付本懂,申海清,等.人参皂苷Rh2对MSB-1细胞的增殖抑制作用及其机理[J].中国兽医学报,2009,29(8): 1052-1061.
[32] 蒋孟军,杨 敏,周尧远,等.23-羟基桦木酸体外抑制血管生成的实验研究[J].细胞与分子免疫学杂志,2006,22 (1):88-91.
[33] XU Y,CHIU J F,HE Q Y,et al.Tubeimoside-1 Exerts Cytotoxicity in HeLa Cells through Mitochondrial Dysfunction and Endoplasmic Reticulum Stress Pathways[J].Journal of Proteome Research,2009,8(3):1585-1593.
[34] GUAN F Q,SHAN Y,ZHAO X Z,et al.Apoptosis and membrane permeabilisation induced by macranthoside B on HL-60 cells[J].Natural Product Research,2011,25(4):332-340.
[35] LEE K W,KIM H J,LEE Y S,et al.Acteoside inhibits human promyelocytic HL-60 leukemia cell proliferation via inducing cell cycle arrest at G0/G1phase and differentiation into monocyte[J].Carcinogenesis,2007,28(9):1928-1936.
[36] HSU H F,HOUNG J Y,KUO C F,et al.Glossogin,a novel phenylpropanoid from Glossogyne tenuifolia,induced apoptosis in A549 lung cancer cells[J].Food and Chemical Toxicology,2008,46(12):3785-3791.
[37] 刘 睿,顾谦群,崔承彬,等.密脉鹅掌柴的化学成分及其抗肿瘤活性[J],中草药,2005,36(3):328-332.
[38] RUAN M,JI T,YANG W J,et al.Growth Inhibition and Induction of Apoptosis in Human Oral Squamous Cell Carcinoma Tca-8113 Cell Lines by Shikonin was partly through the Inactivation of NF-κB Pathway[J].Phototherapy Research,2008,22(3):407-415.
[39] XIONG W B,LUO G,ZHOU L M,et al.In vitro and in vivo antitumor effects of acetylshikonin isolated from Arnebiaeuchroma (Royle)Johnst(Ruanzicao)cell suspension cultures[J].Chinese Medicine,2009,4(1):14.
[40] 李元圆,杨 莉,王长虹,等.草豆蔻化学成分及体外抗肿瘤作用研究[J].中国中医药大学学报,2010,24(1):72-75.
[41] JIANG R W,HAY M E,CRAIG R F,et al.Antineoplastic unsaturated fatty acids from Fijian macroalgae[J].Phytochemistry,2008,69(13):2495-2500.
[42] 高世勇,刘 溪,季宇彬,吴莱萸碱调控微管蛋白聚集阻滞HepG-2细胞周期[J].哈尔滨商业大学学报:自然科学版,2011,27(4):513-516.
