盐胁迫对大花飞燕草种子萌发的影响
2012-03-12张彦妮
张彦妮,李 博,何 淼
(东北林业大学园林学院,黑龙江 哈尔滨 150040)
目前,我国的盐碱地和次生盐碱地约占陆地面积的1/3,广泛分布在东部沿海、东北和西北等地区[1]。城市绿地盐渍化也日益严重,研究植物对盐害的抗逆能力及其耐盐机理具有重要的现实意义[2]。
大花飞燕草(Delphiniumgrandiflorum)为毛茛科翠雀花属多年生草本植物,萼片花瓣状,与花瓣同色,伸长呈狭椭圆形,花瓣2枚合生,有距,距突伸于萼距内,茎叶被柔毛。其花形别致,色彩淡雅,具有很高的观赏价值及应用前景,且全草及种子均可入药治牙痛,茎叶浸汁可杀虫[3]。目前,对大花飞燕草的研究主要局限于其化学物质的提取和药用价值的开发[4],而对其种子萌发期耐盐碱的生理特性研究尚未见报道。本研究通过不同浓度盐碱组合胁迫,探讨大花飞燕草种子萌发和幼苗生长状况,了解盐分对其种子萌发的影响和幼苗不同部位对盐的敏感性,以为引种驯化和园林应用提供参考。
1 材料与方法
1.1试验材料 大花飞燕草种子购自北京林大林业科技股份有限公司,保存于4 ℃冰箱中待用。试验于2010年5月在东北林业大学园林学院实验室进行。
1.2盐碱胁迫模拟设计 根据黑龙江省盐碱地盐分组成,选定中性单盐组(A)、混合中性盐组(B)、碱性较低单盐组(C)、碱性较高混合盐组(D)为盐碱胁迫模拟对象,根据其盐度与pH值复杂多变的特点,将4种盐(NaCl、Na2SO4、NaHCO3和Na2CO3)按不同摩尔比混合,使其盐度和pH值与选定盐分组合相同,并随着盐度的提高,pH值也不断提高。各处理组所含盐分及其体积比如表1所示。每组内设5种处理浓度,依次为25、50、100、150、200 mmol·L-1,分别以1、2、3、4 和5标识,如A组中的25 mmol·L-1标为A1,依次类推,共设计20种盐度不同的混合盐碱组合。
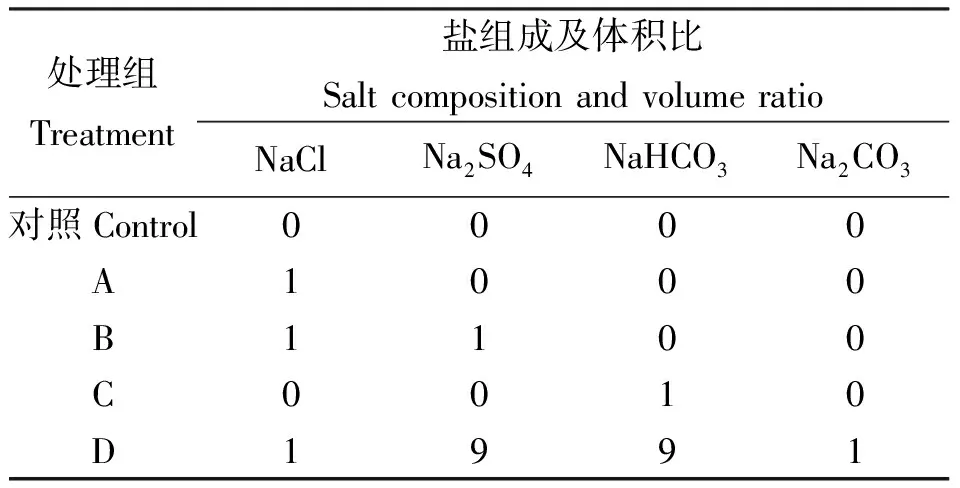
表1 各处理组所含盐分及其体积比Table 1 Salt composition and its volume ratio in different treatments
随着碱性盐比例的增加,A至D组pH值递增。每一处理组内,随盐浓度增加pH值变化不明显。各组盐浓度25~200 mmol·L-1,pH值由6.4到9.4,模拟出了20种盐碱条件(表2)。

表2 各处理组盐浓度和pH值Table 2 Salt concentration and pH value in different treatments
1.3种子处理方法 选取充实、饱满的种子用75%的酒精溶液消毒30 s,再用2%的次氯酸钠溶液处理10 min,最后用蒸馏水冲洗5~6 遍,用滤纸吸干后备用。使用直径90 mm的培养皿,皿内铺双层滤纸,每个培养皿内均匀排列40粒种子,加入3 mL盐碱混合溶液充分润湿滤纸,置于人工变温光照培养箱中进行发芽试验,培养箱内昼夜时间为16 h/8 h,温度为15 ℃,光强为5 000 lx,湿度66%。为使培养皿内的盐碱浓度保持不变,处理液和滤纸2 d更换1次。以蒸馏水作为对照,每处理重复3次。
1.4指标测定 从种子处理之日起开始观察,以种子露白为发芽的开始,依据《种子检验学》进行相关数据的测定[5],每天定时记录每个培养皿内种子萌发数,24 d后(根据具体试验所得)分别测定幼苗鲜质量。
1.4.1种子活力的测定
种子发芽率(GR)=n/N×100%;
发芽指数(GI)=∑Gt/Dt;
活力指数(VI)=GI×S。
式中,n为发芽终期全部正常发芽的种子数,N为供试种子总数;Gt为t日发芽数,Dt为相应的天数,S为芽鲜质量。
1.4.2幼苗生长相关指标的测定 幼苗先用蒸馏水冲洗干净,经吸水纸吸干后测定幼苗生长相关指标。幼苗高度和根长用游标卡尺测量。芽的鲜质量和根质量用万分之一分析天平称量。
1.5数据处理 3次重复结果计算平均值,然后采用SPSS 17.0统计分析软件进行方差分析及均值比较。Excel 2000作图。
2 结果与分析
2.2盐浓度及组合对大花飞燕草种子萌发指标的影响
2.2.1盐碱胁迫对大花飞燕草种子发芽率的影响 整体上看混合盐对种子发芽率的影响比单盐显著(图1)。大花飞燕草种子经A1、B1、C1处理后,种子的发芽率略高于对照组。随盐浓度的升高,A组处理下的种子萌发变化最为缓慢,呈现下降―上升―下降的趋势。经B组处理后,发芽率随着盐浓度的增加呈下降趋势,植物在低浓度时保持着较高的萌发率,当浓度达到100 mmol·L-1时,萌发率显著下降,B5处理组因胁迫强度过大,发芽率降为7%。C组处理下,在25、50和100 mmol·L-1时都保持着较高的萌发率,150和200 mmol·L-1时,萌发率显著下降。D组处理下的种子萌发率呈现下降趋势,变化最为明显,D5处理组因胁迫强度过大,发芽率降为3%。可见,高碱性的混合盐对大花飞燕草种子萌发的抑制作用最为显著。
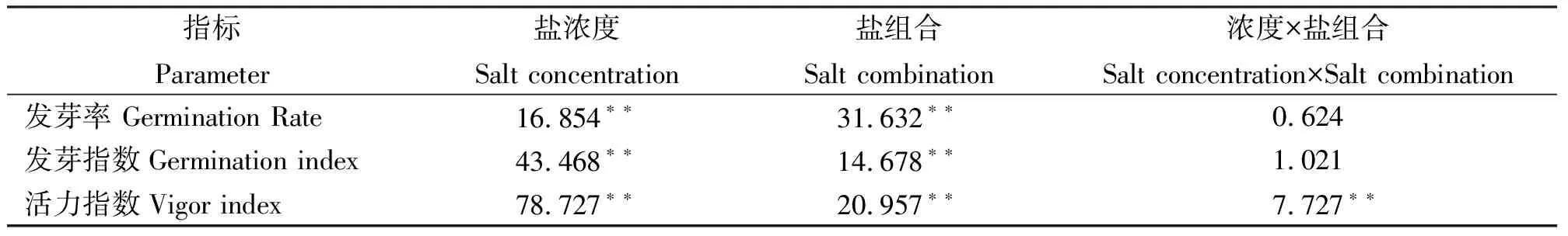
表3 盐浓度及组合对大花飞燕草种子萌发指标的影响Table 3 Effects of salt concentration and combination on seed germination of Delphinium grandiflorum
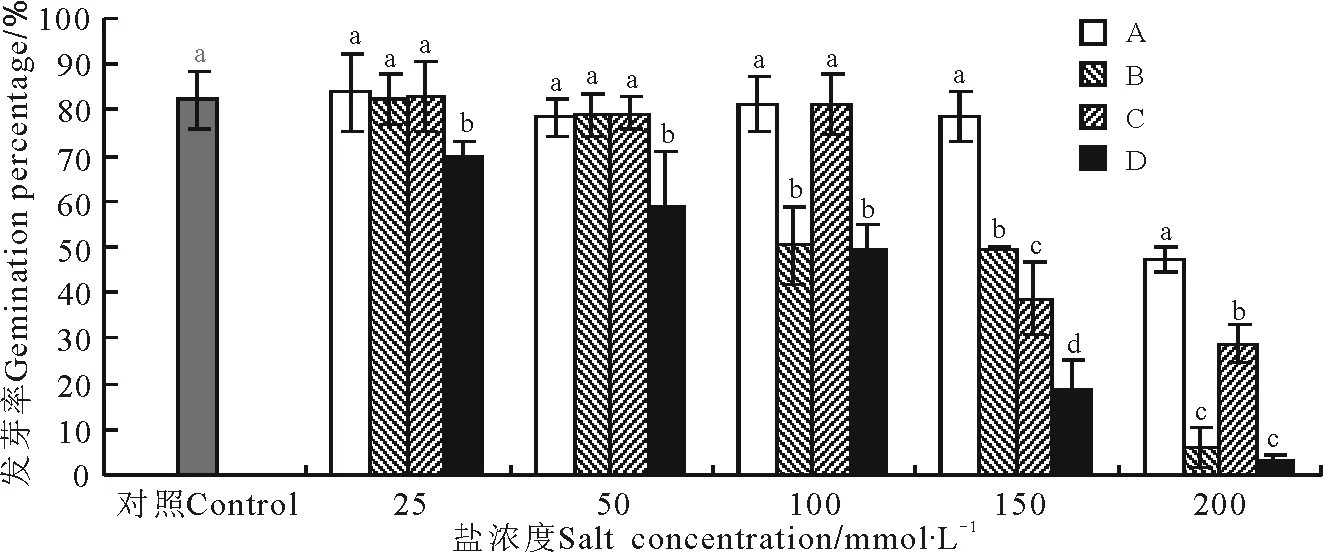
图1 不同盐胁迫条件下大花飞燕草种子的发芽率Fig.1 Seed germination percentage of Delphinium grandiflorum under different salt stress conditions
2.2.2盐碱胁迫对大花飞燕草种子发芽指数的影响 除C1处理种子的发芽速度较对照快外,大花飞燕草的发芽指数随着盐浓度增加而减小,且单盐作用下的发芽指数高于混合盐指数(图2)。
2.2.3盐碱胁迫对大花飞燕草种子活力指数的影响 在25 mmol·L-1时,NaCl处理对大花飞燕草长势有明显的促进作用。但其他的盐组合对大花飞燕草种苗生长有不同程度的抑制,种子活力指数降低。当浓度为50 mmol·L-1时,A2处理种子活力指数明显下降,小于对照;B2由0.51下降至0.28。当浓度达到100 mmol·L-1时,只有A3具有少量的生物量(图3)。其他的虽有萌发,但幼根腐烂,幼芽死亡,导致生物量接近于0,使种子丧失活力。表现出中、高盐浓度对大花飞燕草萌发后的正常生长具有很强的抑制作用。
盐浓度及其组合方式均极显著影响大花飞燕草的发芽率、发芽指数与活力指数(P<0.01),但二者互作对发芽率与发芽指数无显著影响(P>0.05)(表3)。
2.3盐胁迫对根和幼苗生长状况的影响 NaCl胁迫时,A1、A2处理的根长、根的生长速度及幼苗长、幼苗生长速度高于对照,且A1处理的根质量高于对照,说明A1处理可以促进大花飞燕草种子萌发及幼苗生长,A3处理对幼苗的根及长势影响较大,幼苗生物量最小。B1、B2处理的种子与对照差异显著(P<0.05),根、苗长及其生长速度慢。C1处理的根长变化小于幼苗的变化,说明C胁迫时,苗比根表现的敏感。D1处理的结果与对照差异最显著,根和苗生长极慢,对其影响最大(表4)。
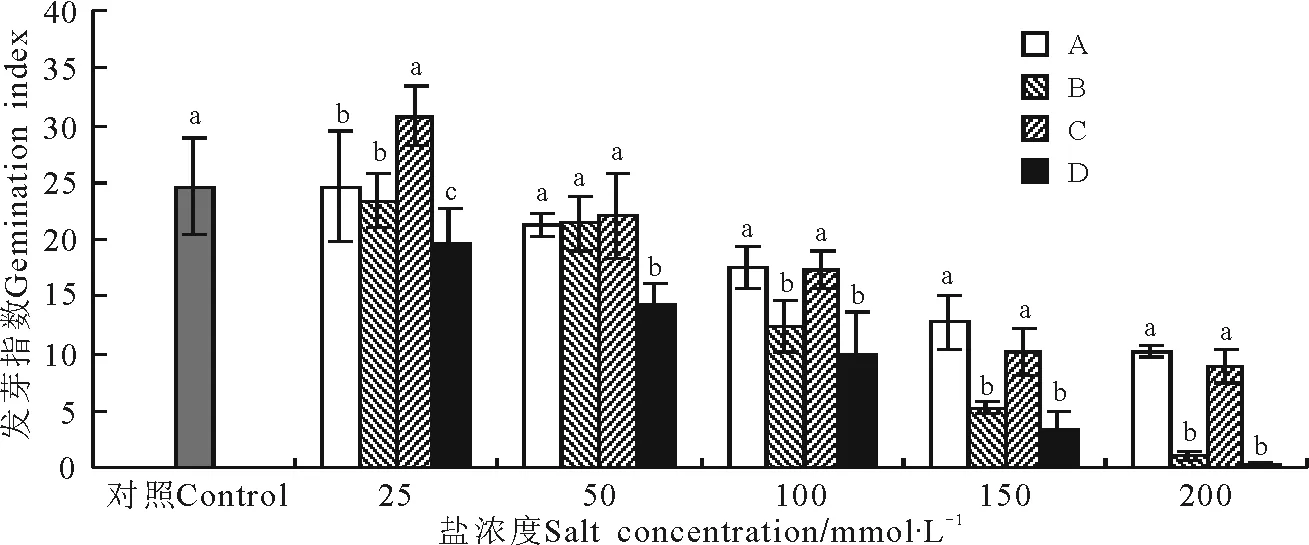
图2 不同盐胁迫条件下大花飞燕草种子的发芽指数Fig.2 Seed germination indexes of Delphinium grandiflorum under different salt stress conditions

图3 混合盐碱胁迫对大花飞燕草种子活力指数的影响Fig.3 Effects of mixed salinity-alkalinity stress on seed vigor indexe of Delphinium grandiflorum
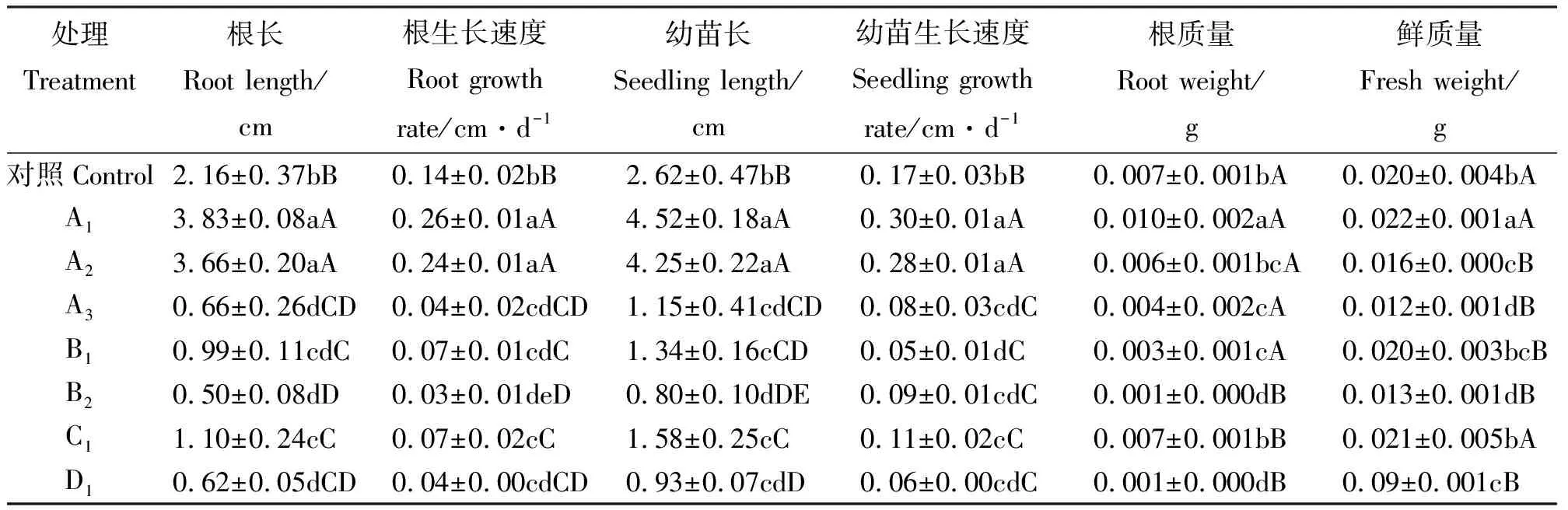
表4 盐胁迫对幼苗和根生长速度及鲜质量的影响Table 4 Effects of mixed salinity-alkalinity stress on growth rate and fresh weight of seedlings and roots
3 讨论与结论
种子耐盐性及其机制是植物耐盐性早期鉴定及耐盐个体与品种早期选择的基础[6],盐胁迫主要表现在抑制种子萌发、胚根、胚芽生长和长势方面[7-9],盐分对种子萌发的影响一般归结为渗透效应和离子效应[10]。通过对大花飞燕草种子萌发情况的综合研究,发现在25 mmol·L-1的处理浓度下,除了Na2CO3处理,其他组合处理萌发指标均高于对照组,由此表明,适宜浓度的盐碱有助于促进大花飞燕草种子发芽,这可能与低盐促进细胞膜渗透调节作用有关[11],也可能是微量的无机离子(Na+)对呼吸酶有刺激作用[12]。而经Na2CO3处理下萌发率变低,可能是由于复杂的离子反应引起的离子毒害作用导致发芽率下降。总体来看,随着浓度的升高,大花飞燕草种子的萌发率呈下降趋势。NaHCO3胁迫是Na+盐胁迫和OH-的双重作用结果,而在25 mmol·L-1的NaHCO3处理胁迫下,发芽指数最高,萌发速度最快,可能由于低浓度NaHCO3对pH值的影响导致膜上某些酶的折叠发生变化,从而影响酶的活性。从活力指数和根及苗的生长状况综合来看,中性单盐NaCl对大花飞燕草种子的萌发及生长有促进作用,这可能是由于大花飞燕草自身保护系统的耐受性所致,表现出具有较好的耐中性单盐NaCl的能力,但当盐浓度达200 mmol·L-1时,破坏了保护系统,引致其最终萌发率下降。当盐浓度达25 mmol·L-1时,Na2CO3处理严重影响根和幼苗的生长,可见高浓度混合盐碱抑制种子的正常萌发,这可能与胁迫条件下Na+和高pH值协同作用有关。随着混合盐碱溶液浓度的增加,种子的发芽率与发芽指数都低于单纯的高盐高碱,说明高盐高碱的共同作用结果远远大于单纯的高盐或高碱,即二者具有明显的协同作用。
通过大花飞燕草的萌发特性和幼苗生长特性的综合分析,可得出4种盐胁迫对种子和幼苗的危害程度随着浓度的不同,呈现不同的结果。在浓度≥25 mmol·L-1的范围时,碱性较高混合盐组>碱性较低单盐组>混合中性盐组>中性单盐组,在浓度≤25 mmol·L-1范围时,NaCl对大花飞燕草的萌发及生长具有促进作用,并且碱性较低单盐组NaHCO3的危害程度<混合中性盐组。盐浓度和盐组合对发芽率、发芽指数的影响均达到差异极显著水平,这与冯建永等[13]的研究结果相一致。
[1] 张士功,邱建军,张华.我国盐渍土资源及其综合治理[J].中国农业资源与区划,2000,21(1):52-56.
[2] Zhao F Y,Guo S L,Wang Z L,etal.Recent advances in study on transgenic plants for salt tolerance[J].Journal of Plant Physiology and Molecular Biology,2003,29(3):171-178.
[3] 刘燕.园林花卉学[M].北京:中国林业出版社,2004:162.
[4] 王锋鹏.二萜生物碱的13C核磁共振谱[J].有机化学,1982(3):161-169.
[5] 张庆春.种子检验学[M].北京:高等教育出版社,2006:75.
[6] 殷秀杰,燕昌江,李凤兰,等.混合盐碱胁迫对白三叶种子萌发的影响[J].东北农业大学学报,2009,40(12):58-61.
[7] 杜利霞,董宽虎,夏方山,等.盐胁迫对新麦草种子萌发特性和生理特性的影响[J].草地学报,2009,17(6):789-794.
[8] 纪荣花,于磊,鲁为华,等.盐碱胁迫对芨芨草种子萌发的影响[J].草业科学,2011,28(2):245-250.
[9] 丛丽丽,张蕴薇,陈新,等.盐胁迫对虉草种子萌发与幼苗生理生化的影响[J].草业科学,2011,28(12):2136-2142.
[10] Webster B D,Leopold A C.The ultrastructure of dry and imbibed cotyledons of soybean[J].American Journal of Botany,1977,64(10):1286-1293.
[11] 周婵,杨允菲.盐碱胁迫下羊草种子的萌发特性[J].草业科学,2004,21(7):34-36.
[12] 郭彦,杨洪双,赵家斌.混合盐碱对大豆种子萌发的影响[J].种子,2008,27(12):92-94.
[13] 冯建永,庞民好,张金林,等.复杂盐碱对黄顶菊种子萌发和幼苗生长的影响及机理初探[J].草业学报,2010,19(5):77-86.
