干旱胁迫对绢毛委陵菜叶片解剖结构和生理指标的影响
2012-03-12吴建慧赵倩竹崔艳桃岳莉然周蕴薇
吴建慧,郭 瑶,赵倩竹,崔艳桃,岳莉然,周蕴薇
(1.东北林业大学园林学院,黑龙江 哈尔滨 150040; 2.东北林业大学林学院,黑龙江 哈尔滨 150040)
绢毛委陵菜(Potentillasericea)是蔷薇科委陵菜属多年生草本植物,是一种良好的早春及初夏时节的观花地被植物,能够适应北方寒冷、干旱的气候环境,有良好的涵养水源、保持水土及护坡作用。目前,对委陵菜属植物的研究主要集中在资源开发利用、药用、观赏价值、引种驯化及花粉、叶表皮形态等方面[1-5],而对其生理方面特别是干旱胁迫方面的研究极少。干旱是一个世界性的问题,据统计,世界干旱、半干旱区占陆地面积的33%,我国的干旱、半干旱地区占国土面积的45%[6]。水分是影响植物分布、观赏性状和生长发育的主要环境因子之一,水分短缺已成为干旱地区限制植物生产力的主要因素。植物的抗旱性及其对干旱胁迫的响应和适应过程与其自身的抗性紧密联系,并以生化代谢、生理功能、形态适应、生长发育以及生物生产力等多种形式表现出来[7-9]。因此,系统地开展干旱胁迫模拟试验,探讨植物应对干旱环境刺激或逆境的适应及抵御机制,是把握植物对不同强度干旱胁迫响应与适应对策的有效手段,也是解答水分与植物关系的切入点[10]。本研究以绢毛委陵菜为试验材料,研究自然失水胁迫后植物叶片的丙二醛(MDA)含量、游离脯氨酸(Pro)含量和超氧化物歧化酶(SOD)活性等生理指标的变化,了解其耐旱生理响应状况,同时通过制作石蜡切片,对不同程度干旱胁迫后的叶片解剖结构进行观察,确定其耐旱能力,旨在一定程度上阐明其耐干旱机制,为抗性品种的筛选提供理论依据,也为干旱地区的城市绿化提供更多的植物材料。
1 材料与方法
1.1试验材料 研究对象为绢毛委陵菜1龄幼苗,所用幼苗采用当年生走茎进行繁殖,依据走茎的长势、株高分批栽培,于2010年6月从黑龙江省植物园移至东北林业大学苗圃中进行培育和繁殖。
1.2试验处理 2011年6月选取生长一致、发育正常的植株,用长35 cm、宽20 cm、高12 cm的盆对其进行自然失水胁迫的盆栽试验,栽培基质为土∶草炭=3∶1。采用连续控水的方法,试验前对植株进行正常的管理,给予充足的水分,保证植株的正常生长。干旱胁迫试验设对照组和处理组,两组植株的盆数分别为3和12盆,分成3小组,每小组为对照组1盆、处理组4盆,试验重复3次,从3小组各取样一次。对照组每天正常浇水,通过称重法浇水,使土壤含水量始终保持在35%~40%;处理组连续停水21 d,每3 d取样一次,测定各项生理指标;叶片解剖结构观察从处理组胁迫的第6天(土壤含水量25%~27%,轻度干旱胁迫)、第9天(土壤含水量15%~17%,中度干旱胁迫)、第18天(土壤含水量5%~7%,重度干旱胁迫)取样制作石蜡切片,每次取样均重复3次。
1.3试验方法
1.3.1植物生理指标测定方法 叶绿素含量采用乙醇浸提法测定,丙二醛含量采用硫代巴比妥酸显色法测定,游离脯氨酸含量采用磺基水杨酸显色法测定,超氧化物歧化酶含量采用氮蓝四唑法测定[11]。
1.3.2石蜡切片的制备方法 取对照组和处理组相同部位、大小一致的叶片,取叶片中心部位长0.5 cm、宽0.3 cm的样块。采样后立刻用FAA固定液固定24 h以上,参照李正理[12]的石蜡切片法,在浓度递增的酒精中脱水,用二甲苯透明,之后浸蜡、包埋、切片、粘片、脱蜡、染色、封片。试验采用Leica石蜡切片机制片,样片使用显微镜(Leica DM 2500)进行观察,所得数据为不同样片上30个视野的平均值。
1.4数据处理 测定的数据采用Excel软件制表,用SAS 17.0软件进行相关性分析。
2 结果与分析
2.1干旱胁迫对绢毛委陵菜叶片解剖结构特征的影响 绢毛委陵菜叶片的解剖结构包括上下表皮、栅栏组织、海绵组织等(图1)。上下表皮均为单层细胞,细胞呈长卵形、近圆形或近长方形等不规则形状,细胞彼此排列紧密,没有细胞间隙。上表皮细胞体积大于下表皮的,近上表皮的一层排列整齐且紧密的柱状细胞为栅栏组织,少数有两层,栅栏组织与下表皮之间排列着多层散乱不规则且细胞间隙较大的部分为海绵组织。
选择上表皮细胞厚度、下表皮细胞厚度、栅栏组织厚度、海绵组织厚度、栅栏组织同海绵组织的比值5项指标来观察和分析叶片解剖结构受干旱胁迫后的变化。随着干旱胁迫程度的加重叶片厚度出现显著差异(P<0.05),并呈逐渐减小的趋势;不同胁迫后上表皮厚度差异不显著,但处理组均显著小于对照组,且随胁迫加重厚度逐渐减小;重度胁迫时下表皮厚度显著小于轻度与中度胁迫,中度胁迫时小于轻度胁迫但差异不显著;栅栏组织和海绵组织的厚度均随胁迫程度加重而减小,除轻度和中度胁迫栅栏组织厚度差异不显著外其他均差异显著;受到干旱胁迫后处理组叶片的栅栏组织同海绵组织的比值均大于对照组,但不同胁迫程度间差异不显著,大小变化为中度胁迫>重度胁迫>轻度胁迫(表1、图1)。
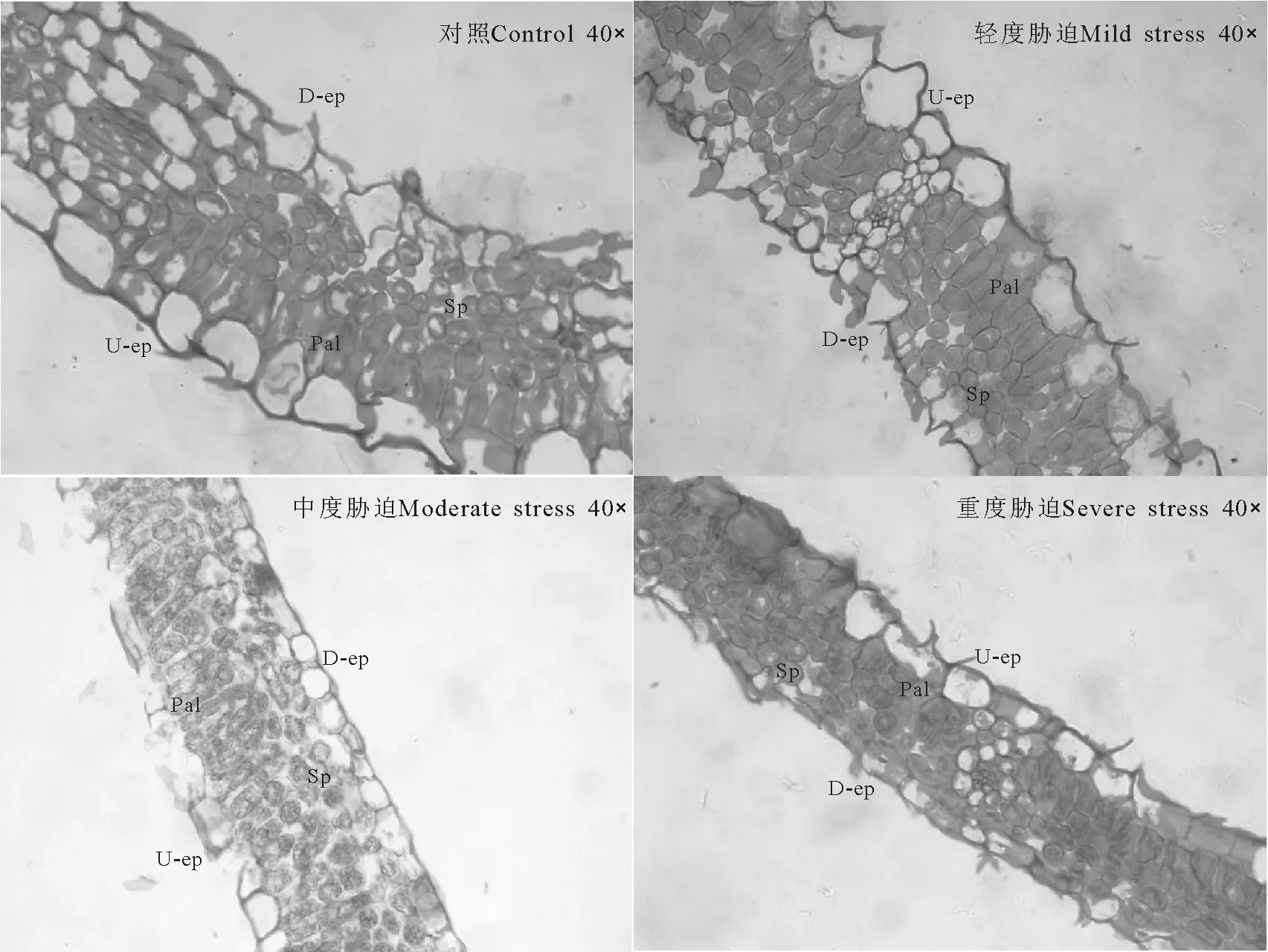
图1 干旱胁迫对叶片解剖结构的影响Fig.1 Effects of drought stress on anatomical structure of leaves
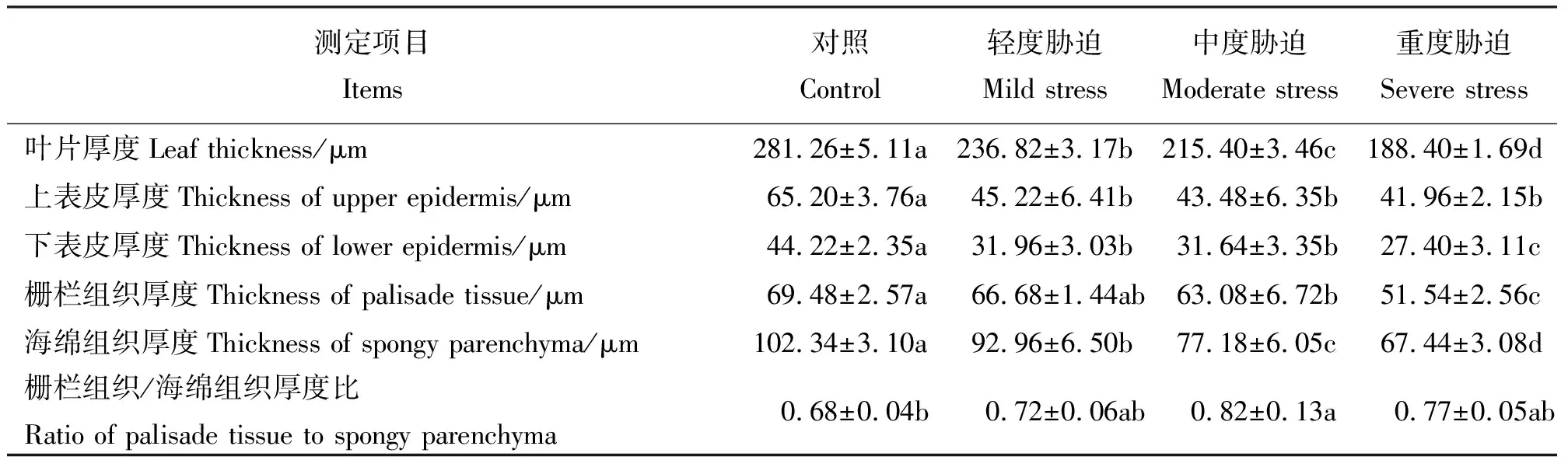
表1 不同干旱胁迫条件下绢毛委陵菜叶片解剖结构变化Table 1 Anatomical structures of Potentilla sericea leaves under drought stress
2.2干旱胁迫对绢毛委陵菜叶绿素含量的影响 干旱胁迫下,绢毛委陵菜叶绿素含量随着干旱胁迫的加重持续下降。胁迫前9 d叶绿素含量下降幅度较大,胁迫第9天时叶绿素含量明显低于胁迫初期,降幅达27.32%,之后下降幅度有所减缓,胁迫第15天同第9天相比下降10.49%,但从胁迫第15天开始叶绿素含量下降幅度又开始小幅变大,胁迫第21天较第15天下降幅度达16.86%。对照组叶绿素含量较稳定,变化范围在5.47~6.22 mg·g-1,且对照组含量均高于胁迫组(图2)。
2.3干旱胁迫对绢毛委陵菜丙二醛含量的影响 随着干旱胁迫程度的加重,MDA的含量逐渐增加。胁迫到第6天时MDA含量没有明显变化,但当胁迫达到第9天时MDA的含量开始明显升高,之后变化趋于平缓,没有大幅度的升降。对照组MDA含量在整个试验期间变化较平稳,没有明显的升降,但均低于胁迫组(图3)。
2.4干旱胁迫对绢毛委陵菜游离脯氨酸含量的影响 当植株受到干旱胁迫后Pro含量总体呈上升的趋势。在干旱胁迫前9 d Pro含量没有明显的变化,但从胁迫第9天开始直到第18天Pro含量急剧的上升,在第18天时Pro含量达到最大值,之后开始下降,但胁迫第21天时Pro含量仍显著大于胁迫初期。对照组Pro含量变化不大(图4)。

图2 自然失水胁迫对绢毛委陵菜叶片叶绿素含量的影响Fig.2 Effects of drought stress on chlorophyll content of Potentilla sericea leaves
2.5干旱胁迫对绢毛委陵菜超氧化物歧化酶活性的影响 在整个胁迫期间,SOD活性基本呈先上升后下降的趋势,胁迫前15 d SOD活性基本随胁迫天数的增加而增加,在胁迫第15天时SOD活性达到最大,随后开始下降。对照组SOD活性变化范围不大,走势较稳定,胁迫组SOD活性基本上都高于对照组(图5)。

图3 自然失水胁迫对绢毛委陵菜叶片MDA含量的影响Fig.3 Effects of drought stress on MDA content ofPotentilla sericea leaves

图4 自然失水胁迫对绢毛委陵菜叶片Pro含量的影响Fig.4 Effects of drought stress on Pro content of Potentilla sericea leaves

图5 自然失水胁迫对绢毛委陵菜叶片SOD活性的影响Fig.5 Effects of drought stress on SOD activity of Potentilla sericea leaves
3 讨论
叶片是植物体暴露在环境中面积最大的器官,在复杂的外界环境中反应最为敏感,最容易因适应环境而改变它的形态和结构[13-15]。植物的水分代谢一旦失去平衡,就会打乱植物体的正常生理活动,严重时能使植物体死亡[16]。
植株受到不同程度干旱胁迫后叶片解剖结构会产生相应的变化。随着干旱胁迫程度的加重,除栅栏组织与海绵组织厚度比外,其他几项指标均逐渐减小,但有的呈显著性差异,有的差异不显著,表明干旱胁迫的加剧在叶片解剖结构上主要表现为细胞逐渐变小,细胞间隙变小,排列逐渐紧密,叶片解剖结构各部分均逐渐变小。干旱胁迫下,叶片变薄、栅栏组织与海绵组织厚度比值增大,是为了以最大限度减少植物对辐射的直接接触和水分的蒸腾,保存有限水分并充分加以利用,是典型的节约型适应[17]。绢毛委陵菜受到胁迫后栅栏组织与海绵组织厚度比值大于对照组,表明绢毛委陵菜具有较强的抗旱能力。
叶绿素的合成与水分关系密切,植物受到逆境胁迫时叶绿素结构会变得不稳定,极易发生变化。一般认为,干旱胁迫可导致植物叶片缺水影响叶绿素的生物合成,而且促进已形成的叶绿素的降解,造成叶片发黄[18]。聂华堂[19]认为,抗旱性越强的树种,随着干旱胁迫程度的加深,叶绿素含量的变化幅度越小,这同本研究结果基本一致。随着胁迫天数的增加叶绿素含量下降幅度逐渐变小,在胁迫后期下降幅度虽然又有所升高,但变化幅度仍小于胁迫初期,说明绢毛委陵菜具备一定的抗旱性。
丙二醛是细胞膜质过氧化作用的主要产物之一,其含量可以表示膜质过氧化作用的程度[20]。因此,丙二醛的含量可以反映植物抗干旱胁迫的能力,了解植物膜结构受伤害的程度。本试验中,随着干旱胁迫程度的加重丙二醛含量有所增加,说明干旱加速了膜质过氧化作用,但丙二醛含量并非持续增加,当胁迫到第9天丙二醛含量开始趋于平稳,说明绢毛委陵菜有一定的抗旱能力。
游离脯氨酸是细胞质中重要的渗透剂和防脱水剂[21]。在正常情况下,植物体内游离脯氨酸含量很低;在干旱胁迫下,它的增加有助于细胞或组织持水,减少脱水,维持各器官较强的渗透,从而提高植株对干旱的适应能力[22]。本试验中,胁迫第9天时游离脯氨酸含量急剧升高,之后持续增加,在胁迫第18天时含量达到最大值,直到胁迫第21天时含量有所下降。游离脯氨酸含量的增加能够减轻干旱胁迫对植株造成的伤害,植物体内游离脯氨酸含量积累持续时间的长短同积累量的多少也是植物抵抗干旱胁迫能力的体现。绢毛委陵菜受到干旱胁迫后游离脯氨酸含量达到如此大量的积累,且持续时间较长,说明绢毛委陵菜抵抗干旱胁迫的能力较强。
超氧化物歧化酶是植物体内清除活性氧的保护酶类,能催化超氧自由基的歧化作用,形成O2和H2O2,消除超氧阴离子自由基,减轻膜脂过氧化作用,维持活性氧代谢的平衡,从而对机体起保护作用[23]。植物体内超氧化物歧化酶活性的强弱往往与植物抵抗逆境的能力有关,它在抗氧化酶类中处在核心地位。本试验中,超氧化物歧化酶活性的变化基本表现为先升高后下降的趋势,胁迫15 d时是超氧化物歧化酶活性变化趋势的转折点,胁迫15 d后超氧化物歧化酶的活性开始下降。活性上升是植物对于遭受干旱胁迫而产生的超氧自由基做出的保护性应激反应,之后活性的下降可能是植物在重度干旱胁迫下受到较严重的伤害,酶保护系统也遭到了一定的破坏,从而导致超氧化物歧化酶活性下降,但下降后超氧化物歧化酶活性仍高于胁迫初期,并没有失去活性,说明绢毛委陵菜具有较强的抗旱适应能力。
综上所述,通过对植物叶片解剖结构和几个较重要生理指标的研究发现,绢毛委陵菜受到干旱胁迫后植物叶片解剖结构同体内的生理生化活动都受到了影响,发生了相应的变化。依据植物在这两个方面的变化情况以及通过以上对试验结果的分析表明绢毛委陵菜对于干旱胁迫具有一定的抵抗能力,能够适应较干旱的环境条件。
[1] 卞勇,吕冬霞,张玉泉,等.扁蓄和叉叶委陵菜的草坪利用研究[J].草业科学,2004,21(7):66-68.
[2] 王晓红,王索玲,姜殿勤,等.野生地被植物光叉委陵菜的引种栽培[J].长春大学学报(自然科学版),2006,16(3):69-71.
[3] 张彦芬,吴学明.青藏高原东北部鹅绒委陵菜资源及开发利用前景的研究[J].西北农业学报,2006,15(3):193-200.
[4] 由凤丽,梁彦涛,曲丽娜,等.大庆地区委陵菜属植物花粉形态研究[J].中国农学通报,2010,26(16):337-340.
[5] 田丽,周新宗,孙航,等.7种委陵菜属植物叶表皮微形态的研究[J].草业科学,2009,26(2):53-56.
[6] 高祥斌,张秀省,蔡连捷.干旱胁迫对白蜡苗生理指标的影响[J].林业科技,2009,34(5):7-9.
[7] 杨帆,苗灵凤,胥晓,等.植物对干旱胁迫的响应研究进展[J].应用与环境生物学报,2007,13(4):586-591.
[8] 鲁萍,桑卫国,马克平.外来入侵种飞机草在不同环境胁迫下抗氧化酶系统的变化[J].生态学报,2006,26(11):3578-3585.
[9] 赵丽英,邓西平,山仑.活性氧的清除系统对干旱胁迫的响应机制[J].西北植物学报,2005,25(2):413-418.
[10] 罗大庆,薛会英,权红,等.干旱胁迫下砂生槐、锦鸡儿的生理生化特性与抗旱性[J].干旱区资源与环境,2011,25(9):122-127.
[11] 李合生.植物生理生化原理和技术[M].北京:高等教育出版社,2000:130-260:
[12] 李正理.植物制片技术[M].第二版.北京:科学出版社,1987:129-137.
[13] Castro-Diez P,Puyravaud J P,Cornelissen J H C.Leaf structure and anatomy as related to leaf mass per area variation in seedlings of a wide range of woody plant species and types[J].Oecologia,2000,124:476-486.
[14] England J R,Attiwill P M.Changes in leaf morphology and anatomy with tree age and heigh in the broadleaved evergreen species,EucalypturegnansF.Muell[J].Trees Structure and Function,2006,20:79-89.
[15] Kocsis M,Darok J,Borhidi A.Comparative leaf anatomy and morphology of some neotropicalRondeletia(Rubiaceae) species[J].Plant Systematics and Evolution,2004,248:205-218.
[16] 邵钰,邱菊,干友民,等.干旱胁迫对西南野生马蹄金生理特性的影响[J].草业科学,2011,28(6):1004-1008.
[17] 薛静,王国骄,李建东,等.不同水分条件下三裂叶豚草叶解剖结构的生态适应性[J].生态环境学报,2010,19(3):686-691.
[18] 艾克拜尔.伊垃洪,周抑强,等.土壤水分对不同品种棉花叶绿素含量及光合速率的影响[J].中国棉花,2000,27(2):21-22.
[19] 聂华堂.干旱胁迫下柑橘的生理变化与抗旱性关系[J].中国农业科学,1991,24(4):78-85.
[20] 祁娟,徐柱,马玉宝,等.披碱草属六种野生牧草苗期抗旱胁迫的生理变化[J].中国草地学报,2008,30(5):18-24.
[21] 王茂良.植物抗渗透胁迫及其与脯氨酸的关系[J].北京园林,2006,22(2):21-24.
[22] 刘正刚.辐射松、油松幼苗抗旱性研究[D].雅安:四川农业大学,2007:21.
[23] Shalata A,Neumann P M.Exogenous ascorbic acid (vitamin C) increases resistance to salt stress and reduces lipid peroxidation[J].Journal of Experimental Botany,2001,52(364):2207-2211.
