MAP30基因转化烟草的研究
2012-03-12陈秀玲侯莉华李小梅王傲雪
栾 杰,陈秀玲,侯莉华,李小梅,王傲雪*
(1.东北农业大学园艺学院,哈尔滨 150030;2.大庆市教师进修学院,黑龙江 大庆 163311)
MAP30是从苦瓜果实和种子中分离纯化得到的一种单链、I型核糖体失活蛋白,其分子质量为30 ku[1]。MAP30不但具有抗肿瘤、抗菌、抗病毒等多种生物学活性,而且它还具有特异性,只对病毒感染的细胞有效,对正常细胞无毒副作用[2]。MAP30这些独特的优势,使其具有成为抗肿瘤、抗病毒的治疗药物的可能性[3-6]。烟草是基因工程生产的模式植物,其叶片中富含蛋白质,一般为15%,可高达20%,蛋白质提取后呈结状,无异味,水溶性好。研究表明,烟草悬浮细胞通常是人们首选培养细胞,由于植物细胞培养的生产环境可以人为控制、下游纯化较为方便,因此比较适于生产药用蛋白,具有开发利用的广阔前景。
本研究以烟草叶片为受体,通过农杆菌介导法将MAP30基因导入烟草基因组中,以烟草为生物反应器为生产MAP30药用蛋白提供新材料。
1 材料与方法
1.1 材料
供试烟草BY2种子、植物表达载体pBIMAP30质粒及农杆菌EHA105菌株由本实验室保存。限制性内切酶(Bam HⅠ、SacⅠ)、pfu酶购自TaKaRa公司;卡那霉素(Kan)、利福平(Rif)购自Bio BASIC公司;标准分子质量Trans2K购自北京全式金生物技术有限公司;质粒提取试剂盒购自上海生工生物工程技术服务有限公司。
1.2 方法
1.2.1 培养基
YEP培养基:胰蛋白胨10 g、酵母提取物5 g、NaCl 5 g,蒸馏水定容到1000 mL,NaOH调节pH至7.0,固体培养基含0.8%琼脂。M1:MS基本培养基;2%MSO菌液重悬培养基:MS粉4.3 g、肌醇100 mg、VB1(1 mg·mL-1)0.4 mL、蔗糖20 g,蒸馏水定容至1000 mL;M2:预培养及共培养培养基,MS+1.0 mg·L-16-BA+0.2 mg·L-1NAA;M3:分化及筛选培养基,MS+1.0 mg·L-16-BA+0.2 mg·L-1IAA+500 mg·L-1Cef;M4:生根培养基,1/2 MS+500 mg·L-1Cef,pH 5.8[7],固体培养基均含0.8%琼脂,培养基均121℃、高温、高压灭菌20 min。
1.2.2 烟草无菌苗的制备
将烟草种子用70%酒精冲洗30 s,无菌水冲洗3~4次后,在含有10%的NaClO溶液中灭菌10 min,再用无菌水冲洗3~4次,将种子摆在M1培养基中,光照培养箱中培养,当苗长出4~5片真叶时进行转化[8]。
1.2.3 植物表达载体转化农杆菌
通过冻融法将植物表达载体质粒转入农杆菌EHA105中,在含有50 mg·L-1Kan、50 mg·L-1Rif的培养基上培养48~96 h至有单菌落长出,提取农杆菌质粒,以两条特异引物1ST-S:5'AAGGATCC ACCATGGTGGTATGCTTACTAC 3';1ST-A:5'AT TCACAACAGATTCCCC 3'进行PCR鉴定,反应条件为94℃预变性5 min;94℃变性30 s、54℃退火20 s、72℃延伸1 min,30个循环;72℃延伸5 min。质粒用Bam HⅠ、SacⅠ进行双酶切鉴定。
1.2.4 侵染菌液的制备
挑取转化的农杆菌单菌落接种于含有50 mg·L-1Kan和50 mg·L-1Rif的10 mL YEP液体培养基中,28 ℃,200 r·min-1过夜震荡培养至OD600为0.5左右;按1∶10的比例将菌液转接入50 mL YEP培养基中进行二次活化,200 r·min-1,28℃继续震荡培养至OD600约0.5;菌液在4 ℃、10000 r·min-1条件下离心10 min,菌体用50 mL 2%的MSO培养基重新悬浮;使菌液OD600=0.5准备用于侵染。
1.2.5 选择培养中Kan选择压的确定
本试验共设置0、30、40、50、60、70、80、90、100、110、120 mg·L-1Kan 11个水平,分别于15、30 d后统计愈伤组织诱导率及芽诱导率。
1.2.6 烟草遗传转化
1.2.6.1 预培养时间对烟草叶片转化的影响
烟草叶片切成0.5 cm2接种在M2培养基上,设6个时间梯度:0、12、24、36、48、72 h,每个处理60个外植体。
1.2.6.2 共培养时间对烟草叶片转化的影响
各处理外植体用2%MSO培养基重悬菌液侵染20 min后接种于M2培养基,共培养时间设为:0、12、24、48、72、96 h,然后转入M3培养基培养,30 d后观察子叶不定芽分化情况。
1.2.6.3 转化烟草外植体再生成植株将长至2~4 cm不定芽切下,转入M4上诱导生根。苗长至4 cm左右时,揭开封口膜,在室内炼苗2 d,栽于温室培养。
1.2.7 抗性植株的检测
1.2.7.1 转化植株的PCR检测
取7株转化抗性植株与1株未转化植株,采用CTAB法提取植物基因组DNA,检测MAP30基因是否已经整合到烟草基因组中。
1.2.7.2 转化植株的RT-PCR分析
采用Trizol法提取PCR扩增呈阳性转化植株叶片的总RNA,逆转录成cDNA,进行PCR扩增。
2 结果与分析
2.1 植物表达载体转化农杆菌的PCR及酶切鉴定
从图1可以看出,经PCR扩增出867 bp大小的条带,鉴定其为阳性质粒。将能正确扩增的质粒进行Bam HⅠ,SacⅠ双酶切,结果与预期片断大小相同,如图2所示。
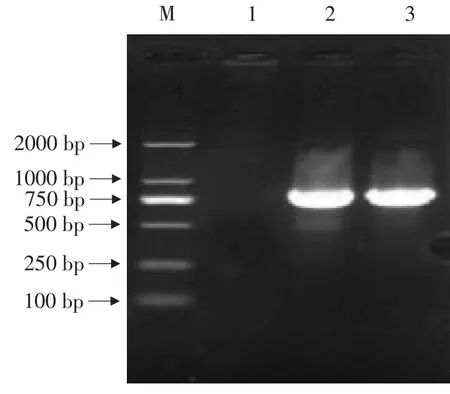
图1 EHA105单菌落的PCR产物Fig.1 PCR products of EHA105 single clone
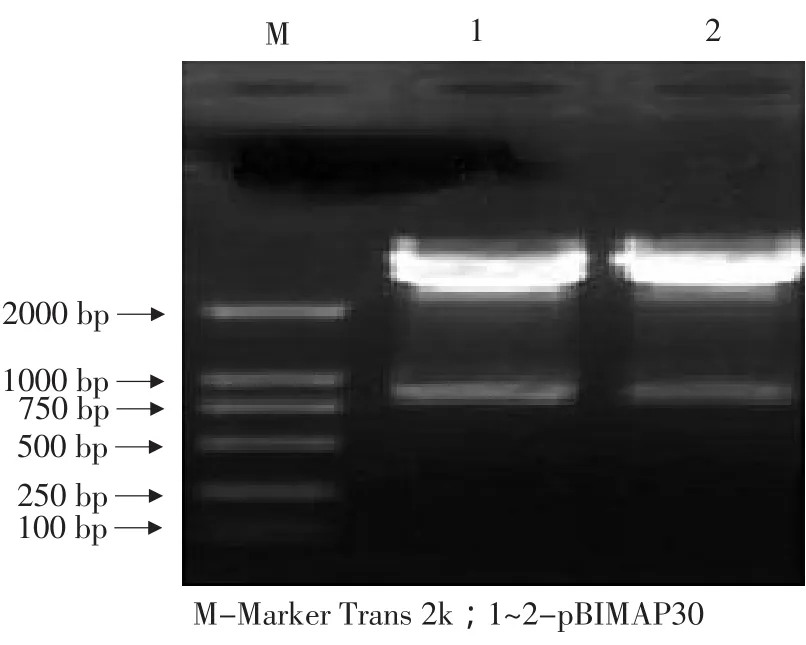
图2 pBIMAP30的双酶切电泳图谱Fig.2 Digestion products of pBIMAP30 by enzyme Bam H I and Sac I
2.2 选择培养中Kan选择压的确定
研究表明,随着Kan浓度增加,愈伤组织诱导率和芽诱导率随之降低,当Kan浓度为90 mg·L-1时,愈伤组织诱导率和芽诱导率都较低,当其浓度达到100 mg·L-1时,叶片分化完全受抑制。所以本试验选择Kan浓度为100 mg·L-1,如图3所示。
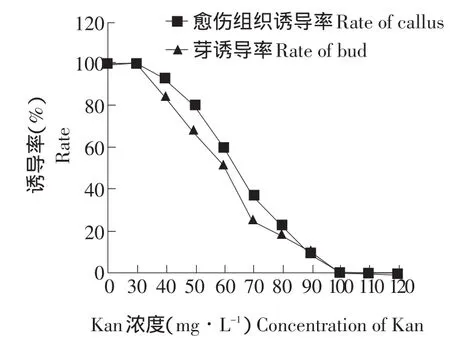
图3 不同Kan浓度对烟草愈伤组织诱导率和芽诱导率的影响Fig.3 Effect on of different Kan concentrations on the rate of tobacco callus and bud
2.3 预培养时间对烟草叶片转化和再生的影响
由表1可知,预培养时间较长或较短均不利于转化及再生。36 h预培养时,抗性愈伤组织和抗性芽形成最多,愈伤组织诱导率为76.4%,芽诱导率74.5%。因此,以36 h预培养为宜。
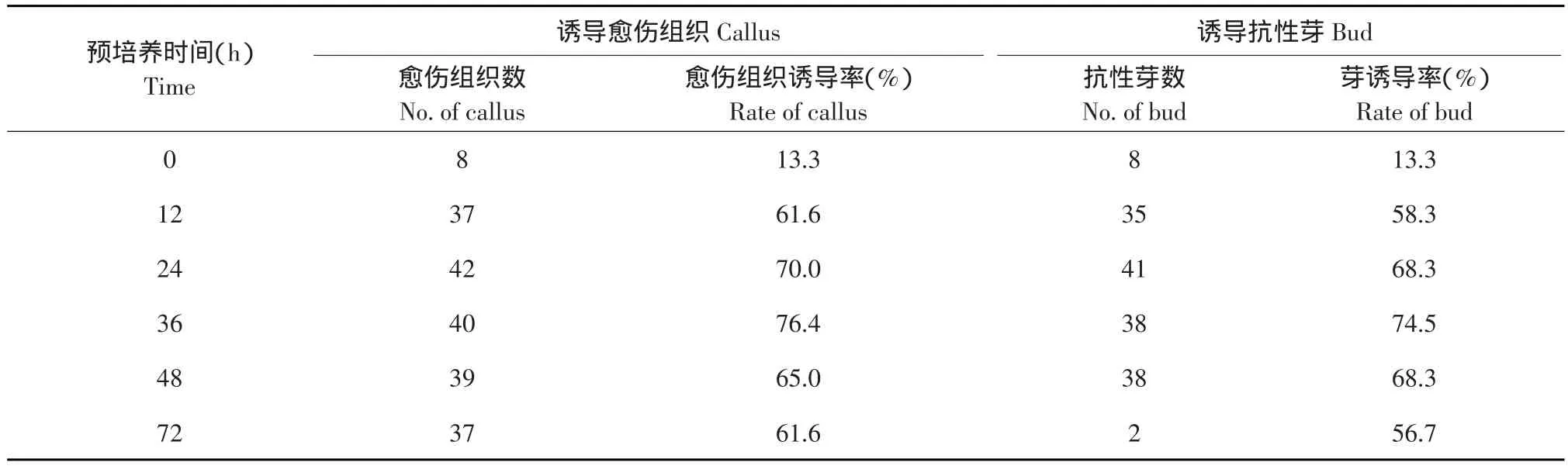
表1 预培养时间对转化效率的影响Table 1 Effect of pre-culture time on transformation
2.4 共培养时间对烟草叶片再生及转化的影响
结果见表2。
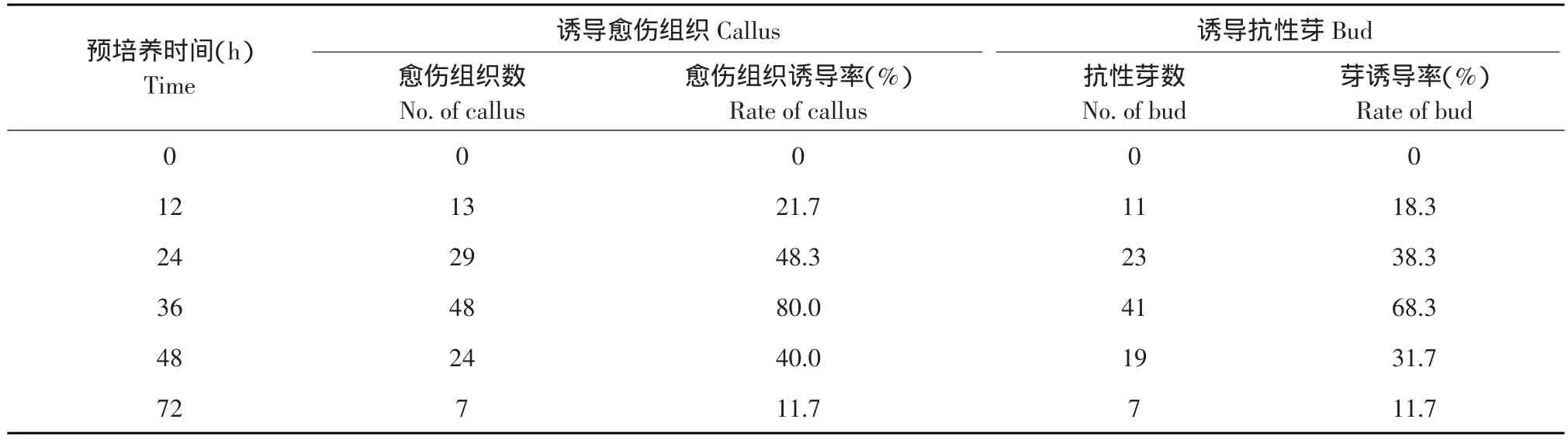
表2 共培养时间对转化效率的影响Table 2 Effect of different co-culture time on transformation
从表2可以看出,48 h共培养对外植体愈伤组织诱导率和芽诱导率都较高。
2.5 抗性转化植株的获得
通过农杆菌侵染、Kan抗性筛选、诱导生根、移栽,获得抗性烟草植株,如图4所示。

图4 烟草遗传转化过程Fig.4 Process of tobacco genetic transformation
2.6 转化植株的PCR检测
对转化植株进行PCR检测,5株转化烟草植株867 bp处均有电泳条带,而对照无条带。
如图5所示,说明外源基因已经整合到烟草基因组中。
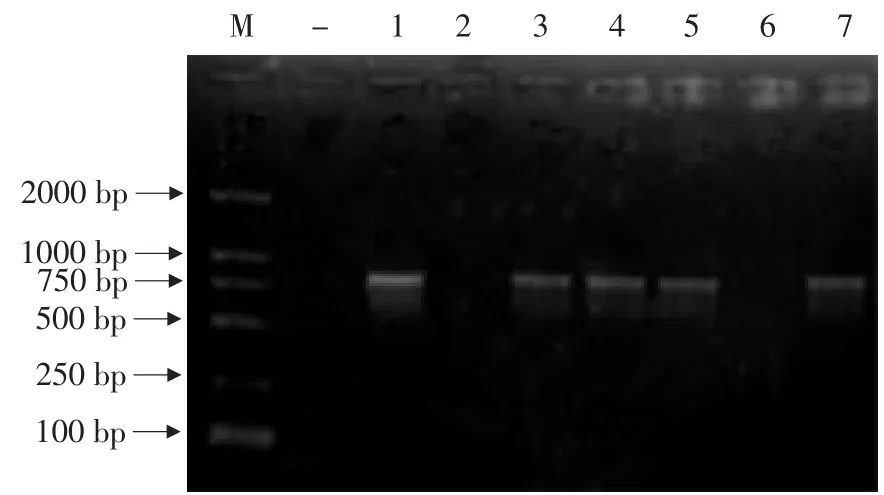
图5 转化植株的PCR检测Fig.5 PCR detection of transgenic tobacco plant
2.7 转化植株的RT-PCR检测
对5株PCR检测呈阳性的植株,提取叶片总RNA进行RT-PCR分析(见图6)。
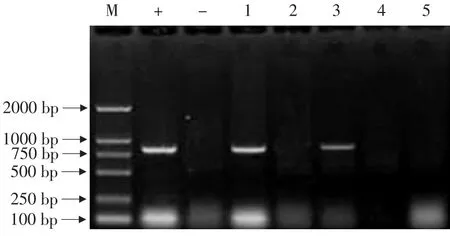
图6 转化植株的RT-PCR检测Fig.6 RT-PCR detection of transgenic tobacco plant
如图6所示,有2株烟草转化植株RT-PCR呈阳性,说明MAP30基因在转录水平表达。
3 讨论与结论
在农杆菌介导的遗传转化中,适合T-DNA转移的反应条件和感受细胞的形成是成功转化的关键[9]。选择适宜的预培养时间能使伤口部分愈合,使其对农杆菌侵染耐受性增强。预培养时间过长,伤口愈合部分增多,农杆菌侵染的困难增加,外源基因不易导入。T-DNA转移到植物细胞是在共培养这个阶段完成的,共培养时间的长短将直接影响到目的基因整合及转化细胞的数量。外植体经过农杆菌侵染后,T-DNA须经16 h以上才能向植物细胞转移[10]。在本研究中,烟草叶片预培养36 h转化效率最高,烟草转化时农杆菌与外植体共培养时间以48 h为宜。MAP30是一种非常有效的广谱抗肿瘤、抗病毒植物蛋白。基于成本及来源等方面因素,植物基因工程是大批量生产MAP30重组蛋白的首选方法。烟草作为基因转化的模式植物被广泛用于遗传转化研究[11-12]。烟草生长周期短,易于得到再生植株,蛋白质含量高,作为生物反应器生产外源蛋白,生产成本低,适合大规模生产。
尽管有许多问题还需要作进一步探讨,但利用转基因植物生产医药蛋白是一种经济有效的途径。
[1] Lee H S,Huang P L,Nara P L,et al.MAP30:A new inhibitor of HIV infection and replication[J].FEBS Letters,1990,272(1-2):12.
[2] 林育泉,周鹏,曾召绵.苦瓜MAP30蛋白基因克隆、表达及其抗肿瘤活性研究[J].中国生物工程杂志,2005,25(5):60-66.
[3] 孟延发,孟雪琴,张雪梅,等.苦瓜籽核糖体失活蛋白的基本性质研究[J].兰州大学学报:自然科学版,2000,36(4):80.
[4] Lee H S,Huang P L,Chen H C,et al.Anti HIV and anti tumor activities of recombinant MAP30 from bitter melon[J].Gene,1995,161(2):151.
[5] Huang P L,Chen H C,Kung H F,et al.Anti HIV plant proteins catalyze to pological changes of DNA into inactive forms[J].Biofactors,1992,4(1):37.
[6] 高玉忠,吴光耀,张天民.重组苦瓜蛋白MAP30及其制剂的研制[J].中国生化药物杂志,2003,24(1):45.
[7] 刘荣梅,李凤兰,胡国富,等.转CBF3基因烟草的抗寒性研究[J].东北农业大学学报,2011,42(1):119-123.
[8] 李晶,刘煜,嵩连梅,等.转DREB1A基因提高烟草抗逆性的研究[J].东北农业大学学报,2011,42(1):124-129.
[9] Groot M J A,Bundock P,Hooykaas P J J,et al.Agrobacterium tumefaciens-mediated transformation offilamentous fungi[J].Nature Biotechnology,1998,16:839-842.
[10] 王关林,方宏筠.植物基因工程[M].2版,北京:科学出版社,2002:393.
[11] 张付云,李伟,张瑛,等.NtSKP1基因的反义载体构建及转基因烟草的产生[J].生物技术通报,2010(4):145-149.
[12] 周颖.玉米核糖体失活蛋白基因z108在烟草原生质体中的转化及其表达[J].生物技术通报,2010(4):100-102.
