SSR分子标记分析彩色马铃薯品种间的遗传关系
2012-03-12李先平王冬冬陈秀华朱延明
李先平,王冬冬,陈秀华,,朱延明,陈 勤,*
(1.东北农业大学生命科学学院,哈尔滨 150030;2.加拿大农业及农业食品部莱斯布里奇研究中心,莱斯布里奇,艾伯塔省,加拿大 T1J4B3;3.云南省农业科学院经济作物研究所,昆明 650205)
马铃薯是世界上种植最广泛的粮食作物之一,也是人类饮食中重要的抗氧化活性食物的来源。马铃薯中含有多酚、类胡罗卜素、类黄酮和维生素C等多种抗氧化活性物质。近年开发的彩色马铃薯除含有以上各种抗氧化活性物质外,还含有多种花青素色素,使其抗氧化活性比常见的白肉和黄肉马铃薯增加2~3倍[1],食用彩色马铃薯更有益于人体健康,这使得育种学家把目标集中到高色素含量的彩色马铃薯新品种选育上。Reyes等研究发现彩色马铃薯块茎薯皮含有较多的花青素色素[2],其含量比薯肉高出0.9~1.6倍,但薯皮对花青素的贡献只有整个块茎的20%左右,马铃薯花青素主要还是来自于薯肉,因而培育高色素含量彩色马铃薯新品种关键在于薯肉色素含量高低。
随着彩色马铃薯抗氧化、抗癌、抑制肿瘤活性等诸多保健功能的发现利用,彩色马铃薯成为当前马铃薯育种研究热点。目前彩色马铃薯的研究主要集中于色素含量、色素稳定性及保健功能等方面,研究使用的彩色品种为国际上现有品种如“Russian Blue”,“Purple Peruvian”和“Purple Majesty”等紫肉品种和“Mountain Rose”、“Red Cardinal”等红肉品种[3-4]。而这些彩色马铃薯品种来源、遗传背景等尚不清楚,因此对彩色马铃薯品种间遗传关系进行研究,利用亲缘关系较远的彩色马铃薯彼此杂交,发挥杂种优势,有利于培育色素含量更高的彩色马铃薯新品种。
分子标记技术广泛用于植物遗传育种、品种鉴定、生物多样性分析、遗传图谱构建、基因定位与克隆和分子标记辅助育种等诸多领域。其中SSR(简单重复序列),又称微卫星(Microsatellite),由1~6个核苷酸为单位多次串联的DNA序列组成,其序列侧翼具有高度保守的DNA序列,重复次数差异较大,是检测多态性的有效方法。SSR具有试验操作简便、重复性好、多态性高、数量和信息量丰富、共显性遗传等特点,被广泛用于动植物遗传研究中。1995年Veilleux等首次利用SSR分子标记研究马铃薯[5],其后SSR分子标记被广泛应用于马铃薯的遗传关系分类[6-8]、品种鉴定[9]、核心种质资源收集评价[10]等领域。
目前已开发200多个马铃薯SSR分子标记引物,Milbourne等公布了遍布马铃薯12条染色体的112个SSR分子标记引物[11];Ashkenazi等开发出30对SSR引物用于研究马铃薯野生种与普通栽培种的多态性[12];Feingold等通过EST数据库的DNA序列信息设计开发了64个SSR引物用于马铃薯遗传图谱构建[13]。Ghislain等于2004年通过对近1000个马铃薯品种和品系的筛选鉴定[9],从156对SSR引物中筛选出18对表现好的SSR引物用于马铃薯研究,并于2009年通过对742个马铃薯品种的筛选鉴定,将多态性好、信息量大、重复性好的SSR引物从原来的18对SSR引物扩增至24对[14]。Spooner等用50对SSR引物对742个马铃薯品种8个马铃薯野生种进行多态性分析,对不同染色体倍性,不同来源的马铃薯进行分类研究[10]。
相较于其他分子标记技术,SSR分子标记多态性好,简便易用,重复性好,更适合于植物品种鉴定和遗传多样性研究。本文旨在利用SSR分子标记研究彩色马铃薯品种间的遗传关系,分析彩色马铃薯的遗传背景及其亲缘关系,以便更好的为彩色马铃薯遗传育种服务。
1 材料与方法
1.1 材料
试验采用来自北美、欧洲和国际马铃薯中心不同颜色马铃薯品种及彩色马铃薯育种中间材料进行研究。表1列出了试验材料的品种名称、来源和品种的皮色、肉色等主要特征特性。
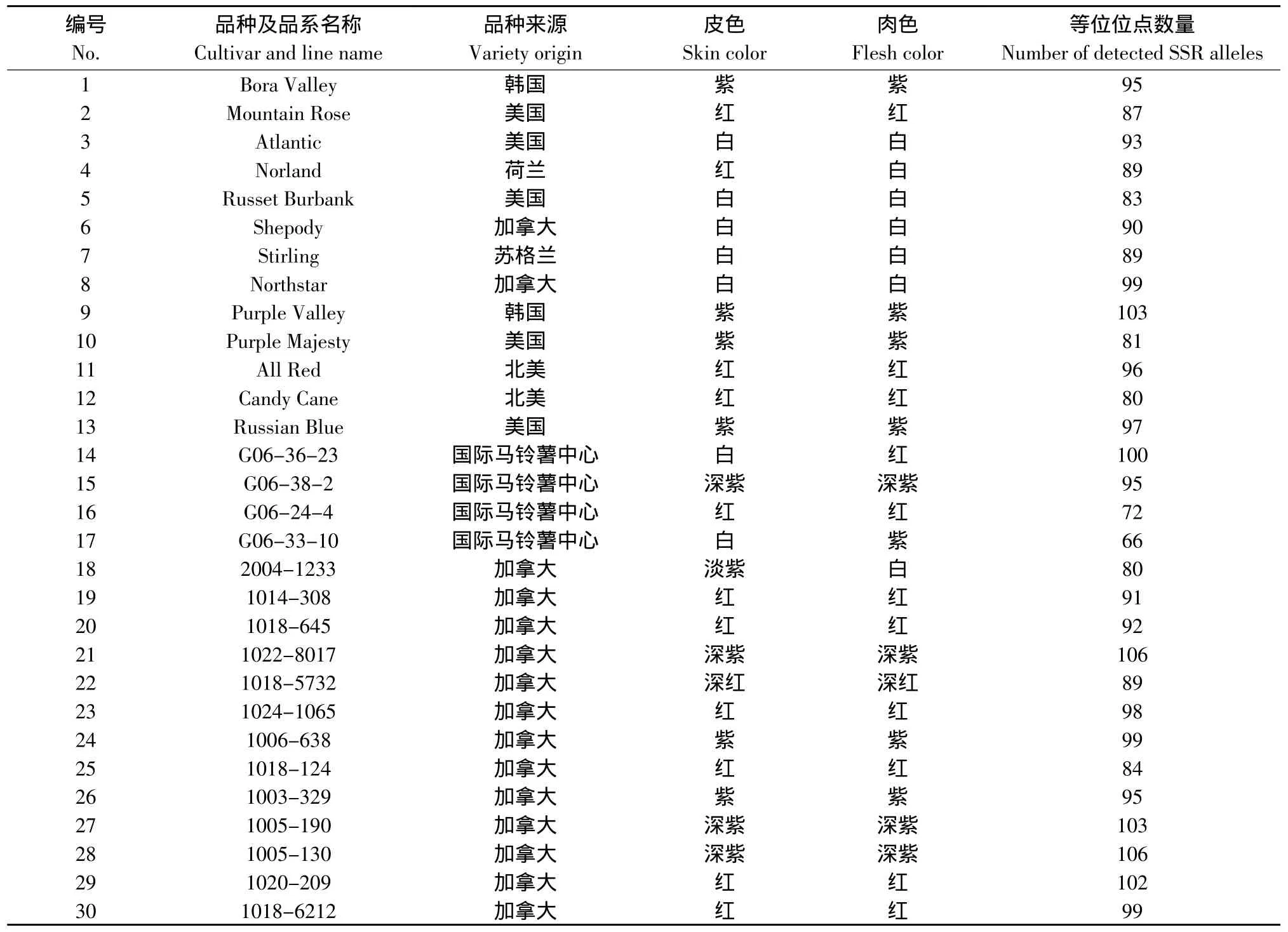
表1 用于SSR分析的彩色马铃薯品种Table 1 Color potato cultivars for SSR marker analysis
1.2 方法
1.2.1 DNA提取及SSR分析
DNA提取使用植物DNA提取试剂盒(D Neasy Plant Mini Kit,Qiagen,Maryland,USA),用0.8%琼脂糖电泳检测DNA质量及浓度。根据文献报道[9-12],选择多态性好的SSR引物进行彩色马铃薯多态性研究,SSR引物信息如表2所示。
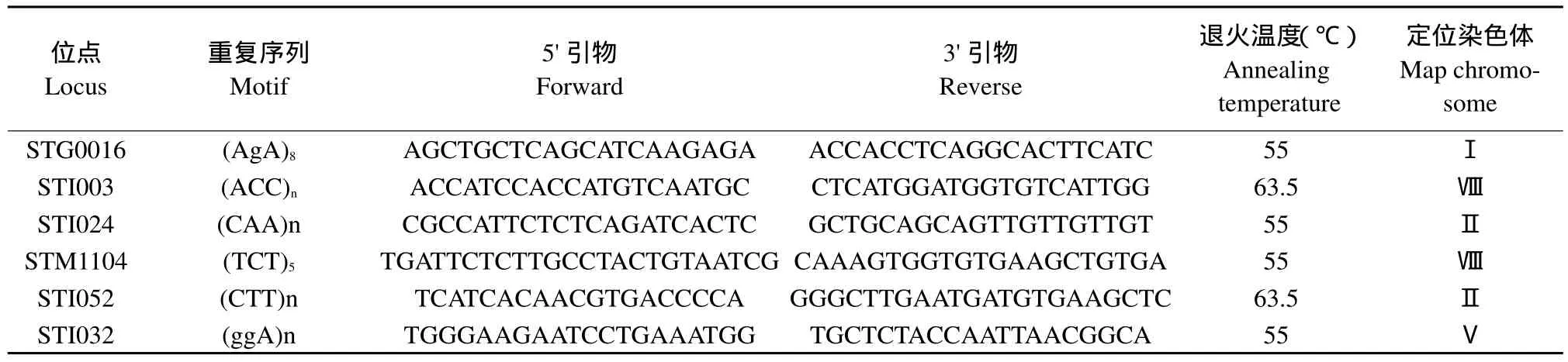
表2 用于彩色马铃薯品种遗传多样性分析的SSR引物信息Table 2 SSR primer for genetic diversity analysis of color potato cultivars
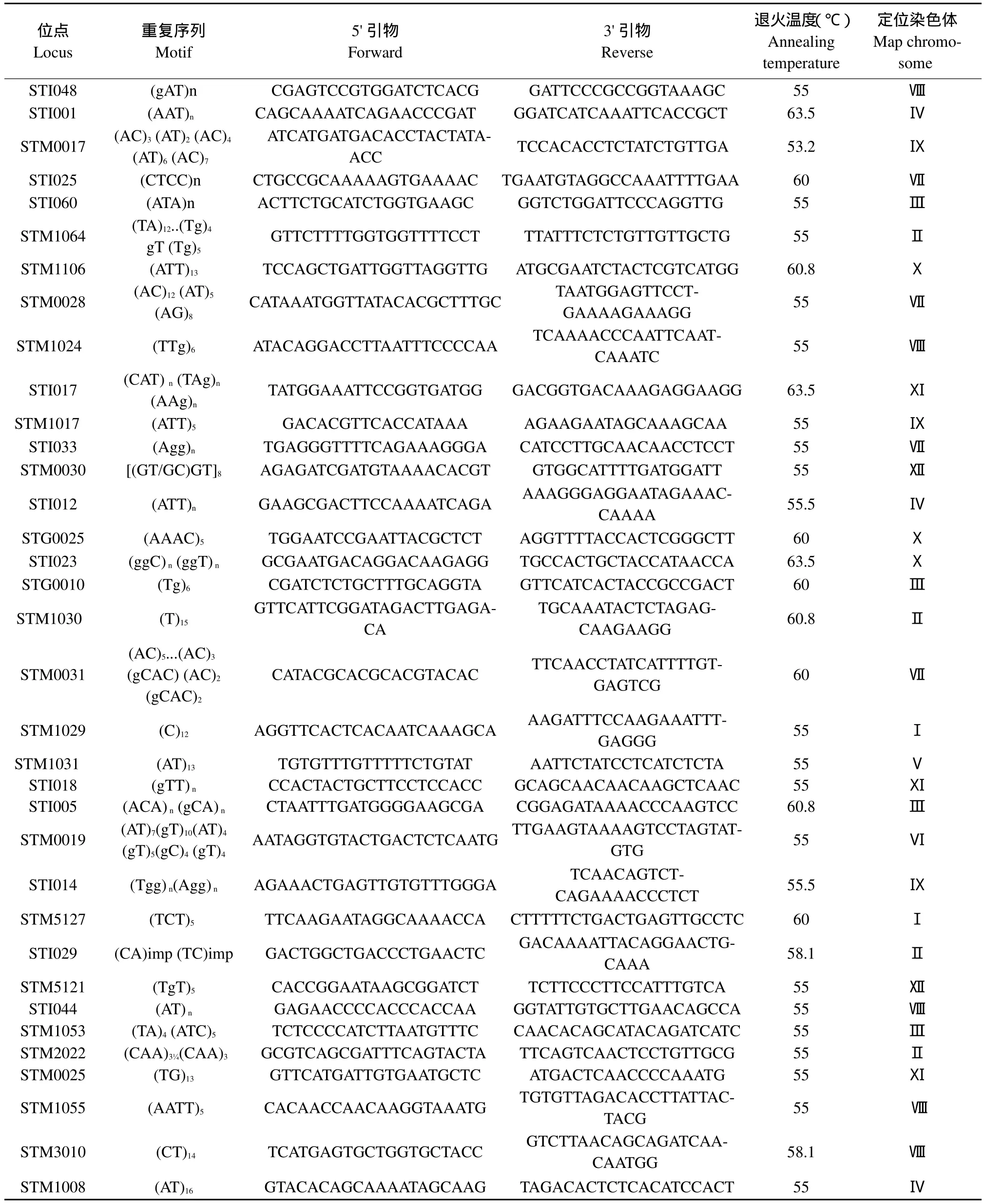
续表
PCR反应使用PCR反应试剂盒(Taq PCR Master Mix Kit,Qiagen),反应体系15 μL,反应程序为:94℃预变性3 min;然后进行35个PCR循环:94℃变性30 s,退火温度(引物退火温度见表2)退火30 s,72℃延伸50 s;最后72℃延伸7 min。扩增反应在PCR扩增仪(Eppendorf mastercycler)上进行。PCR产物用8%非变性聚丙烯酰胺凝胶电泳,200 V电泳1~1.5 h。电泳后用1%硝酸银进行银染,银染好的凝胶用数码相机在胶片观察灯下进行拍照。凝胶电泳和银染方法参照国际马铃薯中心的实验程序。
1.2.2 数据分析
根据SSR位点上银染带型的有无,转换为二进制数据,有条带的赋值为“1”,无条带的赋值为“0”。二进制数据组成矩阵,利用简单匹配系数(Simple matching coefficient,SM)计算相似性系数,然后进行UPGMA聚类分析,自动生成树状图。NTSYS-PC 2.1软件用于计算遗传相似性和聚类分析。
多态性信息量值PIC(Polymorphism index contents)采用Nei's多样性指数公式获得:PICk=1-∑(Pi)2,其中Pi是带有第i个等位基因在k位点上的群体比例,计算每个微卫星位点的PIC值。
2 结果与分析
研究使用Qiagen公司的DNA提取试剂盒提取DNA。结果表明试剂盒提取的DNA质量好,无降解,品种间DNA提取量均匀(见图1),经稀释后可用于SSR分析。
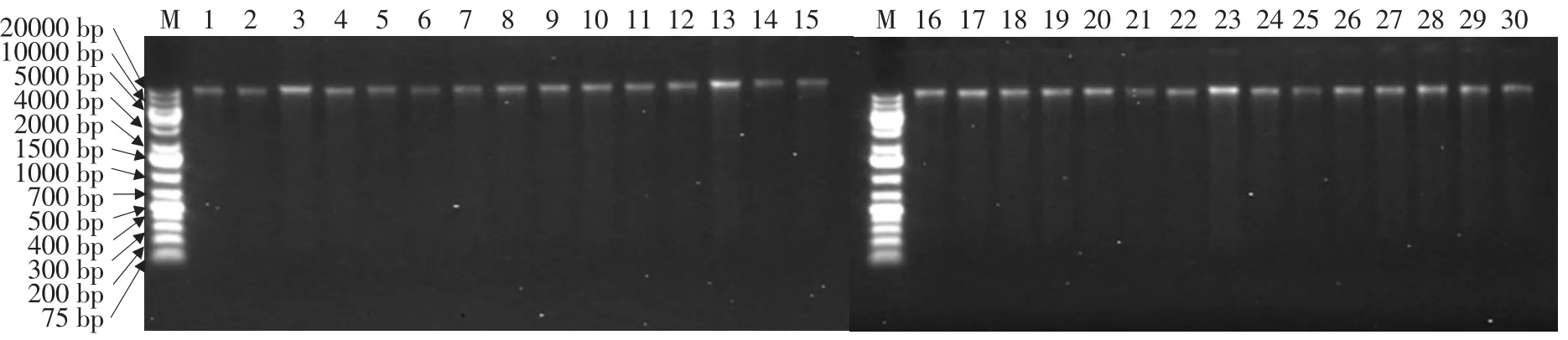
图1 马铃薯DNA琼脂糖凝胶电泳Fig.1 Agrose electrophoresis of potato DNA
2.1 SSR引物多态性分析
表3显示了SSR引物对彩色马铃薯进行分析的多态性信息。41对SSR引物在试验中共获得152个SSR扩增条带,其中有24条带为所有品种共有,在品种间不具有多态性;另外128条带在品种间存在差异,显示多态性。SSR引物在各品种间显示1~11个多态性条带,PIC值变幅为0.32~0.94,平均值0.76。其中PIC值达到和高于0.9的有4个:引物STG0016在PCR扩增中获得11个条带,其中10个显示为多态性条带,PIC值为0.94;引物STI003的9个位点均为多态性条带,PIC值为0.93;引物STI024的9个位点中8个显示为多态性条带,PIC值为0.93;引物STM1104的6个均为多态性条带,PIC值为0.9。以上4对引物在品种间显示了良好的多态性,适合用于马铃薯品种间的多态性分析;PIC在0.80~0.89之间的有15对引物,亦表现出较好的多态性;PIC值在0.70~0.79的有12对引物;PIC值在0.60~0.69之间的有4对引物;PIC值在0.50~0.59之间的有5对引物;PIC值低于0.5的有1对引物。图2为引物STI024扩增PCR产物的聚丙烯酰胺凝胶电泳结果。
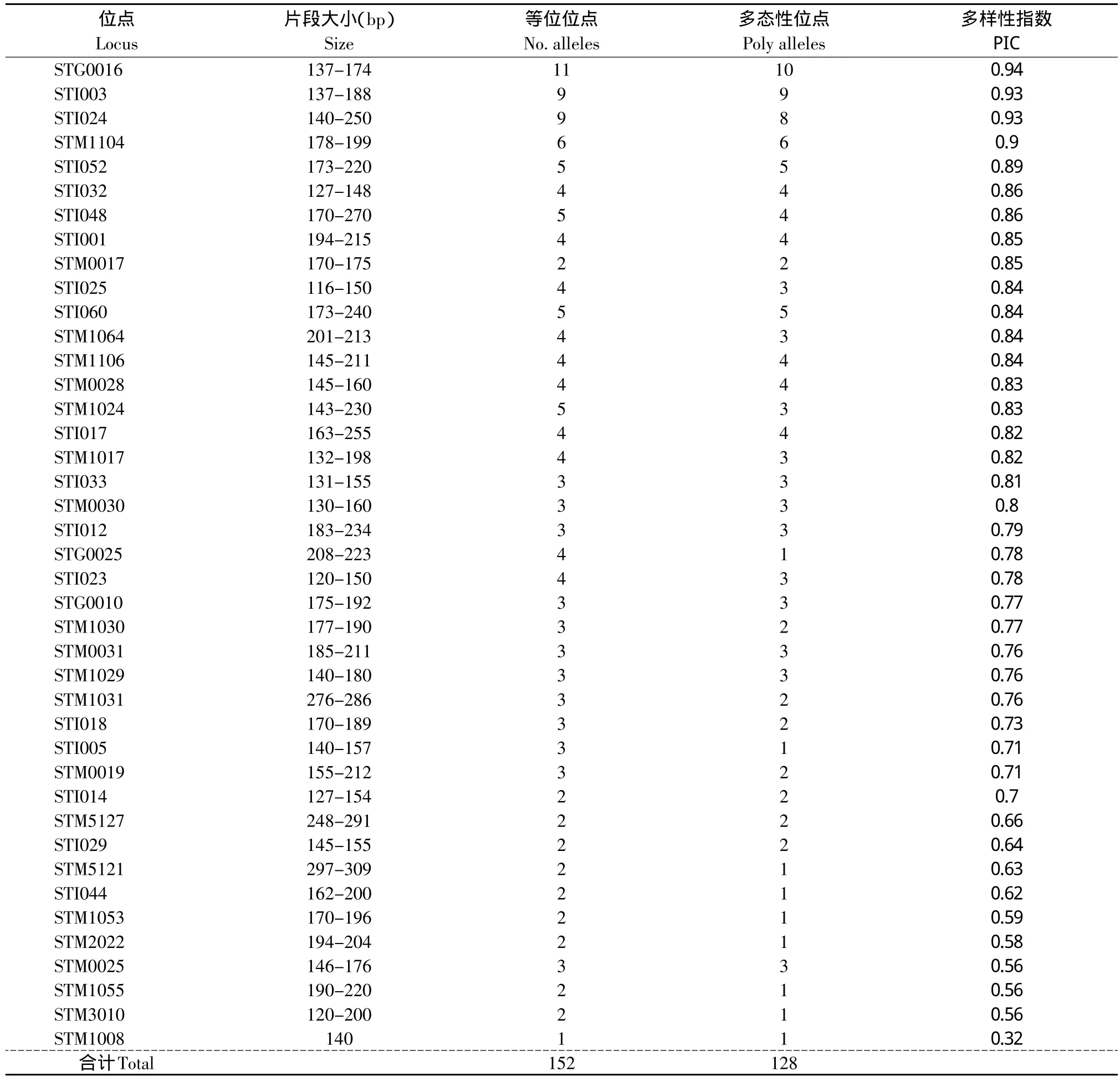
表3 SSR引物分析30个彩色马铃薯品种的多态性信息Table 3 Polymorphisms revealed by SSR primer in 30 color potato cultivars
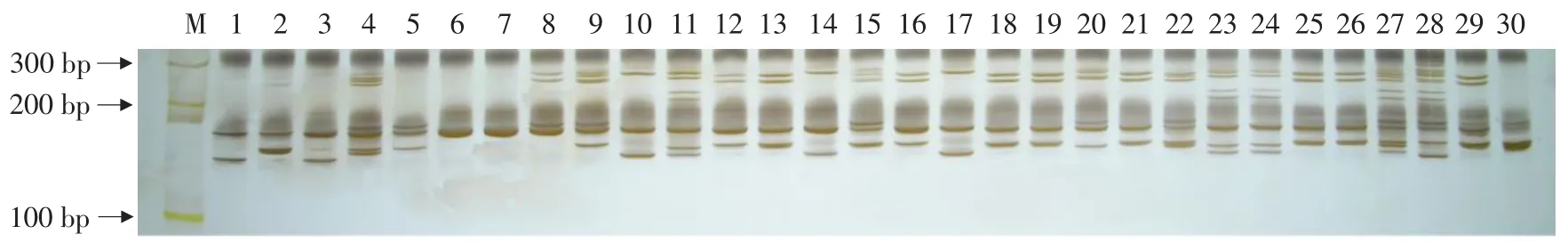
图2 引物STI024对30个彩色马铃薯品种PCR扩增的电泳结果Fig.2 Result of electrophoresis of PCR products using STI024 for 30 color potato varieties
通过聚类分析发现,PIC值达到0.9的4对引物扩增出的35条带能把参试30个品种全部区分开来,说明多态性好的SSR引物适用于大部分马铃薯品种的多态性研究。用PIC值达到0.8的19对引物对参试品种进行聚类分析,不仅能把所有30个品种全部区别开,并且19对引物的聚类结果和所有41对SSR引物进行聚类分析的结果高度相似,说明筛选多态性好的SSR引物能更高效地对马铃薯品种进行遗传多态性研究。
2.2 SSR引物检测的特异性位点分析
在SSR扩增结果中,我们检测到一些品种和组合特异性的条带(见表4)。3个特异性条带STI060-170、STG0010-190和STM0025-150能单一识别品种G06-33-10;条带STI017-170能检测品种Atlantic;STI023-120能识别品种Shepody;2个特异性条带STM0028-150和STM0031-180能检测来源于CIP的二倍体彩色马铃薯资源G06-24-4和G06-33-10;特异性条带STM1106-145能专一检测来源于CIP的四倍体彩色马铃薯资源G06-36-23和G06-38-2;2个特异性条带STM1024-220和STM2024-230能从参试品种中检测出品种1024-1065和1003-329;2个特异性条带STI048-270和STM1029-140能检测品种2004-1233和Purple Majesty;条带STM-
1017-180能检测品种Purple Valley和1022-8017;STM0028-160能专一检测来源于CIP的4个彩色马铃薯种质G06-36-23、G06-38-2、G06-24-4和G06-33-10;STM1055-190检测的4个马铃薯品种Norland、Russet Burbank、Shepody和 Dermot Lynch均为白肉品种,该条带可能与马铃薯白色薯肉相关。

表4 SSR分子标记检测到的彩色马铃薯品种特异性位点Table 4 Accession and group specific SSR alleles detected in color potato cultivars
2.3 彩色马铃薯品种聚类分析
表3显示SSR引物对30个彩色马铃薯品种进行分析的结果,在各个品种中检测到66~106个等位位点,平均每个品种检测到92个等位位点。根据检测的多态性位点,使用UPGMA方法进行聚类分析,分析结果见图3。参试30个品种在SM=0.65处分为两个主要聚类群,类群Ⅰ共有23个品种,包括各种颜色马铃薯品种,所有品种均为马铃薯普通栽培种(S.tuberosum),品种间遗传相似度较高。类群Ⅰ在SM=0.72处又可以分为5个亚群:亚群Ⅰ.1中除品种All Red为红色马铃薯外,其他均为紫皮紫肉马铃薯品种,可视为紫色马铃薯品种亚群。亚群Ⅰ.2和Ⅰ.3主要为红色马铃薯品种,9个品种中只有Atlantic和Shepody是白皮白肉,其他均为红皮红肉,可视为红色马铃薯亚群;亚群Ⅰ.4和Ⅰ.5共7个品种,其中Norland为红皮白肉,Northstar、Russet Burbank和Stirling均为白皮白肉,而另外3个彩色马铃薯则均为白皮白肉品种杂交后代,其中1003-329为Northstar后代,1014-308和1006-638亲本之一为Stirling,因此类群Ⅰ.4和Ⅰ.5可归为白色马铃薯亚群。
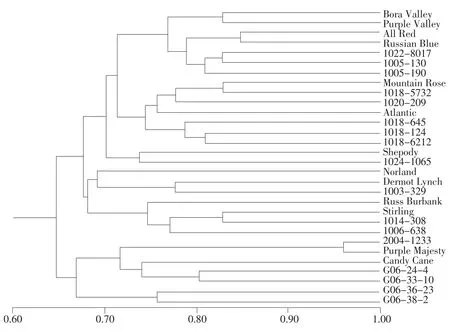
图3 30个彩色马铃薯品种的SSR谱带聚类分析结果Fig.3 Dendrogram of cluster analyses of 30 color potato cultivars by SSR screen
类群Ⅱ共有7个品种,包括参试品种中其他马铃薯种质材料,在SM=0.66处分为2个亚群,亚群Ⅱ.1中2004-1233为二倍体野生种S.pinnatisectum和普通栽培种体细胞杂种,G06-24-4和G06-33-10是来自国际马铃薯中心的二倍体原始栽培种S.stenotomum的杂交后代。该亚群包括参试品种中所有已知二倍体血缘的试验材料。亚群Ⅱ.2是来自国际马铃薯中心的S.andigena亚种和普通栽培种的杂交后代。
3 讨 论
各种不同的分子标记应用于马铃薯遗传多样性、系统分类以及指纹图谱建等研究。Grg等用RFLP分子标记鉴定德国马铃薯品种[15];Ghislain等用RAPD分子标记分析马铃薯原始栽培种S.phureja的种间变异情况[16];Kim等使用AFLP分子标记对马铃薯品种进行识别[17];Bornet等用ISSR分子标记比较来源于欧洲和阿根廷马铃薯品种的异同[18]。相较于上述各种分子标记,由于SSR分子标记具有多态性好、重复性好和方便利用的优点。本研究使用SSR分子标记对彩色马铃薯进行遗传多样性研究Milbourne等用3种基于PCR技术的分子标记评价16个马铃薯栽培品种多样性[19],发现SSR分子标记在分析马铃薯品种间遗传距离时效率更高,并在此基础上开发了112对SSR引物用于马铃薯研究。王绍鹏等对SSR分子标记扩增条件进行优化,并把SSR多重PCR反应体系应用到马铃薯分子标记研究中[20-21]。Ghislain等总结的“马铃薯遗传鉴定试剂盒”(Potato genetic identity kit)共包括24对SSR引物,在马铃薯12条染色体的每条染色体上分布有2对SSR引物,其对742个马铃薯品种识别效率达93.5%[14]。
为更好研究彩色马铃薯遗传多样性,在以上24对SSR引物基础上,还收集了文献报道中多态性、重复性好的SSR引物用于本研究彩色马铃薯多态性分析。从聚类分析结果看,马铃薯品种聚类分成2个类群,类群Ⅰ全部为普通栽培种,包括大多数彩色马铃薯品种和北美栽培面积较大的白色薯肉品种。这些品种根据颜色不同分成3个亚群:紫色品种亚群、红色品种亚群和白色品种亚群。SSR引物来自遍布马铃薯12条染色体的遗传位点,研究根据遗传相似度聚类,把彩色马铃薯不同颜色品种大致归类,说明马铃薯颜色为多基因控制,色素相关基因位于多条染色体上。同时由于参试彩色马铃薯品种多来自于北美,遗传背景相似,亲缘关系较近,因此品种间色素上的差异能被SSR聚类区分开。
类群Ⅱ除了2个北美现有的彩色马铃薯品种外,包括了参试品种中其他种质来源的马铃薯材料,其中3个来自二倍体种:1个有野生种S.pinnatisectum血缘,2个是原始栽培种S.stenotomum后代。类群Ⅱ的另外2个品种为普通栽培种安第斯栽培亚种(S.andigena)后代,马铃薯四倍体种的彩色马铃薯性状主要来种于该亚种,但经多年的农艺性状改良和定向选择,使得现代栽培的彩色马铃薯品种与安第斯栽培亚种之间的遗传关系较远(见图3)。类群Ⅱ包括二倍体和四倍体的彩色马铃薯种质,这些种质代表马铃薯品种中颜色性状的原始来源,在色素表现上和北美彩色马铃薯品种相似,但在其他性状如植株、叶片形状、块茎薯形、芽眼深浅等植物学特征上与其他彩色马铃薯品种间差异很大。SSR聚类从进化关系上把彩色马铃薯种质划分成两类,一类为现代的彩色马铃薯栽培品种,在农艺性状,适应性和产量等方面经过改良驯化,适宜现代的马铃薯生产加工。另一类则代表了彩色马铃薯种质的来源,是彩色马铃薯未经改良前的种质资源,这些资源具有更丰富的彩色色素基因,是马铃薯品种选育的宝贵种质资源。从聚类关系图看出,类群Ⅰ中的彩色马铃薯品种间亲缘关系近,相似度高,遗传背景相似,彼此间不宜再用作杂交育种的亲本配对。而类群Ⅱ不仅与类群Ⅰ的彩色马铃薯关系较远,类群内的种质间来源也不相同,彩色马铃薯育种中利用类群Ⅰ和类群Ⅱ彼此进行杂交可以拓展彩色马铃薯遗传背景,提高彩色马铃薯新品种选育效率。
[1] Brown C,Wrolstad R,Durst R,et al.Breeding studies in potatoes containing high concentrations of anthocyanins[J].American Journal of Potato Research,2003,80(4):241-249.
[2] Reyes L F,Cisneros-Zevallos L.Degradation kinetics and colour of anthocyanins in aqueous extracts of purple-and red-flesh potatoes(Solanum tuberosum L.)[J].Food Chemistry,2007,100(3):885-894.
[3] Reyes L,J Miller,Cisneros-Zevallos L.Antioxidant capacity,anthocyanins and total phenolics in purple-and red-fleshed potato genotypes[J].American Journal of Potato Research,2005,82(4):271-277.
[4] Stushnoff C,Holm D,Thompson M D,et al.Antioxidant properties of cultivars and selections from the colorado potato breeding program[J].American Journal of Potato Research,2008,85(4):267-276.
[5] Veilleux R E,Shen L Y,Paz M M.Analysis of the genetic composition of anther-derived potato by randomly amplified polymorphic DNA and simple sequence repeats[J].Genome,1995,38(6):1153-1162.
[6] Provan J,Powell W,Waugh R.Microsatellite analysis of relationships within cultivated potato[J].Theoretical and Applied Genetics,1996,92(8):1078-1084.
[7] Rocha E A,Paiva L V,Carvalho H H,et al.Molecular characterization and genetic diversity of potato cultivars using SSR and RAPD markers[J].Crop Breeding and Applied Biotechnology,2010(10):204-210.
[8] de Galarreta J,Barandalla L,Rios D J,et al.Genetic relationships among local potato cultivars from Spain using SSR markers[J].Genetic Resources and Crop Evolution,2011,58(3):383-395.
[9] Ghislain M,Spooner D M,Rodriguez F,et al.Selection of highly informative and user-friendly microsatellites(SSRs)for genotyping of cultivated potato[J].Theoretical and Applied Genetics,2004,108(5):881-890.
[10] Spooner D M,Nunez J,Trujillo G,et al.Extensive simple sequence repeat genotyping of potato landraces supports a major reevaluation of their gene pool structure and classification[J].Proceedings of the National Academy of Sciences,2007,104(49):19398-19403.
[11] Milbourne D,Meyer R C,Collins A J,et al.Isolation,characterisation and mapping of simple sequence repeat loci in potato[J].Molecular and General Genetics MGG,1998,259(3):233-245.
[12] Ashkenazi V A,Chani E,Lavi U,et al.Development of microsatellite markers in potato and their use in phylogenetic and fingerprinting analyses[J].Genome,2001,44:50-62.
[13] Feingold S,Lloyd J,Norero N,et al.Mapping and characterization of new EST-derived microsatellites for potato(Solanum tuberosum L.)[J].Theoretical and Applied Genetics,2005,111(3):456-466.
[14] Ghislain M,Nunez J,Herrera M,et al.Robust and highly informative microsatellite-based genetic identity kit for potato[J].Molecular Breeding,2009,23(3):377-388.
[15] Görg R,Dchachtschabel U,Ritter E,et al.Discrimination among 136 tetraploid potato varieties by fingerprints using highly polymorphic DNA markers[J].Crop Sci,1992,32(3):815-819.
[16] Ghislain M,Zhang D,Fajardo D,et al.Marker-assisted sampling of the cultivated Andean potato Solanum phureja collection using RAPD markers[J].Genetic Resources and Crop Evolution,1999,46(6):547-555.
[17] Kim J,Joung H,Kim H,et al.Estimation of genetic variation and relationship in potato(Solanum tuberosum L.)cultivars using AFLP markers[J].American Journal of Potato Research,1998,75(2):107-112.
[18] Bornet B,Goraguer F,Joly G,et al.Genetic diversity in european and Argentinian cultivated potatoes(Solanum tuberosum subsp.tuberosum)detected by inter-simple sequence repeats(ISSRs)[J].Genome,2002,45:481-484.
[19] Milbourne D,Meyer R,Bradshaw J,et al.Comparison of PCR-based marker systems for the analysis of genetic relationships in cultivated potato[J].Molecular Breeding,1997,3(2):127-136.
[20] 王绍鹏,邱彩玲,李勇,等.马铃薯DNA提取及SSR标记分析[J].东北农业大学学报,2009,39(5):7-12.
[21] 王绍鹏,刘尚武,李勇,等.马铃薯SSR标记多重PCR反应体系优化研究[J].东北农业大学学报,2010,41(10):17-23.
