水稻叶绿素含量的动态QTL剖析
2012-03-12姜树坤张喜娟王嘉宇徐正进陈温福张凤鸣
姜树坤,张喜娟,王嘉宇,徐正进,陈温福,张凤鸣*
(1.黑龙江省农业科学院耕作栽培研究所,哈尔滨 150086;2.沈阳农业大学水稻研究所,沈阳 110161)
水稻(Oryza sativa L.)生物产量95%来自于叶片光合作用,而叶绿素是其光合作用关键。对于“增加光合速率是否能增加最终产量”这一问题仍有争议,但最近的研究表明高产品种往往具有较高的光合速率和较高的叶绿素含量[1]。对衣藻和拟南芥等模式生物研究已阐明叶绿素生物合成和降解的基本过程[2-3]。虽然对叶绿素合成和降解途径的研究有一定进展,但关于该过程在水稻整个发育过程中的分子调节机制仍不了解。随着数量遗传学理论和相关分析软件的不断发展和完善,利用分子标记进行QTL定位分析在水稻重要农艺性状的遗传基础研究中发挥重要作用[4-7]。研究表明,叶绿素的合成与降解在水稻整个生育期是一个动态过程[8],生育前期叶绿素含量逐渐增加,生育后期叶绿素含量降低,叶绿素含量降低往往暗示叶片衰老、营养缺乏或遭遇逆境。因此,叶绿素含量的动态变化作为稻作研究和生产实践的重要参考指标,明确叶绿素含量在不同时期变化的遗传基础,将有利于合理采取对应措施,充分发挥品种高产潜力。
本研究通过对沈农265/丽江新团黑谷的RILs群体在水稻分蘖盛期、抽穗期和成熟期的叶绿素含量变化进行QTL分析,旨在剖析水稻叶绿素不同时期的表达规律,为超高产水稻育种和后期功能型水稻品种选育及改良提供理论依据。
1 材料与方法
1.1 材料
以叶绿素含量较高的北方超级粳型常规稻品种沈农265(SN265)为母本,以叶绿素含量较低的云南地方粳稻品种丽江新团黑谷(LTH)为父本进行杂交,经单粒传7代衍生构建粳/粳交重组自交系群体(命名为SL-RILs)。该群体由126个株系组成,遗传稳定。其对应的连锁图谱包括121个标记,包含119个SSR标记和2个形态学标记(紫色稃尖C和直立穗型EP)。该图谱覆盖水稻12条染色体,总长度为1397.50 cM,标记间平均距离为11.55 cM[9]。
1.2 田间试验及叶绿素测定
试验于2009年在沈阳农业大学水稻所试验田进行,4月12日育苗,5月18日移栽,126个RILs家系采用2次重复的随机区组设计,每小区4行,每行10株,栽植的行株距为30 cm×13.3 cm,其他管理同生产田。由于沈农265(102 d)和丽江新团黑谷(105 d)的抽穗期仅差3 d,且RIL群体的抽穗期变异范围小于10 d[10],因此所有株系可以统一调查。分别于分蘖期(6月25日)、抽穗期(7月28日)和成熟期(9月21日)用叶绿素仪(SPAD-502.Monito,Japan)测定亲本及各家系最上端叶片的叶绿素含量。取叶片中部重复测定3次,每个家系测定20片叶,取平均值用于换算该家系的叶绿素含量。叶绿素仪测定的SPAD值与叶绿素含量之间换算的公式为Y=0.1285X-0.5656,式中,X为叶绿素仪的测定值(SPAD值),Y为叶绿素含量(mg·dm-2)[11]。
1.3 动态QTL分析
取每个调查时刻各株系叶绿素含量的平均值,即为t时刻(y(t))的表型值,根据朱军提出的条件遗传效应值的统计分析方法[12],采用QGA Station 1.0软件进行数据处理,可以获得给定的t-1时刻表型值的 y(t)时刻条件表型值 y(t|t-1)。非条件QTL的加性效应反映发育初始时刻至t时刻基因表达的累积效应,条件QTL的加性效应则为t-1时刻到t时刻基因表达的净加性效应。第1次测定得到的非条件QTL,即为初始时刻至第1次测定时期的条件QTL。
采用WinQTL Cartographer 2.5的CIM方法进行QTL定位[13],步移速度设置为1 cM,模型为6,控制标记数为5,用向前回归方法,被检区间选择每侧10 cM的控制窗口。采用排列组合1000次的方法确定LOD阈值(α=0.05),当实际求得的LOD值大于LOD阈值时,就认为该区段存在1个QTL,其置信区间为LOD峰值向下1个LOD值单位的区间。
2 结果与分析
2.1 3个生育时期叶绿素含量表现
沈农265的叶绿素含量在3个不同的生育时期(分蘖期、抽穗期和成熟期)均极显著大于丽江新团黑谷(见表1)。3个性状皆在SL-RILs群体中表现为连续的正态分布,且呈现明显的超亲遗传,表明群体中各个株系间基因型差异较大,适于进行QTL分析。
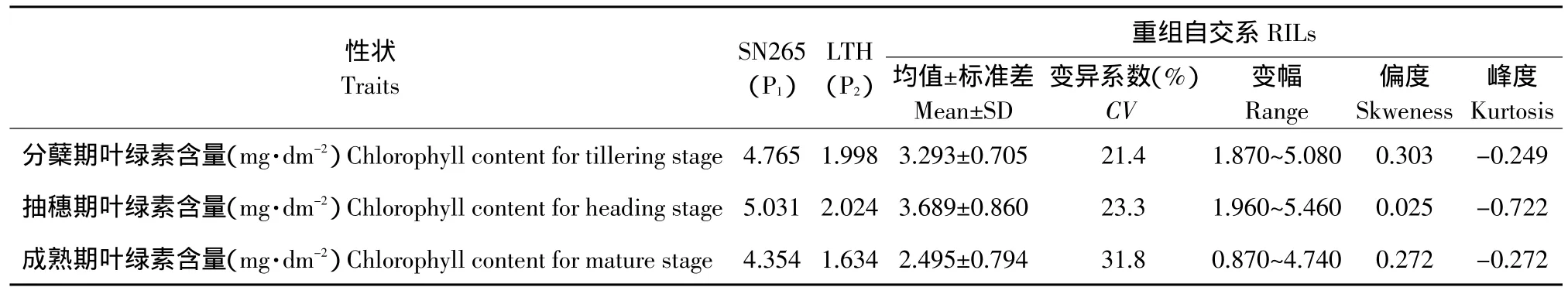
表1 亲本和RILs群体在3个不同时期的叶绿素含量Table 1 Chlorophyll contents of the parents and the RIL population at three different stages
2.2 3个生育时期叶绿素含量的QTL定位
共检测到控制水稻分蘖期、抽穗期和成熟期叶绿素含量的22个QTL,分布在除第5染色体以外的11条染色体上,其中与分蘖期叶绿素含量相关的5个;与抽穗期叶绿素含量相关的7个;与成熟期叶绿素含量相关的10个(见表2,图1)。在3个时期同时检测到的1个,在2个时期同时检测到的3个。控制分蘖期叶绿素含量的5个QTL分布于第3、6、9和10号染色体上,增效等位基因均来自SN265,其中表型贡献率大于20%的为qCT3a和qCT9。控制抽穗期叶绿素含量的7个QTL分布于第1、2、3、4、7、8和9号染色体上,其中qCT2、qCH3、qCH7和qCH9的增效等位基因来自SN265;qCH1、qCH4和qCH8的增效等位基因来自LTH,表型贡献率大于20%的仅有qCH9。控制成熟期叶绿素含量的10个QTL分布于第2、3、4、7、9、10、11和12号染色体上,其中 qCM4a、qCM7a、qCM7b、qCM9、qCM11a和qCM12的增效等位基因来自SN265;qCM2、qCM3、qCM4b、和qCM11b的增效等位基因来自LTH,表型贡献率大于20%的仅有qCM2,其贡献率达21.8%。
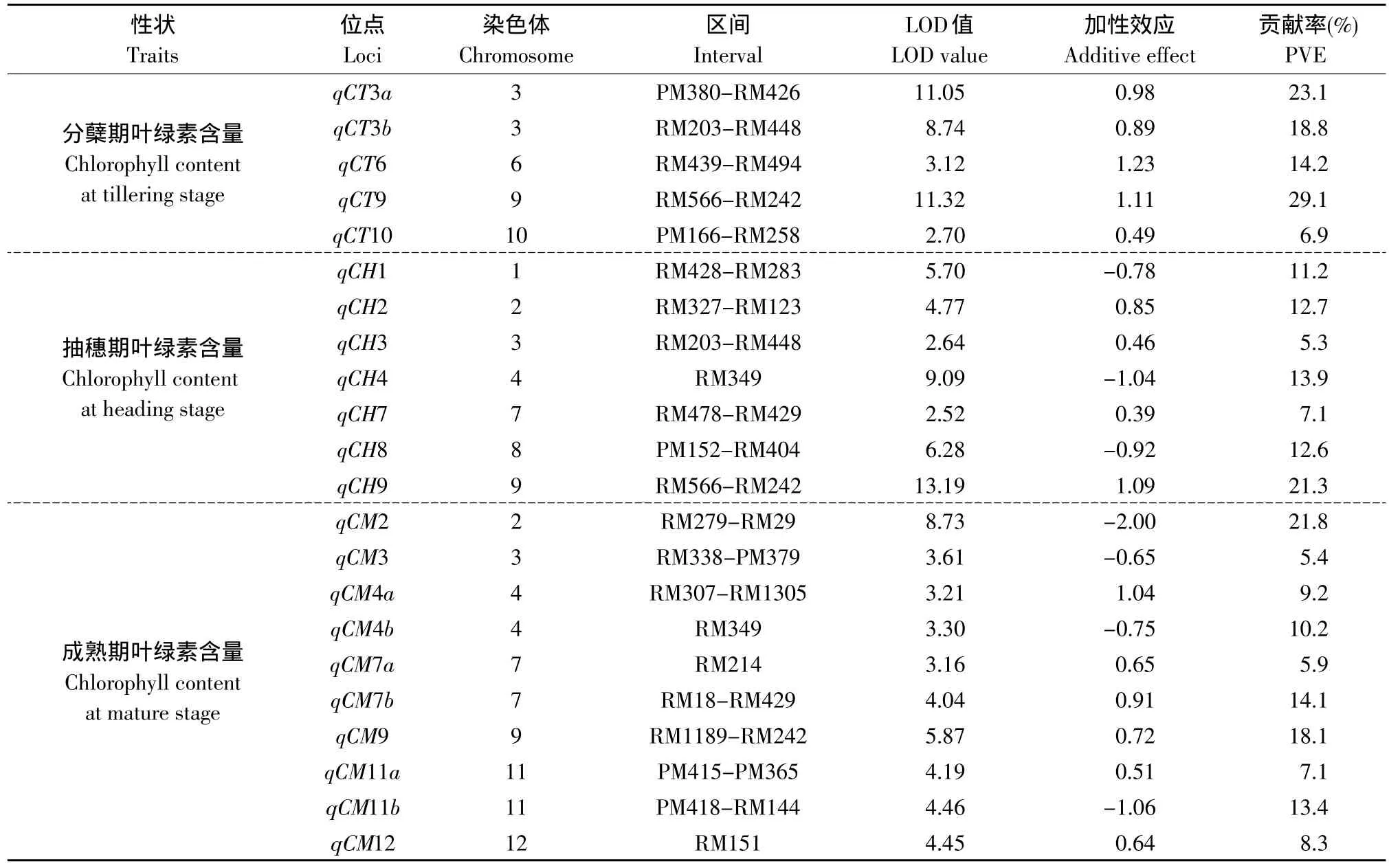
表2 3个不同生育时期叶绿素含量的QTL定位Table 2 QTL location of chlorophyll content at three different growth stages

图1 控制3个生育时期叶绿素含量的QTL在染色体上的位置Fig.1 Chromosome location of putative QTL for chlorophyll content at three stages
2.3 3个生育时期叶绿素含量的动态QTL定位
非条件QTL的加性效应可反映发育初始时刻至t时刻基因表达的累积效应,条件QTL加性效应则为t-1时刻到t时刻基因表达的净加性效应。对应本研究就是非条件QTL反应的是从生育起始至3个不同时期的累积效应,而条件QTL反应的是从分蘖至抽穗和从抽穗至成熟这两个时间段的净效应。在这两个阶段共检测到14个QTL,其中有控制分蘖期至抽穗期叶绿素含量的位点7个,分别位于第4、7、8、9和11号染色体上。控制抽穗期至成熟期叶绿素含量的位点也有7个,位于第1、2、3、4、8、10和12号染色体上,未发现在两个阶段同时表达的位点,反映了控制叶绿素含量机制的复杂性,这些位点的具体信息见表3。
这些条件QTL为非条件QTL提供确切的解释。将其分为3类,第一类,非条件QTL与条件QTL检测结果完全一致。如第2染色体上检测到控制抽穗期至成熟期叶绿素含量的位点qCh-m2,该位置我们曾检测到控制成熟期叶绿素含量的非条件QTL-qCM2,以上信息表明该位点是在水稻抽穗以后才表达的;第二类,条件QTL只在某一时期表达,而非条件QTL却能在多个时期重复出现。如第4染色体上检测到的控制分蘖期至抽穗期叶绿素含量的位点qCt-h4,该位置曾检测到控制抽穗期叶绿素含量的非条件QTL-qCT4和控制成熟期叶绿素含量的非条件QTL-qCM4。qCt-h4的信息暗示其在分蘖期以后表达直至抽穗期结束,而在成熟期还能检测到该位点是由于叶绿素在分蘖期至抽穗期的表达累积所致;第三类,条件QTL能检测到,而非条件QTL检测不到。如第1染色体和第8染色体上控制抽穗期至成熟期叶绿素含量的位点qCh-m1和qCh-m8,这两个位点均是在抽穗期以后表达,但由于前期叶绿素积累较多,使得先前在检测成熟期叶绿素含量QTL位点时却没有检测到。

表3 三个不同生育时期叶绿素含量的非条件QTL的位置及效应Table 3 Location and effects of unconditional QTL controlling chlorophyll content at three different growth stages
3 讨论
“源-库-流”的协调是水稻获得高产的关键,只有“源”足、“库”大,同时“流”畅才能获得较高的产量。目前人们的研究重点集中在对“库”的研究,大量的“库”相关性状基因被克隆,如控制单株产量的qGY2-1[14],控制每穗粒数的 Gn1a[5],Ghd7[15],DEP1[16]和 IPA1[17], 控 制 籽 粒 大 小 的 GW2[6]、GS3[7]和 qSW5[18],以及控制灌浆的GIF1[19]等等,而对于“源”和“流”的研究相对较少。主要是因为“源”和“流”的性状难以直接测定,同时遗传机制复杂且易受环境因素影响。本研究将研究重点放在重要的“源”性状—叶片的叶绿素含量上,期望研究结果能够为水稻高产育种提供理论支持。
在水稻整个生育期,叶绿素的合成与降解是一个动态过程[8]。为探讨水稻叶片叶绿素含量变化规律和遗传规律,本研究小组通过对SL-RILs群体在分蘖期、抽穗期和成熟期的叶绿素含量进行动态QTL分析,共检测到22个条件QTL和14个非条件QTL。一般而言,非条件QTL的加性效应可反映发育初始时刻至t时刻基因表达的累积效应,条件QTL加性效应则为t-1时刻到t时刻基因表达的净加性效应。比对发现,非条件QTL给条件QTL提供较好解释,尤其是部分非条件QTL只在特定的时期表达,而条件QTL却能在多个时期重复出现,由此亦反映出水稻叶绿素含量遗传的复杂性。此外,与其他研究小组结果相比[20-24],定位在第1染色体RM428-RM580区段、第3染色体RM426-RM514区段、第4染色体RM470-RM559区段、第8染色体RM408-RM25区段和第9染色体RM566-RM242区段的位点在不同群体中的重演性很好,有一定应用价值。其中,第3染色体qCT3a、qCH3、qCM3以及第9染色体qCT9、qCH9b和qCH9等区域是提高叶绿素含量的重要功能区。刘化龙等研究表明,水稻生育后期的叶绿素含量对最终产量影响很大,可以作为高光效育种和超高产育种的关键指标[25]。本研究其中检测到的控制抽穗期到成熟期叶绿素含量的QTL可以作为分子辅助育种的重要“元件”,对这些区域开发稳定并易于检测的分子标记,可用于品种的分子改良。
4 结论
以沈农265和丽江新团黑谷的粳-粳交重组自交系为材料,对水稻分蘖期、抽穗期和成熟期的叶绿素含量进行动态QTL分析。共检测22个条件QTL和14个非条件QTL,分布在第5条染色体以外的11条染色体上。控制分蘖期、抽穗期和成熟期叶绿素含量的条件QTL分别有5个、7个和10个;控制分蘖期—抽穗期和抽穗期—成熟期叶绿素含量的非条件QTL各有7个。检测到的控制生育后期叶绿素含量的QTL可以作为分子辅助育种的重要“元件”,用于品种的分子辅助改良。
[1] Sinclair T R,Purcell L C,Sneller C H.Crop transformation and the challenge to increase yield potential[J].Trends in Plant Science,2004,9(2):70-75.
[2] Beale S I.Green genes gleaned[J].Trends in Plant Science,2005,10(7):309-312.
[3] Hörtensteiner S.Chlorophyll degradation during senescence[J].Annual Review of Plant Biology,2006,57:55-77.
[4] Takahashi Y,Shomura A,Sasaki T,et al.Hd6,a rice quantitative trait locus involved in photoperiod sensitivity,encodes the alpha subunit of protein kinase CK2[J].Proceedings of the National Academy of Sciences of the United States of America,2001,98(14):7922-7927.
[5] Ashikari M,Sakakibara H,Lin S,et al.Cytokinin oxidase regulates rice grain production[J].Science(New York),2005,309(5735):741-745.
[6] Song X J,Huang W,Shi M,et al.A QTL for rice grain width and weight encodes a previously unknown ring-type E3 ubiquitin ligase[J].Nature Genetics,2007,39(5):623-630.
[7] Fan C A,Xing Y Z,Mao H L,et al.GS3,a major QTL for grain length and weight and minor QTL for grain width and thickness in rice,encodes a putative transmembrane protein[J].Theoretical and Applied Genetics,2006,112(6):1164-1171.
[8] Suzuki J Y,Bollivar D W,Bauer C E.Genetic analysis of chlorophyll biosynthesis[J].Annual Review of Genetics,1997,31:61-89.
[9] 姜树坤,张喜娟,徐正进,等.粳稻叶绿素含量的QTL与其叶绿素合成降解相关基因的比较分析[J].作物学报,2010,36(3):376-384.
[10] 黄成,姜树坤,刘梦红,等.水稻抽穗期的QTL剖析[J].华北农学报,2009,24(3):7-9.
[11] 曹树青,陆巍,翟虎渠,等.用水稻苗期叶绿素含量相对稳定期估算水稻剑叶光合功能期的方法研究[J].中国水稻科学,2001,15(4):309-313.
[12] 朱军.遗传模型分析方法[M].北京:中国农业出版社,1997.
[13] Zeng Z B.Precision mapping of quantitative trait loci[J].Genetics,1994,136(4):1457-1468.
[14] He G,Luo X,Tian F,et al.Haplotype variation in structure and expression of a gene cluster associated with a quantitative trait locus for improved yield in rice[J].Genome Research,2006,16(5):618-626.
[15] Xue W,Xing Y,Weng X,et al.Natural variation in Ghd7 is an important regulator of heading date and yield potential in rice[J].Nature Genetics,2008,40(6):761-767.
[16] Huang X,Qian Q,Liu Z,et al.Natural variation at the DEP1 locus enhances grain yield in rice[J].Nature Genetics,2009,41(4):494-497.
[17] Jiao Y,Wang Y,Xue D,et al.Regulation of Osspl14 by Osmir156 defines ideal plant architecture in rice[J].Nature Genetics,2010,42(6):541-544.
[18] Shomura A,Izawa T,Ebana K,et al.Deletion in a gene associated with grain size increased yields during rice domestication[J].Nature Genetics,2008,40(8):1023-1028.
[19] Wang E,Wang J,Zhu X,et al.Control of rice grain-filling and yield by a gene with a potential signature of domestication[J].Nature Genetics,2008,40(11):1370-1374.
[20] Ishimaru K,Yano M,Aoki N,et al.Toward the mapping of physiological and agronomic characters on a rice function map:QTL analysis and comparison between QTLs and expressed sequence tags[J].Theoretical and Applied Genetics,2001,102(6-7):793-800.
[21] Farouk A,Shishido R,Nomura K,et al.QTL-based analysis of leaf senescence in an indica/japonica hybrid in rice(Oryza sativa L.)[J].Theoretical and Applied Genetics,2005,110(7):1226-1235.
[22] 阿加拉铁,曾龙军,薛大伟.水稻灌浆期不同阶段叶绿素含量的QTL分析[J].作物学报,2008,34(1):61-66.
[23] 童汉华,梅捍卫,邢永忠,等.水稻生育后期剑叶形态和生理特性的QTL定位[J].中国水稻科学,2007,21(5):493-499.
[24] 杨权海,陆巍,胡茂龙,等.水稻叶片叶绿素和过氧化氢含量的QTL检测及上位性分析[J].遗传学报,2003,30(3):245-250.
[25] 刘化龙,田红刚,樊冬生,等.寒地粳稻生育后期剑叶光合特性变化的研究[J].东北农业大学学报,2008,39(6):17-21.
