不同用药顺序吉非替尼、多西他赛联用对非小细胞肺癌细胞的体外抑制作用
2012-03-10玄香兰周彩存安昌善
玄香兰,周彩存,安昌善
(1延边大学附属医院,吉林延吉133000;2上海市肺科医院)
为了使非小细胞肺癌(NSCLC)患者能从靶向药物和化疗中受益,目前正在寻找靶向治疗与化疗的最佳联合方案和时机。2011年,我们观察了不同顺序吉非替尼、多西他赛(DXT)联用对人肺癌细胞株PC-9、PC-9/G、A549细胞周期及凋亡的影响,旨在寻找抑制NSCLC生长的最佳联用方案
1 材料与方法
1.1 材料 人肺癌细胞株PC-9、PC-9/G、A549(上海肺科医院中心实验室);DMEM培养基、胰蛋白酶(鼎国生物);细胞凋亡试剂盒(BioVision公司);流式细胞仪分析细胞试剂盒(GenMed Scientifics公司);全自动酶标仪(芬兰)。
1.2 方法
1.2.1 细胞培养 将盛有PC-9(EGFR 19外显子突变吉非替尼敏感株)、PC-9/G(吉非替尼获得性耐药)、A549(吉非替尼原发性耐药)的液氮冻存管放入37℃水浴箱中快速融化,用PBS洗涤后移入培养瓶,加入10 mL含10%胎牛血清的DMEM培养基中,置5%CO2、37℃培养箱孵育,每周换液传代,保持其对数生长状态。吉非替尼原料用DMSO稀释成浓度50 μmol/mL的母液,避光、4℃保存,用药时DMSO终浓度小于0.1%。DXT 40 mg/mL避光、4℃保存,配制母液时以1∶3比例溶于13%乙醇中,加药后乙醇终浓度小于0.1%。
1.2.2 药物半数抑制浓度(IC50)检测 采用MTT法检测药物IC50。取100 μL含细胞数5×103个的细胞悬液,接种于96孔板;加入100 μL含不同浓度吉非替尼(浓度梯度5~50 μmol/L)或DXT(浓度梯度4~40 μg/mL)的培养液,72 h后每孔加入20 μL MTT 5 mg/mL,置细胞培养箱孵育4 h,1 200 r/min离心10 min,弃上清;每孔加DMSO 200 μL,置摇床上充分混匀1 h。最后用酶标仪测量波长530 nm时的光密度(OD)值,求出每组平均OD值,计算细胞存活率。细胞存活率=(每组平均OD值-试剂空白/对照组OD平均值-试剂空白)×100%。用细胞存活率作出量效曲线,用作图法得出两种药物对不同细胞的IC50。
1.2.3 不同用药顺序对细胞存活率的影响 取100 μL含细胞数5×103个的细胞悬液接种于96孔板。各组用药顺序:G→D组(即吉非替尼→DXT组)先加入100 μL含不同浓度的吉非替尼(PC-9、PC-9/G、A549终浓度分别为0.04、15、30 μmol/L),24 h后加入10 μL含不同浓度的DXT(PC-9、PC-9/ G、A549终浓度分别为8、18、16 μg/mL)培养液;培养72 h后加入20 μL/孔MTT 5 mg/mL,置细胞培养箱孵育4 h,1 200 r/min离心10 min,弃上清;每孔加入DMSO 200 μL,摇床上充分混匀后,用酶标仪检测波长530 nm时的OD值,求出每组平均OD值。D→G组先加DXT,后加吉非替尼,PC-9、PC-9/G、A549终浓度同G→D组。G组单用吉非替尼;D组单用DXT;同时设空白对照组。实验重复3次,计算细胞存活率。细胞存活率=(每组平均OD值-试剂空白/对照组平均OD值-试剂空白)×100%。用细胞存活率作出直方图。
1.2.4 细胞周期检测 取1×105个对数生长期细胞接种于6孔板,24 h贴壁后弃培养液,用PBS清洗2遍,加入3 mL含不同浓度的吉非替尼或DXT培养液;24 h后加100 μL含不同浓度的吉非替尼或DXT培养液。实验分组、药物终浓度同细胞存活率检测方法。72 h后,用0.25%胰酶消化收集全部细胞,1 500 r/min离心5 min,弃上清;用冷PBS洗涤2次,加固定液1 mL、4℃固定2 h以上;离心后去上清,用冷PBS洗涤2次,加标记液500 μL(500 μL Assay Buffer+10 μL RNase A+10 μL PI),避光、室温孵育30 min,用流式细胞仪检测细胞周期。
1.2.5 细胞凋亡检测 其检测方法同细胞周期检测。加药72 h后,用0.25%胰酶消化收集全部细胞,1 500 r/min离心5 min后弃上清;用冷PBS洗涤2次,加500 μL Binding Buffer悬浮细胞、5 μL Annexin V-PE混匀,避光、室温反应5 min,过滤后用流式细胞仪检测细胞凋亡情况。
1.2.6 统计学方法 采用SPSS11.5统计软件,数据用s表示,细胞存活率比较用方差分析(oneway ANOVA)。P≤0.05为差异有统计学意义。
2 结果
2.1 不同顺序吉非替尼、DXT联用对细胞存活率的影响 吉非替尼、DXT均能抑制PC-9、PC-9/G、A549生长,其作用呈浓度依赖性(见图1~3)。吉非替尼对PC-9、PC-9/G、A549的IC50分别为(0.05 ±0.008)、(27.2±2.0)、(28.3±0.3)μmol/L,DXT分别为(12.8±1.9)、(21.4±1.1)、(14.5±0.2) μg/mL。各组不同细胞存活率比较响见表1。

图1 吉非替尼对PC-9的存活率—药物浓度曲线
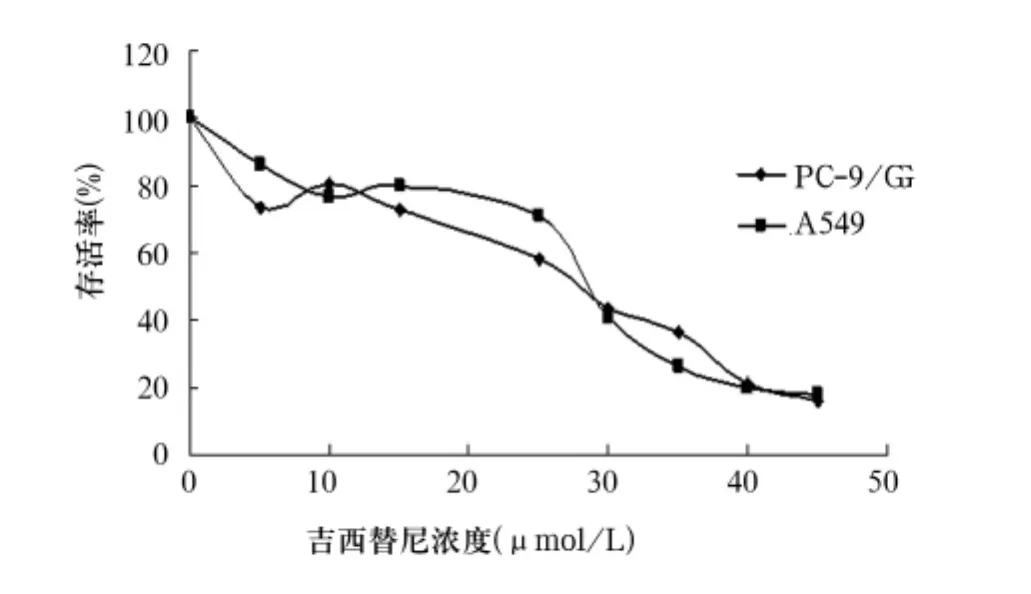
图2 吉非替尼对PC-9/G和A549的存活率—药物浓度曲线
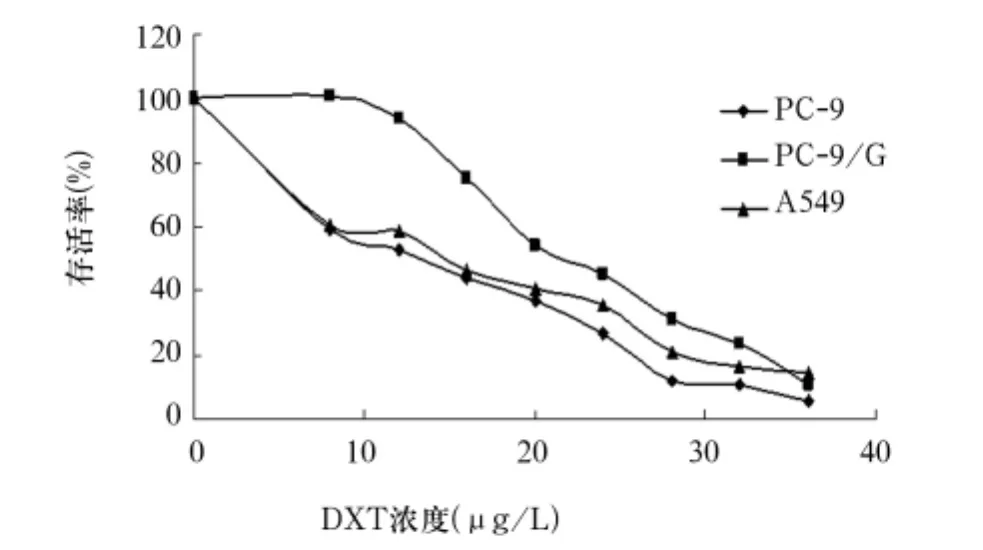
图3 DXT对PC-9、PC-9/G、A549的存活率—药物浓度曲线
表1 各组细胞存活率比较(%,s)

表1 各组细胞存活率比较(%,s)
注:与G组、D组比较,*P<0.05;与G-D组比较,#P<0.05
细胞 G组 D组 G→D组 D→G组PC9 42.1±1.8 45.4±1.8 34.8±0.2* 27.7±0.4*# PC9/G 57.6±0.2 63.8±2.3 50.0±2.9* 41.9±0.5*# A549 58.0±1.7 48.7±1.5 43.6±1.3* 34.5±1.1*#
2.2 不同顺序吉非替尼、DXT联用对细胞周期的影响 G组、G→D组PC-9、PC-9/G、A549的G0~G期细胞比例均较高,G2~M期细胞比例较少;D组、D→G组G2~M期细胞比例均较高,G0~G1期细胞比例较少。各组细胞周期细胞比例比较见表2。
表2 各组细胞周期细胞比例比较(%,s)

表2 各组细胞周期细胞比例比较(%,s)
注:与G组、G-D组比较,#P<0.05
细胞 G组 D组 G→D组 D→G组PC9 G0~G175.7±4.9 20.1±4.5# 73.3±3.4 17.8±6.1# S 10.2±0.4 14.5±7.9 10.5±7.4 13.8±8.5 G2~M 13.6±4.3 65.4±3.5# 16.2±5.9 68.4±10.4# PC9/G G0~G180.0±7.0 19.9±4.6# 71.9±4.7 20.6±5.9# S 6.0±3.3 11.0±4.5 8.1±3.3 19.4±3.8 G2~M 13.8±7.7 69.1±3.1# 20.0±1.6 60.0±4.4# A549 G0~G170.5±8.2 18.0±2.0# 70.5±7.8 18.0±3.9# S 18.1±7.5 11.0±6.9 6.8±0.9 10.0±6.9 G2~M 11.5±1.1 71.0±6.9# 22.7±7.0 72.0±3.8#
2.3 不同顺序吉非替尼、DXT联用对细胞凋亡的影响 与G→D组比较,D→G组PC-9、PC-9/G凋亡率明显升高,A549凋亡率无统计学差异。各组细胞凋亡率比较见表3。
表3 各组细胞凋亡率比较(%,s)

表3 各组细胞凋亡率比较(%,s)
注:与G组、G-D组比较,*P<0.05
细胞 G组 D组 G→D组 D→G组PC9 15.5±8.7 47.7±9.2*24.8±10.9 51.3±5.7* PC9/G 7.8±1.3 18.0±3.5* 9.2±3.5 21.6±1.1* A549 4.4±4.0 5.5±1.6 5.2±1.3 6.5±0.8
3 讨论
吉非替尼是选择性表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),是最常用的治疗NSCLC的分子靶向药物,对女性、非吸烟、EGFR突变的腺癌患者疗效显著[1]。DXT是治疗NSCLC的一、二线化疗药物。体外研究发现,吉非替尼可抑制细胞生长,阻滞细胞周期,促进细胞凋亡[2];DXT可促进细胞凋亡[3];EGFR-TKIs可增强化疗药物抑制肿瘤细胞生长的作用[4]。但临床试验发现,同时应用吉非替尼、DXT两类药物的NSCLC患者生存率并未延长[5]。
本研究显示,PC-9、PC-9/G、A549对吉非替尼和DXT均呈浓度依赖性,药物浓度越高,细胞存活率越低;吉非替尼、DXT联用抑制细胞增殖的效果均强于单药;先用DXT或吉非替尼都有协同作用,但先用DXT抑制细胞增殖的效果优于先用吉非替尼,其原因可能与两药作用机制不同有关。吉非替尼可影响细胞信号传导通路,使细胞增殖阻滞在G0~G1期;DXT主要作用在微管形成阶段,使细胞增殖阻滞在G2~M期。如受到外界因素影响,细胞生长周期无法到达微管形成阶段,DXT就不能完全发挥抑制细胞生长的作用,这可能是吉非替尼拮抗DXT的原因。本研究显示,与G→D组比较,D→G组PC-9、PC-9/G细胞凋亡率明显升高;提示吉非替尼可促进DXT诱导的凋亡,给予DXT前先用吉非替尼,可降低DXT的凋亡,说明凋亡可能为两药协同或相互拮抗的原因之一。Mahaffey等[6]研究发现,单用DXT或者先用DXT、后用厄罗替尼处理的NSCLC细胞,可明显表达凋亡相关蛋白;而单用厄罗替尼或先用厄罗替尼、后用DXT处理的细胞则无凋亡相关蛋白表达;提示细胞凋亡是引起两类药物顺序差异的重要原因,但其药物凋亡作用相互拮抗的机制尚待进一步研究。
总之,本研究显示先用DXT、后用吉非替尼是较理想的抑制NSCLC细胞增殖的最佳联用方案,无论原发性、获得性吉非替尼耐药患者,均可能在此方案中获得最大利益。
[1]Mitsudomi T,Yatabe Y.Mutations of the epidermal growth factor receptor gene and related genes as determinants of epidetmal growth factor receptor tyrosine kinase inhibitors sensitivity in lung cancer[J].Cancer Sci,2007,98(12):1817-1824.
[2]Huether A,Hopfner M,Sutter AP,et al.Erlotinib induces cell cycle arrest and apoptosis in hepatocellular cancer cells and enhances chmosensitivity towards cytostatics[J].Journal of Hepatology,2005,43(4):661-669.
[3]Mhaidat N,Zhang XD,Jiang CC,et al.Docetaxel-induced apoptosis of human melanoma is mediated by activation of c-Jun NH2-terminal kinase and inhibited by the mitogen-activated protein kinase extracellular signal-regulated kinase 1/2 pathway[J].Clin Cancer Res,2007,13(4):1308-1314.
[4]Ciardiello F,Caputo R,Bianco R,et al.Antitumor effect and potentiation of cytotoxic drugs activity in human cancer cell by ZD-1839(Iressa),an epidermal growth factor receptor-selective tyrosine kinase inhibitor[J].Clinical Cancer Research,2000,6(5): 2053-2063.
[5]Herbst RS,Giaccone G,Schiller JH,et al.Gefitinib in combination with paclitaxel and carboplatin in advanced non-small-cell lung cancer:a phaseⅢ trial-INTACT 2[J].J Clin Oncol,2004,22 (5):785-794.
[6]Mahaffey CM,Davies AM,Lara PN Jr,et al.Schedule-dependent apoptosis in K-ras mutant non-small-cell lung cancer cell lines treated with docetaxel and erlotinib:rationale for pharmacodynamic separation[J].Clin Lung Cancer,2007,8(9):548-553.
