BRL37344对3T3-L1脂肪细胞脂肪分解与脂肪因子表达的影响
2012-03-10耿厚法
岳 杉,耿厚法,班 博
(1天津医科大学研究生院,天津300070;2济宁医学院附属医院)
肥胖是糖尿病、高血压、冠心病等多种疾病的共同危险因素,近10余年肥胖率呈上升趋势,开发抗肥胖药物是目前国际研究的热点。研究显示,β3肾上腺素受体激动剂(β3ARa)对肥胖啮齿类动物有良好的抗肥胖作用,可降低其体脂含量。BRL37344是选择性β3ARa,其可通过降低体脂含量显著降低肥胖ob/ob小鼠的体质量,且不影响食物摄入[1]。目前,脂肪组织作为内分泌器官已逐渐成为共识,瘦素、TNF-α是与脂代谢密切相关的脂肪细胞因子。为探讨BRL37344减轻体质量、改善脂代谢的作用机制,2010~2011年,我们观察了BRL37344对3T3-L1细胞脂肪分解与脂肪因子表达的影响。现报告如下。
1 材料与方法
1.1 材料 3T3-L1前脂肪细胞株购自中国科学院细胞库;BRL37344、胰岛素、IBMX购自Sigma公司; DMEM培养基、胎牛血清(FBS)购自Hyclone公司;甘油测定试剂盒购自北京普利来公司;Trizol试剂购自Invitrogen公司;RT-PCR试剂盒购自Fermentas公司。
1.2 方法
1.2.1 细胞培养及药物干预 将3T3-L1前脂肪细胞置于含10%FBS的DMEM培养基,在37℃、5% CO2培养箱中培养,2~3 d换液一次,直至细胞单层融合至80%以上进行传代培养。以5×104个/孔密度接种于6孔培养板,用含10%FBS的DMEM培养基继续培养,待细胞生长融合后2 d,换用含0.5 mmol/L IBMX、1 μmol/L地塞米松及0.86 μmol/L胰岛素的DMEM培养基;诱导细胞分化48 h后,换用含1 μmol/L地塞米松及0.86 μmol/L胰岛素的培养基继续培养,2 d换液一次。诱导分化后10 d左右,3T3-L1前脂肪细胞80%以上呈成熟脂肪细胞表型,可用于实验[2]。细胞分化成熟后,分别用浓度0、10-9、10-7mol/L的BRL37344干预48 h,或用10-7mol/L的BRL37344干预0、12、24、48 h;观察BRL37344对待测指标的时间与剂量效应,收集细胞及培养基于-80℃冻存。
1.2.2 甘油释放含量检测 采用酶法检测培养基中的甘油释放含量,作为评价脂肪分解的指标。将50 μL DMEM培养液加入750 μL甘油测定液中,37℃、20 min后进行比色,计算待测样品的甘油含量[3]。
1.2.3 瘦素、TNF-αmRNA检测 采用RT-PCR法检测脂肪细胞中的瘦素、TNF-α mRNA,Trizol法提取3T3-L1脂肪细胞的总RNA,紫外分光光度计测定总RNA浓度与A260/A280比值。经琼脂糖电泳显示为28、18、5 s三条清晰带,A260/A280比值均大于1.8。定量后取总RNA 1.5 μg,以Oligo 18为引物进行逆转录反应,反应体系20 μL。取逆转录产物1 μL为模板进行PCR扩增,PCR反应体系25 μL。引物由上海生工生物工程研究所合成,RT-PCR引物序列及反应条件(略)。PCR产物经1.5%琼脂糖凝胶电泳后,用UVP凝胶密度扫描仪对各基因特异性扩增产物的电泳条带进行密度扫描,用Labwork3.0软件分析电泳条带的净光密度值,目的基因mRNA表达以该基因条带密度与β-actin基因条带密度的比值表示。
1.2.4 统计学方法 采用SPSS13.0统计软件,计量资料以s表示,进行t检验和方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 不同浓度BRL37344对3T3-L1脂肪细胞甘油释放含量的影响 BRL37344浓度为0、10-9、10-7mol/L时,甘油释放含量分别为(1.337±0.057)、(1.780±0.133)、(2.698±0.110)μmol/L。与0浓度比较,BRL37344 10-9、10-7mol/L时的甘油释放含量分别增加33%、102%(P<0.05或<0.01)。
2.2 不同时间BRL37344对3T3-L1脂肪细胞甘油释放含量的影响 10-7mol/L的BRL37344干预0、12、24、48 h后,甘油释放含量分别为(1.319± 0.053)、(1.402±0.112)、(1.973±0.098)、(2.747 ±0.125)μmol/L。与BRL37344干预时间0比较,其干预12、24、48 h后的甘油释放含量分别增加6%、50%、95%(P<0.05或<0.01)。
2.3 不同浓度BRL37344对3T3-L1脂肪细胞瘦素、TNF-α mRNA表达的影响 见表1。与0浓度比较,BRL37344 10-9、10-7mol/L时瘦素mRNA表达量分别降低38%、97%(P<0.05或<0.01),TNF-α mRNA表达量分别降低65%、130%(P<0.05或<0.01);呈剂量依赖性。
表1 不同浓度BRL37344对3T3-L1脂肪细胞瘦素、TNF-α mRNA表达的影响(s)

表1 不同浓度BRL37344对3T3-L1脂肪细胞瘦素、TNF-α mRNA表达的影响(s)
注:与0 mol/L比较,*P<0.05,**P<0.01
BRL37344浓度 瘦素mRNA TNF-αmRNA 0 mol/L 1.281±0.302 1.359±0.512 10-9mol/L 0.928±0.241* 0.824±0.326* 10-7mol/L 0.650±0.172** 0.591±0.211**
2.4 不同时间BRL37344对3T3-L1脂肪细胞瘦素、TNF-α mRNA表达的影响 见表 2。与BRL37344干预时间0比较,其干预12、24、48 h后瘦素mRNA表达量分别降低6%、48%、119%(P分别>0.05、<0.05、<0.01),TNF-α mRNA表达量分别降低10%、66%、158%(P分别>0.05、<0.05、<0.01);呈时间依赖性。
表2 不同时间BRL37344对3T3-L1脂肪细胞瘦素、TNF-α mRNA表达的影响(s)
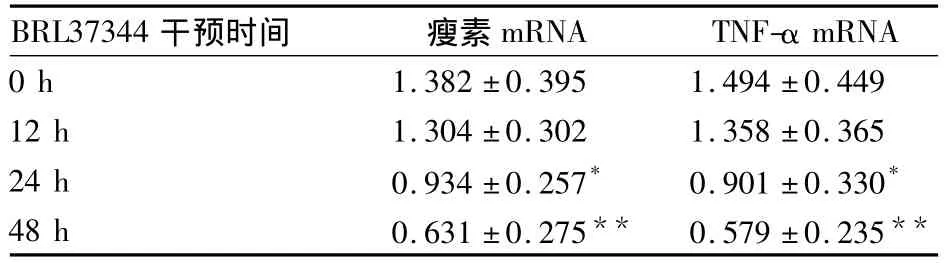
表2 不同时间BRL37344对3T3-L1脂肪细胞瘦素、TNF-α mRNA表达的影响(s)
注:与0 h比较,*P<0.05,**P<0.01
BRL37344干预时间 瘦素mRNA TNF-αmRNA 0 h 1.382±0.395 1.494±0.449 12 h 1.304±0.302 1.358±0.365 24 h 0.934±0.257* 0.901±0.330* 48 h 0.631±0.275** 0.579±0.235**
3 讨论
肥胖是高血压、糖尿病、冠心病等疾病的共同危险因素,据WHO报道,2015年全球肥胖及超体质量人群预计增至23亿。因此,开发抗肥胖药物日益受到重视。β3肾上腺素受体主要分布于棕色、白色脂肪组织,参与调节机体的脂肪分解和产热;β3ARa通过激活β3受体、促进白色脂肪组织的脂肪分解和棕色脂肪组织的非颤栗性产热而减轻体质量,为治疗肥胖症提供了新的思路。
肥胖常伴随脂肪分解过程改变,包括机体对刺激性脂肪分解反应减弱,导致甘油三酯利用减少,从而加重肥胖,形成恶性循环[4]。因脂肪细胞中的甘油三酯水解后,按比例释放甘油和游离脂肪酸,故本研究将测定培养基中的甘油释放含量作为评价脂肪分解的指标。本研究结果显示,BRL37344能显著增加脂肪细胞的脂肪分解,且随浓度及作用时间增加而逐渐增强;提示BRL37344能增加脂质分解,减少细胞内的脂质含量,减轻体质量。Kinney等[5]研究证实,BRL37344能显著增加肥胖C57BL/6小鼠附睾脂肪组织分解及游离脂肪酸氧化,减轻体脂含量。本研究结果与其结果一致。Candelore等[6]研究发现,BRL37344并未显著改变中国仓鼠卵巢细胞的脂肪分解。上述研究的差异可能与实验模型、方法及干预时间等有关。
脂肪组织是能量储存器官,也是人体最大的内分泌组织,其分泌的许多脂肪细胞因子对体内能量平衡有不可或缺的作用。瘦素是目前研究最深入的脂肪细胞因子,主要表达于白色脂肪组织,是肥胖ob基因的表达产物,主要作用于下丘脑能量代谢调节中枢,通过抑制食欲、增加能量消耗,减轻体质量。Kim等[7]发现,在3T3-L1前脂肪细胞分化成熟过程中,瘦素能刺激脂肪酸氧化,抑制CAAT,增强子结合蛋白-α与过氧化物酶体增殖物活化受体表达,减少细胞内甘油三酯积聚,抑制脂肪细胞生长发育。TNF-α是前炎症细胞因子,由脂肪细胞、单核巨噬细胞等产生;它是一种多功能细胞因子,与糖脂代谢密切相关。Chae等[8]研究推断,TNF-α通过激活NF-κB信号通路抑制脂肪细胞分化,使分化好的脂肪细胞逆向转变,包括细胞内脂质积聚减少、形态上由圆形转为长梭形等。此外,TNF-α可增加脂肪分化相关蛋白表达和脂滴包被蛋白磷酸化,促进脂肪分解。以上研究提示,在脂肪细胞脂代谢方面,增加瘦素、TNF-α mRNA表达有利于抑制脂肪细胞增殖及肥胖发生。然而与正常人相比,肥胖者脂肪组织常表达更多的瘦素及TNF-α,多项体外实验证实,脂肪细胞体积及数量增加与瘦素、TNF-α表达水平呈正相关[9]。肥胖伴随瘦素、TNF-α抵抗,体脂含量增加时,机体反馈性增加瘦素、TNF-α表达和分泌,加重抵抗状态。本研究显示,BRL37344可抑制3T3-L1脂肪细胞内的瘦素、TNF-α mRNA表达量,呈剂量与时间依赖性;提示BRL37344能增加脂肪细胞对瘦素、TNF-α的敏感性,改善其抵抗引起的代谢紊乱,促进其减重作用发挥,BRL37344与脂肪细胞内分泌功能间的相互作用也是药效产生的基础。
综上所述,BRL37344可促进脂肪细胞的脂质分解,抑制瘦素、TNF-α mRNA表达,其抗肥胖作用与促进脂肪分解,改善瘦素、TNF-α抵抗状态有关。3T3-L1脂肪细胞内瘦素、TNF-α mRNA表达量降低的确切原因有待进一步研究。
[1]Hashimoto K,Nagao Y,Ida K,et al.Improvement of metabolic disorders and visceral fat obesity by the beta 3-adrenoceptor agonist BRL35135A in genetically obese rodents[J].Biochem Pharmacol,1996,52(10):1529-1535.
[2]Ramanjaneya M,Chen J,Brown JE,et al.Identification of nesfatin-1 in human and murine adipose tissue:a novel depot-specific adipokine with increased levels in obesity[J].Endocrinology,2010,151(7):3169-3180.
[3]He J,Jiang H,Tansey JT,et al.Calyculin and okadaic acid promote perilipin phosphorylation and increased lipolysis in primary rat adipocytes[J].Biochim Biophys Acta,2006,1761(2):247-255.
[4]Duncan RE,Ahmadian M,Jaworski K,et al.Regulation of lipolysis in adipocytes[J].Annu Rev Nutr,2007,27(1):79-101.
[5]Kinney BP,Qiao L,Levauqh JM,et al.B56alpha/protein phosphatase 2A inhibits adipose lipolysis in high-fat diet-induced obese mice[J].Endocrinology,2010,151(8):3624-3632.
[6]Candelore MR,Deng L,Tota L,et al.Potent and selective human beta(3)-adrenergic receptor antagonists[J].J Pharmacol Exp T-her,1999,290(2):649-655.
[7]Kim WK,Lee CY,Kang MS,et al.Effects of leptin on lipid metabolism and gene expression of differentiation-associated growth factors and transcription factor during differentiation and maturation of 3T3-L1 preadipocytes[J].Endocr J,2008,55(5):827-837.
[8]Chae GN,Kwak SJ.NF-kappaB is involved in the TNF-alpha induced inhibition of the differentiation of 3T3-L1 cells by reducing PPARγ expression[J].Exp Mol Med,2003,35(5):431-437.
[9]Zhang Y,Guo KY,Diaz PA,et al.Determinants of leptin gene expression in fat depots of lean mice[J].Am J Physiol Regul Inteqr Comp Physiol,2002,282(1):226-234.
