广州一号桉树高效组培再生体系的建立1)
2012-03-05欧阳乐军沙月娥黄真池曾富华
欧阳乐军 沙月娥 黄真池 曾富华
(湛江师范学院,湛江,524048)
桉树是世界三大速生树种之一,共有1 039 个种、亚种和变种。据统计,全世界桉树人工林面积超过2 000 万hm2,是世界公认的三大人工林树种之一[1]。中国引种桉树已有120 a 历史,在17 个省(区)种植,每年新营造桉树林达33 万hm2,2011年,我国桉树人工林面积已达到368 万hm2,占全国人工林面积的6%以上,年生产木材近4 000 万m3,占国内自主生产纸浆材的50%以上,是我国重要的经济林树种[2]。广州一号桉是尾叶桉(E. urophylla)与细叶桉(E. tereticornis)的杂交种,具有速生丰产、抗逆性强的杂种优势,但由于不定芽分化率低,种苗快繁困难,生产上尚未能大面积推广,关于广州一号桉组织培养再生体系的研究也未见报道。
本试验在前期工作的基础上[3],利用噻唑基脲类新型分裂素(N-phenyl-N'-[6-(2-chlorobenzothiazol)-yl]urea,PBU)诱导广州一号桉高分化潜能的愈伤组织形成和不定芽分化增殖,使不定芽分化率达到90%,生根率为100%,并通过移栽方法优化,使组培苗移栽成活率达到95%,建立了广州一号桉高效组织培养再生体系。为生产上广州一号桉大规模商品化育苗提供一定的参考,也为广州一号桉遗传转化体系的建立奠定了基础。
1 材料与方法
供试材料为湛江市林业科学研究所提供的广州一号桉无菌苗,挑取粗壮的幼苗,将其嫩茎切成0.5 ~0.8 cm 长的不带芽点的茎段作为外植体。
PBU 由广东高校边缘热带特色植物工程技术开发中心李再峰等[4]合成,先将PBU 溶于少量二甲基甲酰胺,再加水定容至质量浓度为100 mg·L-1母液备用;2,4-二氯苯氧乙酸(2,4-D)、吲哚-3-丁酸(IBA)、萘乙酸(NAA)、吲哚乙酸(IAA)、6-苄基腺嘌呤(6-BA)、亚精胺(Spd)、腐胺(Put)、维生素C(Vc)、N-苯基-N'-1,2,3-噻二唑-5-脲(TDZ)均购置于生工生物工程(上海)有限公司,基本培养基采用MS 培养基,培养条件为温度(25±2)℃,光照强度约32.5 μmol·m-2·s-1,光照时间12 h·d-1。
愈伤组织诱导:将外植体接种于愈伤组织诱导培 养基(MS+30 g·L-1蔗糖+7 g·L-1琼脂+100 mg·L-1Vc,添加不同质量浓度的TDZ 与2,4-D 组合以及PBU 与IAA 组合,pH 值为5.8 ~6.0)上,于(25±2)℃下暗培养14 d,再光暗交替培养7 d 后计算愈伤组织形成情况及诱导率。
不定芽的分化:将外植体接种于愈伤组织诱导培 养基(MS+30 g·L-1蔗糖+7 g·L-1琼脂+100 mg·L-1Vc+2 mg·L-1PBU+0.06 mg·L-1IAA,pH值为5.8 ~6.0)上,经暗培养14 d、光暗交替培养7 d 后,再将外植体接种于不定芽分化培养基(1/2MS+500 μmol·L-1Put+100 μmol·L-1Spd+30 g·L-1蔗糖+7 g·L-1琼脂+100 mg·L-1Vc,添加不同质量浓度梯度的6-BA 和NAA 组合、6-BA 和IAA 组合,pH 值为5.8 ~6.0)上,40 d 后统计愈伤组织生长情况和不定芽诱导率。同时,分别用2 mg·L-1PBU 和0.06 mg·L-1IAA 组合、1.0 mg·L-12,4-D 与0.05 mg·L-1TDZ 组合(对照)诱导的两种愈伤组织作不定芽诱导率的比较,统计2 种不同激素组合诱导的愈伤组织在相同的不定芽诱导条件下(激素组合为1 mg·L-16-BA 和0.1 mg·L-1NAA),不定芽诱导情况的差异。
不定芽的增殖与伸长:将高约0.5 cm 且长势较好的芽丛切割成单株,保留部分愈伤组织基部,转移到不定芽伸长培养基(1/2MS+30 g·L-1蔗糖+7 g·L-1琼脂+100 mg·L-1Vc,添加不同质量浓度梯度的PBU 与NAA 组合,pH 值为5.8 ~6.0)上培养,20 d后统计不定芽伸长情况。
不定芽的生根:将高为3 ~4 cm 的无菌苗转入生根培养基(1/2MS+30 g·L-1蔗糖+7 g·L-1琼脂+100 mg·L-1Vc,分别添加不同质量浓度梯度的IBA、IAA 以及NAA,pH 值为5.8 ~6.0)中,培养20 d 后统计生根情况及生根率(即生根苗数占总苗数的百分率)。
炼苗与移栽:将生根良好的生根苗分成3 组,分别从恒温光照培养箱移至室外自然环境中分别炼苗10、15、20 d。挖取黄心土(山地红壤)、腐殖质土,分别以质量m(黄心土)∶m(腐殖质土)=1 ∶1、m(黄心土)∶m(腐殖质土)= 2 ∶1、m(黄心土)∶m(腐殖质土)=3 ∶1 3 种基质装于花盆当中,浇透水,将炼苗后的生根苗移栽至上述3 种基质中,20 d 后统计移栽成活率。
愈伤组织诱导及不定芽分化的每个试验处理均设置5 个重复的培养皿,每个培养皿接种20 个外植体,外植体愈伤组织以切口基部能观察到球状突起,即生长出直径大于2 mm 的愈伤组织计数,愈伤组织诱导率为生长愈伤组织外植体占接种外植体数的百分比。不定芽分化率以愈伤组织表面生长出大于4 mm 芽点的愈伤组织数占接种愈伤组织数的百分比[5]。不定芽伸长、生根及移栽的每个处理均设置5 个重复,每个重复5 个单株。数据利用SAS 分析软件进行处理,文中百分率数据分析时经过正弦平方根转换。
2 结果与分析
2.1 不同植物生长调节剂组合对愈伤组织形成的影响
外植体在愈伤组织诱导培养基上培养5 ~10 d,切口两端陆续开始产生愈伤组织,外植体呈哑铃状,以后逐渐从两端延伸形成膨大的愈伤组织。在光下培养1 周后,愈伤组织逐渐变为绿色,产生芽点(图1A)。
由表1可知,2,4-D 与TDZ 组合、PBU 与IAA组合,都能诱导愈伤组织形成,同一组合的不同质量浓度处理间愈伤组织诱导率差异达到极显著水平。PBU 与IAA 组合处理下的愈伤组织诱导率比2,4-D 与TDZ 组合高,愈伤组织形成快,结构较致密,在后续不定芽诱导中分化能力更好。当PBU 质量浓度为2 mg·L-1,IAA 质量浓度为0.06 mg·L-1时,5 d 后愈伤组织诱导率可达到100%。
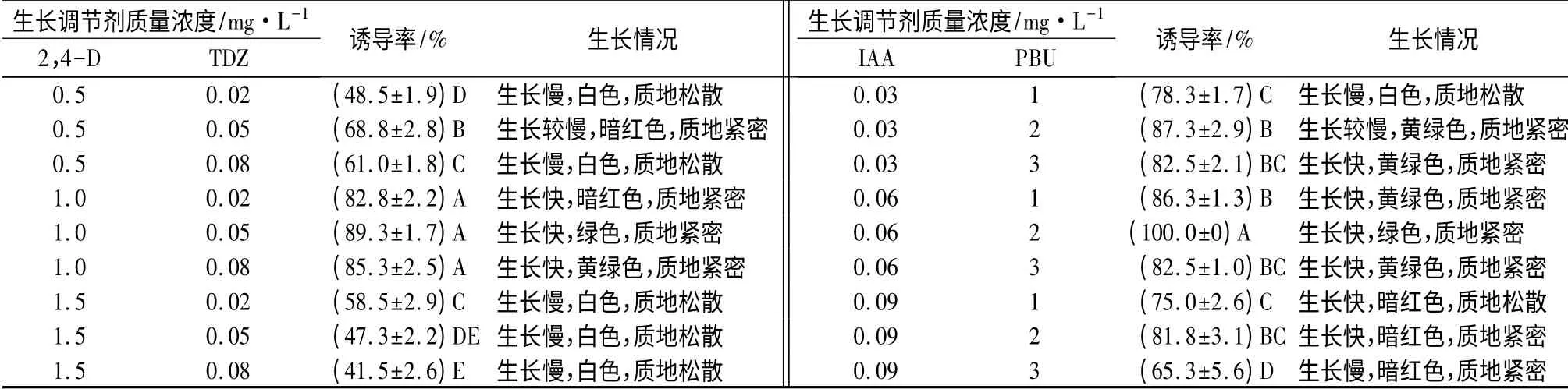
表1 不同植物生长调节剂组合对愈伤组织诱导的影响
2.2 不同植物生长调节剂组合对不定芽分化的影响
由表2可知,同一植物生长调节剂组合的不同质量浓度处理间不定芽诱导率差异达到极显著水平。在6-BA 和IAA 的组合中,诱芽率较低,最高诱导率仅为46%,且不定芽生长情况一般。6-BA 和NAA 的组合中,当6-BA、NAA 的质量浓度分别为1.0、0.10 mg·L-1时,诱芽率达到最大,为90%,生长状况好,30 d 后每块愈伤组织能产生约20 个小芽(图1B、C)。
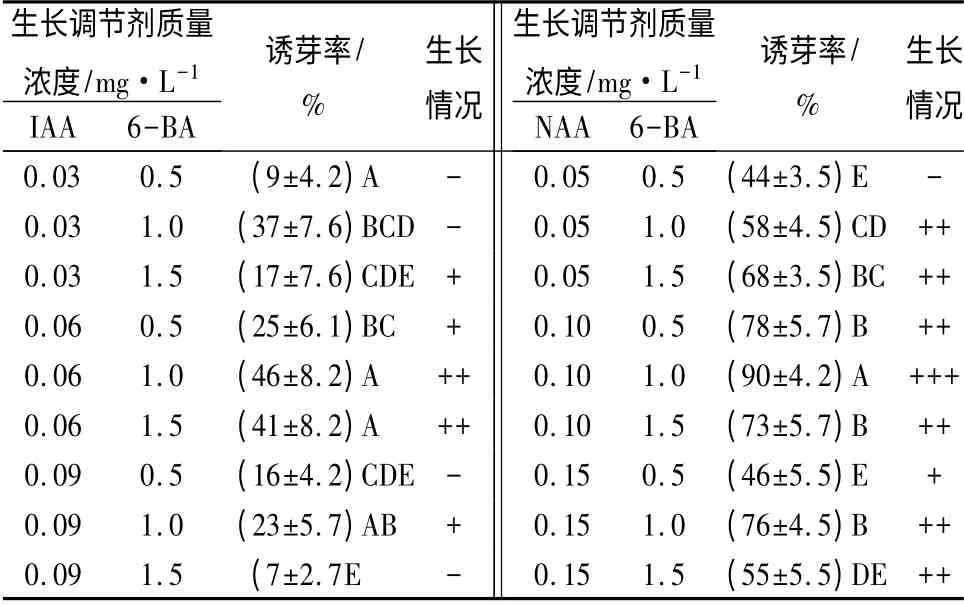
表2 不同植物生长调节剂组合对不定芽分化的影响
为了进一步探究用PBU 诱导的愈伤组织对后续诱芽率的影响,分别用2 mg·L-1PBU 和0.06 mg·L-1IAA 组合、1. 0 mg·L-12,4-D 与0. 05 mg·L-1TDZ 组合(作对照)诱导的2 种愈伤组织作诱芽率的比较,结果表明,在相同的不定芽诱导条件下,经PBU 诱导的愈伤组织平均诱芽率达到90.0%,而对照处理的诱芽率则只有49.6%,经t 检验,差异达到极显著水平。
2.3 不同质量浓度NAA 和PBU 组合对不定芽伸长的影响
本试验设计的所有植物生长调节剂组合诱导芽伸长高度的差异很大,从0.5 ~5 cm 不等(表3)。在低质量浓度的NAA 诱导下,不定芽增殖较多,明显影响到芽伸长的效率;当NAA 质量浓度为0.05 mg·L-1,PBU 质量浓度为0.2 mg·L-1时,不定芽有3 ~5 cm 的明显伸长,叶片绿色,芽苗生长情况较好(图1D)。
2.4 不同质量浓度的植物生长素对生根的影响
将3 cm 左右高的丛生芽切成单株后转入生根培养基,6 d 后在茎基部开始膨大,并有白色根点突起,9 ~15 d 后陆续长根,根由茎直接发出,无愈伤组织形成(图1E)。
如表4可见,不同质量浓度的3 种植物生长素诱导生根率差异较大,经方差分析达到极显著水平。当IBA 质量浓度为0.2 mg·L-1时,生根率最高可达100%,且生根时间短,根粗壮,根系发达;其次是IAA,生根诱导率最高也可达80%以上。而3 种质量浓度的NAA 诱导生根的效果均不是很好,诱导率均没有超过40%。

表3 不同质量浓度的NAA 和PBU 组合对不定芽伸长的影响
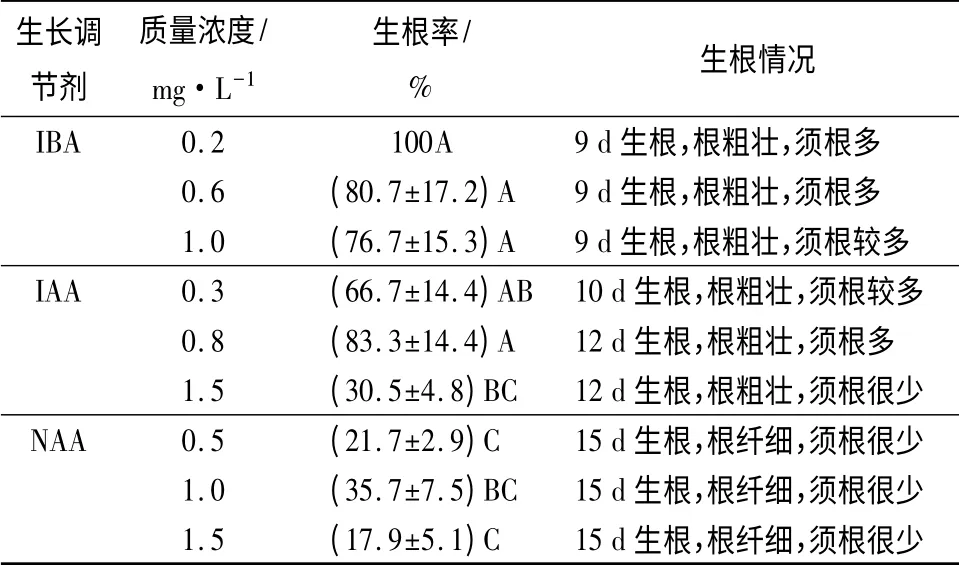
表4 不同质量浓度的生长调节剂对生根的影响
2.5 炼苗时间及移栽基质对生根苗移栽成活率的影响
从表5及表6中可知,不同炼苗时间以及移栽基质对广州一号桉生根苗移栽成活率影响较大。炼苗天数为15 d时成活最高,为95% 。移栽基质中m(黄心土)∶m(腐殖质土)= 1 ∶1 时,移栽后成活率最高,为95%,且长势也最好(图1F)。
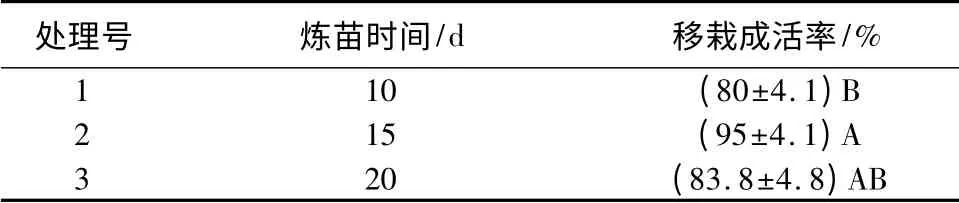
表5 不同炼苗时间及移栽基质对移栽成活率的影响

表6 不同移栽基质对移栽成活率的影响

图1 广州一号桉树再生过程
3 结论与讨论
桉树是多年生木本植物,其细胞返幼状态差,难以脱分化,也难于分化成芽,外植体也极易褐化,因此,在组织培养中诱导愈伤组织形成和分化均有较大难度,特别是广州一号桉是公认的一种不定化分化困难、快繁系数低、组培种苗生产成本高的桉树杂交树种。本实验室利用PBU 和其他植物生长调节剂组合来诱导尾叶桉、尾巨桉、粗皮桉等桉树树种的愈伤组织,结果表明,PBU 能极大地提高愈伤组织诱导率,且活力更好,更有利于后续培养中不定芽的分化[6-8]。在本研究中,PBU 比6-BA 更利于尾巨桉愈伤组织诱导,可能是因为PBU 是在N-取代苯基-N-(6-苯并噻唑基)脲类化合物的基础上,以2-硝基氯苯取代苯胺为原料,合成的脲类化合物,具有促进细胞分裂的作用,再加上IAA 的协同作用,诱导率明显升高,使愈伤组织诱导率达到100%。特别是愈伤组织活力较好,分化潜力强,在后续的不定芽诱导中,不定芽诱导率高达90%,比未经PBU 诱导形成的愈伤组织不定芽诱导率高出近40%,差异达到极显著水平,说明PBU 诱导形成的愈伤组织在后续培养中更有利于不定芽的分化。
在诱导不定芽的分化时,有部分学者采用KT诱导不定芽分化,因KT 作为一种具有很强的分裂素活性,能力较6-BA 强[9],大部分学者都采用6-BA 和NAA 2 种激素进行配比[10-11],结果证明不同质量浓度的6-BA 对桉树不定芽的诱导影响很大,本研究结果也表明,6-BA 1.0 mg·L-1与NAA 0.06 mg·L-1组合诱导广州一号桉不定芽形成的比率可达到90%,初步分析认为,促进细胞分裂能力相对较温和的6-BA,能改善细胞内源生长素和细胞分裂素的比例,调节细胞生理生化状态,有利于促进芽的分化,抑制根的分化。而KT 促进细胞分裂能力过强,不适于芽分化前期的愈伤生长,容易造成褐化。
在广州一号桉组培苗培育过程中,长时间的高湿度生长环境影响了组培苗叶片的形态结构,如角质层变薄、气孔调节失灵,加之组培苗的营养主要从培养基中获得,光合作用效率低下,从而导致组培生根苗在移栽后,散失的水分多于吸收的水分,对外界环境的变化所做出的反应也相应较大,移栽成活变得更加因难。本试验中通过对炼苗时间及移栽基质的优化,使移栽成活率高达95%。本研究发现,炼苗时间太短,组培苗难以适应外界环境;时间太长培养基易染菌,加之培养基消耗时间过长,营养不足,影响组培苗的生长,炼苗时间以15 d 为宜,多数组培苗植株叶片舒展,呈墨绿色,茎木质化程度好,根系发育正常,移栽成活率大为提高。同时,在移栽的腐殖质土中添加一定比例的黄心土,黄心土可以使组培苗染菌的机率大大降低,而腐殖质土则可使移栽基质疏松透气且富含丰富的有机质,提高移栽成活率,促进幼苗的快速生长。
[1] Ouyang L J,Huo Weihua,Huang Zhenchi,et al. Introduction of the Rs-AFP2 gene into Eucalyptus urophylla for resistance to Phytophthora capsici[J]. Journal of Tropical Forest Science,2012,24(2):198-208.
[2] 谢耀坚.中国桉树育种研究进展及宏观策略[J]. 世界林业研究,2011,24(4):50-54.
[3] 谭刻勤,欧阳乐军,李佩华,等.新型植物活性剂对桉树愈伤诱导及芽分化的影响[J].广东农业科学,2011(11):53-55.
[4] 李再峰,罗富英.N-芳基-N'-行取代噻唑基脲的合成与结构表征[J].化学研究与应用,2001,13(1):80-82.
[5] 裘珍飞,曾炳山,李湘阳,等.TDZ 对巨尾桉(GL9)胚性愈伤组织诱导和再生的影响[J]. 林业科学研究,2009,22(5):740-743.
[6] Huang Zhenchi,Zeng Fuhua,Lu Xiangyang. Efficient regeneration of Eucalyptus urophylla from seedling-derived hypocotyls[J].Biol Plantarum,2010,54:131-134.
[7] 欧阳乐军,黄真池,沙月娥,等.新型分裂素PBU 对尾巨桉胚性愈伤组织诱导及植株再生的影响[J].植物生理学报,2011,47(8):785-791.
[8] 曾富华,欧阳乐军,黄真池,等.粗皮桉组培再生的方法:中国,201110025808[P].2011-11-02.
[9] Pinto G,Park Y S,Silva S,et al. Factors affecting maintenance,proliferation,and germination of secondary somatic embryos of Eucalyptus globulus Labill[J]. Plant Cell Tiss Organ Cult,2008,95:69-78.
[10] Prakash M G,Gurumurthi K. Effects of type of explant and age,plant growth regulators and medium strength on somatic embryogenesis and plant regeneration in Eucalyptus camaldulensis[J].Plant Cell Tiss Organ Cult,2010,100:13-20.
[11] 欧阳乐军,李琼华,黄真池,等.3 种抗生素对尾巨桉愈伤组织诱导及植株再生的影响[J].西北农林科技大学学报:自然科学版,2012,40(2):79-84.
