交变电场对鸡血红细胞悬液低温保存特性的影响
2012-02-23马亚红钟力生胡慧玉
马亚红 钟力生 胡慧玉
(西安交通大学电力设备电气绝缘国家重点实验室 西安 710049)
1 引 言
随着生命科学研究的深入发展,特别是医学上活体组织器官移植的发展,使细胞、组织和器官的保存成为现代科学研究的一个重要领域,生物材料的低温保存技术也已成为重要课题。快速冻结和添加低温保护剂是目前生物材料低温保存的有效方法[1-2],能够明显抑制冰晶的形成,但是这些方法在具体实现中有很大的困难,同时存在一些问题[3],如通过快速冻结实现玻璃化保存需要极快速的降温速率(>106℃/min),生物材料热容、热导的各向异性导致降温速率的不均匀性,低温保护剂对细胞的毒害性等,特别是对于体积性对较大的生物体,常规的低温保存方法无法达到生物材料低温保存的目的。
生物体中含有大量的生物溶液,它属于稀释电解质溶液,其中含有许多种类的离子,如:K+、Na+、Ca2+、Mg2+、Cl-、I-等离子,生理盐水(0.9%NaCl溶液)在生物溶液中占主要成分。在电解质溶液中,离子是水化的,溶液中的部分水分子与离子紧密结合,形成水化离子,其余则为自由水分子[4]。水化离子模型如图1所示。

图1 电解质溶液中水化离子模型示意图Fig.1 Schematic of hydration ions in electrolyte solution
水分子是一种强极性分子结构,固有电偶极距为1.87D。分子动力学模拟研究结果显示,电场作用能够引起水分子排列结构的变化[5];一些研究结果也表明电场对冰晶的形成具有显著的影响[6-10,15]。本文以鸡血红细胞悬液为研究模型,在其低温保存过程中引入交变电场,研究交变电场对细胞悬液冻存特性的影响,为生物材料低温保存技术提供参考。
2 实验样品制备
选取鸡血红细胞用于低温冷冻保存实验研究。选用鸡血红细胞因为其具有完整成形的细胞核易于显微观察,而人和哺乳动物的成熟红细胞无细胞核和细胞器。制备鸡血红细胞悬液的步骤如下:
(1)用注射器在鸡翼下静脉取鸡血5 mL,即时使用。制备过程不添加抗凝剂,以免影响实验结果。
(2)取细胞悬液1 mL,移入10 mL离心管,加入4 mL0.9%生理盐水混匀,2 000 r/min,离心 5 min。
(3)弃上清液(用吸管吸去),加0.9%生理盐水至5 mL。混匀后以2 000 r/min速度离心5 min。
(4)重复上述条件,再离心洗涤1次。
(5)收集最后1次离心沉淀的血细胞,加入适量的0.9%生理盐水,直到红细胞在悬液中的浓度达到适合观测的数量。本次试验配置的细胞悬浮液浓度为2.05×107±7.52×105/mL。
3 实验设备及方法
3.1 实验设备
显微观察实验系统主要由7部分组成,分别为:正弦波信号发生器、信号监测、低温环境、光学显微镜、数字图象采集、实验微电极系统、计算机。显微观察系统的组成结构如图2所示。
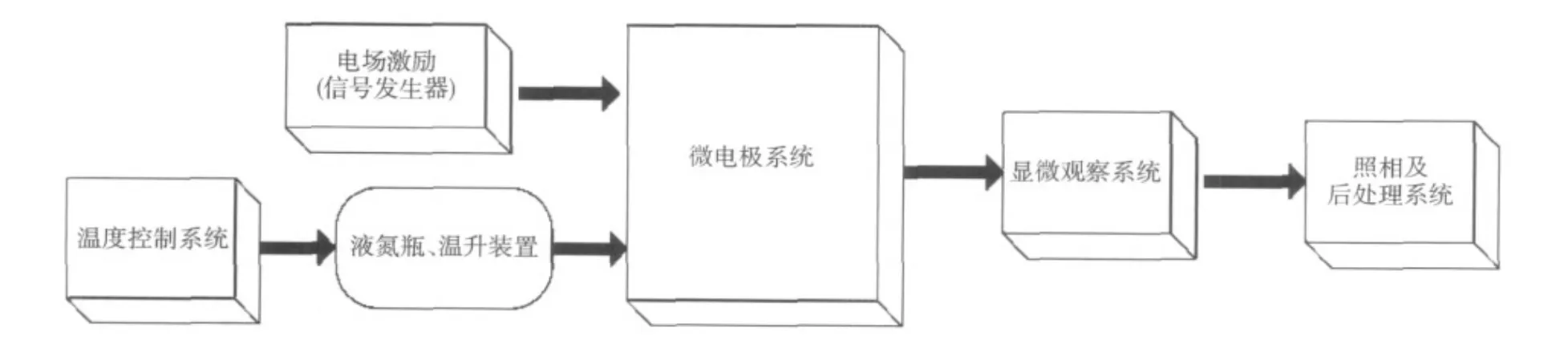
图2 红细胞冻存显微观察系统Fig.2 Microscopic system for observating red blood cell after freezing
在样品冷冻过程中,正弦波信号发生器提供一个正弦波电压信号,并通过铜电极系统作用于样品,为其提供干扰冻结过程的交变电场。正弦波信号发生器的型号为TFG-2001B,性能参数如下:输出波形:正弦波;频率范围:40 mHz—40 MHz;电压范围:100 mVp-p—20 Vp-p;
信号监测用于实时监测作用于实验样品上的正弦波电压信号的频率和幅值,采用TDS220型数字示波器对正弦波电压信号进行实时监测,数字示波器的性能参数为:频带宽度:100 MHz;采样速率:1 GS/s。
温度控制系统包括热台、液氮瓶、加热升温装置、热电阻测温装置,可以提供-180—600℃的温度范围。
光学显微镜型号为Olympus BX-51偏光显微镜,放大倍数:40—2 000。
实验电极采用叉指梳状微电极结构,上层和下层为直径16 mm的圆形石英玻璃载玻片,相对其它绝缘材料,其软化点较高,导热系数较大,光学性能优良。下层载玻片通过磁控溅射和激光刻蚀制作形成如图3所示的微电极结构[11-12]。金具有良好的导电性和化学惰性,可以消除电极表面双电层效应提高试验结果精确度,但由于金膜与玻璃基片的附着性较差,直接镀上后会部分脱落,因而需在金和石英玻璃间加入过渡金属。常采用的连接金属有铬,铬在大气中有很强的钝化能力,对多种酸和碱都具有很好的耐腐蚀性能,化学稳定性好,还有高硬度的特点。铬膜在多复合导电膜中常作为一种“过渡”[13-14],本微电极采用的基片及金属膜的立体结构如图4所示,其中铬膜为50 nm,金膜为80 nm,薄膜电阻率为6.175×10-8Ω·m。

实验过程中,实验样品用移液管滴在微电极区域,上面盖上盖玻片自然形成单层细胞悬液。操作过程中避免气泡的产生。正弦信号通过电极提供一个交变电场作用于实验样品,电场强度由正弦波电压和电极之间距离决定,本实验装置在理想情况下实验电极之间产生的最大电场强度仅为E=2×105V/m,频率为1 MHz。
3.2 实验方法
采用对比试验法,观察交变电场对细胞悬液冻存特性的影响。配置好浓度为2.05×107±7.52×105/mL初始细胞悬浮液保存在室温(25℃左右)环境中,另外3组分别施加不同条件在显微镜热台上以同样的降温速率5℃/min冷冻至-100℃,其中第一组施加1 MHz交变电场,第二组加入质量分数为3.3%的二甲基亚砜作为低温保护剂,第三组既不添加低温保护剂也不施加交变电场。冷冻结束后,并使其在室温(25℃左右)环境下自然解冻直接用偏光显微镜观察。
4 实验结果
图4是对照组和3组实验样品在1 000倍显微镜下的观察结果。图4a对初始细胞显微观察结果显示,红细胞形态完好,几乎所有细胞膜和细胞核均清晰可见。图4b冷冻过程中施加1 MHz交变电场作用的显微观察结果显示,部分红细胞因低温冷冻而造成细胞膜破损,但是还有少量红细胞幸免;从图中可以看出,经过冷冻而幸免的红细胞,其细胞形态基本保持完好,细胞膜没有因低温冷冻而遭到破坏,细胞存活率为23.4% ±1.43%,比对照组明显提高。图4c添加质量分数为3.3%的低温保护剂二甲基亚砜显微结果中可以看出,低温保护剂具有保护细胞免遭低温损伤的作用,经过低温冷冻后,部分细胞还是保持了完好的形态结构,细胞存活率为37.2% ±2.81%。图4d为对照组,冷冻过程中没有任何外加条件的显微观察结果显示,红细胞经过低温冷冻后细胞膜几乎全部破损,红细胞破损后留下的细胞核清晰可见。对照图4b和图4c电场同质量分数为3.3%的低温保护剂(二甲基亚砜)的低温保存效果相比还较差。通过该组对比实验结果表明交变电场对于低温无损保存生物材料具有一定的促进作用。但是还是需要进一步研究最佳电场条件以提高低温保存效率。
5 分析及结论
本实验中鸡血红细胞悬液中主要成分为红细胞、水分子、Na+、Cl–,慢速降温保存过程中交变电场的影响本文从水分子的偶极转向极化和离子位移极化两个方面分析,探讨交变电场影响生物材料低温保存过程的本质。

图4 显微观察图像(1 000倍)Fig.4 Microscopic image(1 000 times)
(1)水分子偶极转向极化。由于水分子是一种强极性分子,当交变电场频率小于水分子的松弛频率时,在电场作用下水分子的电偶极矩μ0将产生趋向外电场方向的重定向,电偶极矩μ0指向电场方向重定向的水分子具有最稳定的状态,水分子沿电场方向所具有的稳定状态为在过冷水中诱发冰核形成提供了有利条件,因此交变电场具有在过冷水中诱发冰核形成的作用。
(2)离子的电迁移运动。外加电场为交变电场,离子将在其自身的热平衡位置上随着电场变化产生不停的往复运动。离子在外加电场作用下产生的离子电迁移运动破坏了溶液中的电荷平衡,造成电荷密度的变化,从而引起局部强电场的出现,而强电场具有在过冷水中诱发冰核形成的作用。另外“离子碰撞假说[15]提出了在含盐水溶液中离子在电场中获得能量,并与冰晶产生碰撞,吸附在生长界面的水分子受到离子碰撞的冲击而脱离生长界面重新回到液相状态,生长界面上水分子浓度减小,减缓冰晶的生长速度,从而抑制了冰晶的生长。
通过对本实验结果的分析可以得到,在冷冻过程中施加1 MHz的交变电场能够抑制鸡血红细胞悬液中纯水冰晶的形成、离子偏析大幅减少,促进含盐冰结构的形成,从而避免红细胞在慢速冷冻过程中“溶质损伤”[16]。因此生物材料低温保存过程中施加一定频率的交变电场对保持细胞完整无损是非常有益的。将交变电场应用于生物材料的低温保存将是一种生物材料低温保存中的创新技术,开拓了电介质物理新的应用前景。
1 Armitage W J,Rich S J.Vitrifcation of organized tissues[J].Cryobiology,1990(27):483-496.
2 Fahy G M,MacFarlane D R,Angell C A,et al.Vitrification as an approach to cryopreservation[J].Cryobiology,1984(21):407-419.
3 Fahy G M,Saur J,Williams R J.Physical problems with the vitrification of large biological systems[J].Cryobiology,1990(27):492-510.
4 胡 英,吕瑞东,刘国杰,等.物理化学[M].北京:高等教育出版社,2005:192-197.
5 Jung D H,Yang J H,Jhon M S.The effect of an external electric field on the structure of liquid water using molecular dynamics simulations[J].Chemical Physics,1999,244:331-337.
6 Wei Sun,Xiaobin Xu,W Sun,et al.Effect of alternated electric field on the ice formation during freezing process of 0.9%KMn04Water[C].IEEE ICPADM2006,2006:774-777.
7 Sun Wei,Xu Xiaobin,Hong Zhang,et a1.The mechanism analysis of NaCl solution ice formation suppressed by electric field[C].IEEE ICPADM2006,2006:770-773.
8 谢 晶,华泽钊.氯化钠溶液在高压静电场中的冻结和解冻[J].上海水产大学学报,2002(3):53-57.
9 陈 程,陶乐仁,华泽钊.静电场对红细胞悬液冻结特性的影响[J].工程热物理学报,2005,26(5):841-843.
10 陈 程,陶乐仁,华泽钊.静电场对红细胞与冰晶间相互机械性作用的影响[J].低温工程,2004(5):45-49.
11 刘 彦.电子束蒸发与磁控溅射方法镀制铬膜研究[J].科技信息,2010(20):109,111.
12 穆敦发,陈文录.激光刻板技术在制造精细导线中的应用[C].2003春季国际PCB论坛论文集,上海:2003.207-217.
13 柳海鹏,周月豪,熊良才,等.准分子激光直刻横向影响区实验研究[J].激光技术,2005,29(2):132-134.
14 杨成娟,梅雪松,王文君等.金铬薄膜的飞秒激光烧蚀加工[J].红外与激光工程,2011,40(1):61-65.
15 孙 伟.交变电场对生物溶液相变特性的影响以及应用于低温生物保存的研究[D].西安:西安交通大学,2008.
16 Mazur P,Leibo S P,Chu E H Y.A two factor hypothesis of freezing injury[J].Experimental Cell Research,1972,71:345-355.
