高产γ-氨基丁酸乳酸菌菌株的筛选及诱变育种研究
2012-02-20吴海波
吴 非,边 鑫,李 良,吴海波,郭 丽
(1.东北农业大学食品学院,哈尔滨 150030;2.国家大豆工程技术研究中心,哈尔滨 150050;3.绥化学院生物与食品工程系,黑龙江 绥化 152061)
γ-氨基丁酸(γ-aminobuyric acid,GABA)是一种广泛分布于动、植物中的非蛋白质氨基酸[1],是哺乳动物脑内的抑制性递质。近年来,随着对GABA的研究不断深入,其降血压[2]、治疗癫痫[3]和焦虑症[4]等众多功效相继被发现,使得GABA受到食品、医疗行业人士的广泛关注。因此,如何提高GABA的含量成为目前国内外的研究热点。目前,GABA主要是通过谷氨酸脱羧酶(GAD)催化谷氨酸转化而成的[5]。研究发现,乳酸菌、霉菌、酵母菌以及其他微生物中含有这种酶[6-8],可通过提取出的GAD催化谷氨酸转化或微生物发酵来生产GABA。本研究从食用级乳酸菌着手,以豆浆(大豆∶水=1∶8)为发酵基质进行发酵,筛选出GABA的高产菌株,然后利用紫外线对高产菌株进行诱变处理,将得到的突变菌株用含有代谢产物GABA的培养基进行抗性初筛,再依次利用含有1%谷氨酸的改良MRS培养基和豆浆发酵进行复筛及遗传稳定性试验,最终得到稳定高产GABA突变菌株。
1 材料与方法
1.1 材料
1.1.1 乳酸菌菌株
嗜热链球菌(Streptococcus thermophilus),保加利亚乳杆菌(Lactobacillus bulgaricus)L1,L2,L12,副干酪乳杆菌(Lactobacillus paracasei),乳酸乳球菌乳酸亚种(Lactococcus lactis subsp.),均由乳品科学教育部重点实验室提供。
1.1.2 试剂
GABA标准品(美国Sigma公司);四硼酸钠(天津市光复精细化工研究所);次氯酸钠(天津富宇精细化工有限公司);苯酚(沈阳东兴试剂厂);乙醇(天津市海滨科迪化学试剂有限公司)。
1.1.3 培养基
改良MRS培养基:蛋白胨5 g,胰蛋白胨10 g,牛肉膏5 g,酵母膏5 g,葡萄糖10 g,乙酸钠5 g,吐温-80 1 g,柠檬酸二胺2 g,磷酸氢二钾2 g,硫酸镁0.1 g,硫酸锰0.25 g,蒸馏水1 000 mL,调pH 5.5。
1.2 方法
1.2.1 豆浆的制备
取大豆加水浸泡6~8 h,沥干后,把泡好的大豆用豆浆机研磨,用纱布过滤。向豆渣中加入适量的纯净水,充分搅拌后,磨滤两次。把3次磨滤制得的浆液混合,再加入适量纯净水混匀,使豆浆中大豆和水的比例为1∶8。然后,用八层纱布过滤4次。
1.2.2 GABA含量的测定方法
本文采用Berthefot比色法[9]测定发酵液中GABA的含量。
1.2.3 乳酸菌菌株的活化
从乳酸菌冻存管中取300 μL菌液,接入10 mL改良MRS液体培养基中,40℃下活化培养24 h,然后,从10 mL改良MRS液体培养基中吸取1.5 mL菌液于50 mL改良MRS培养基中,40℃下培养18 h。再从50 mL改良MRS中吸取3 mL菌液于100 mL改良MRS培养基中,40℃下培养16 h后备用。
1.2.4 高产GABA乳酸菌菌株筛选
将6株活化的乳酸菌菌株接种于改良MRS液体培养基中,40℃静置培养至其稳定期。取7个三角瓶分别倒入等量的豆浆,用封口膜封好,进行巴氏杀菌。杀菌后,取其中一个三角瓶中的样品,测其GABA含量。然后,将不同乳酸菌以3%的接种量分别接到剩下的6个三角瓶中。在40℃恒温条件下发酵12 h。发酵期间每隔1 h取样1次,测定GABA含量,通过GABA含量的比较,获得高产GABA乳酸菌菌株。
1.2.5 高产GABA乳酸菌菌株紫外诱变、抗性初筛及复筛
1.2.5.1 菌悬液的制备
将菌株以3%的接种量接种于含1%谷氨酸的改良MRS液体培养基中,培养至对数期后,取20 mL菌液离心(6 000×g,4℃,15 min),弃上清液,用无菌生理盐水将沉淀溶解,调整菌数约为108cfu·mL-1,即得菌悬液[10]。
1.2.5.2 紫外诱变处理、抗性初筛及复筛
取6 mL菌悬液注入9 cm培养皿中,将培养皿置于磁力搅拌器上,先打开紫外灯(18 W,距离45 cm)预热20 min,再打开磁力搅拌器,将皿盖取下,用紫外灯垂直照射10、20、30、40、50和60 s。然后,取照射菌液1 mL分别稀释102、103、104、105、106、107。再将不同稀释度的菌液涂布于含适当浓度GABA的改良MRS平板上,同时以未诱变菌株的平板作对照,避光置于40℃的恒温培养箱中培养48 h,进行菌落计数,计算致死率。取致死率在90%以上的单菌落转接于含1%谷氨酸的改良MRS液体培养基中,40℃下静置培养24 h后,测定GABA含量,进行抗性初筛,并计算正突变率。
取GABA含量较高的正突变菌株,分别以3%的接种量接入豆浆中,在40℃恒温条件下发酵,根据发酵过程中GABA最大产量进行复筛,最终获得高产GABA乳酸菌突变菌株。
1.2.6 高产GABA乳酸菌突变菌株遗传稳定性分析
将经过筛选得到的高产乳酸菌突变菌株连续传代12次,每3代取一次菌液进行发酵,测定发酵液中GABA含量,以确定其遗传稳定性。
1.2.7 统计分析
原始数据的整理采用Microsoft Excel 2003进行,每组试验样品均作3个重复进行检测。
2 结果与分析
2.1 乳酸菌发酵豆浆过程中GABA积累量随发酵时间的变化
将6株乳酸菌培养至稳定期后,进行接菌发酵,通过豆浆发酵过程中GABA积累量筛选出高产GABA乳酸菌菌株。6株乳酸菌菌株的GABA积累量随发酵时间的变化情况见表1。
由表1可见,豆浆本身就含有GABA,含量为0.819 g·L-1。同时发现6株菌株在发酵2 h左右开始生产GABA,当发酵7 h时,乳酸乳球菌乳酸亚种的GABA产量首先到达最大值,为0.702 g·L-1;当发酵8 h时,保加利亚乳杆菌L2和L12的GABA产量达到最大值,分别为1.066和0.609 g·L-1;当发酵9 h左右时,副干酪乳杆菌和保加利亚乳杆菌L1的GABA产量达到最大值,分别为0.755和0.776 g·L-1;而当发酵到10 h左右时,嗜热链球菌的GABA产量才达到最大值,为0.909 g·L-1。通过对GABA产量的比较,可以看出,保加利亚乳杆菌L2的GABA产量最大,因此,可以确定保加利亚乳杆菌L2为高产GABA乳酸菌。
表1 乳酸菌在发酵过程中GABA积累量随发酵时间的变化情况(¯±S)Table 1 GABA accumulation along with the change of fermentation time by Lactobacillus during fermentation
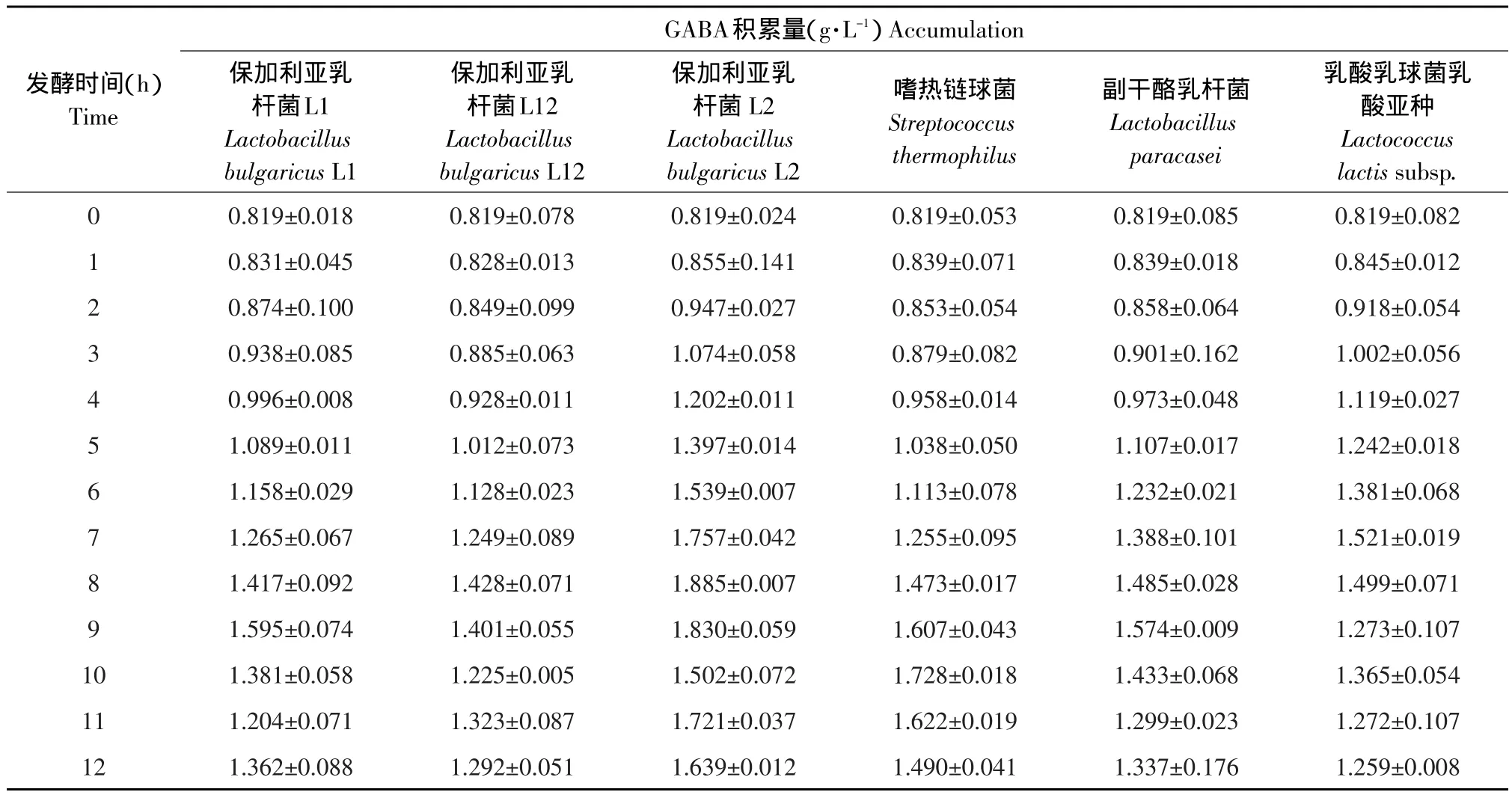
表1 乳酸菌在发酵过程中GABA积累量随发酵时间的变化情况(¯±S)Table 1 GABA accumulation along with the change of fermentation time by Lactobacillus during fermentation
GABA积累量(g·L-1)Accumulation发酵时间(h)Time 0 1 2 3 4 5 6 7 8 9 1 0 11 12保加利亚乳杆菌L1 Lactobacillus bulgaricus L1 0.819±0.018 0.831±0.045 0.874±0.100 0.938±0.085 0.996±0.008 1.089±0.011 1.158±0.029 1.265±0.067 1.417±0.092 1.595±0.074 1.381±0.058 1.204±0.071 1.362±0.088保加利亚乳杆菌L12 Lactobacillus bulgaricus L12 0.819±0.078 0.828±0.013 0.849±0.099 0.885±0.063 0.928±0.011 1.012±0.073 1.128±0.023 1.249±0.089 1.428±0.071 1.401±0.055 1.225±0.005 1.323±0.087 1.292±0.051保加利亚乳杆菌L2 Lactobacillus bulgaricus L2 0.819±0.024 0.855±0.141 0.947±0.027 1.074±0.058 1.202±0.011 1.397±0.014 1.539±0.007 1.757±0.042 1.885±0.007 1.830±0.059 1.502±0.072 1.721±0.037 1.639±0.012嗜热链球菌Streptococcus thermophilus 0.819±0.053 0.839±0.071 0.853±0.054 0.879±0.082 0.958±0.014 1.038±0.050 1.113±0.078 1.255±0.095 1.473±0.017 1.607±0.043 1.728±0.018 1.622±0.019 1.490±0.041副干酪乳杆菌Lactobacillus paracasei 0.819±0.085 0.839±0.018 0.858±0.064 0.901±0.162 0.973±0.048 1.107±0.017 1.232±0.021 1.388±0.101 1.485±0.028 1.574±0.009 1.433±0.068 1.299±0.023 1.337±0.176乳酸乳球菌乳酸亚种Lactococcus lactis subsp.0.819±0.082 0.845±0.012 0.918±0.054 1.002±0.056 1.119±0.027 1.242±0.018 1.381±0.068 1.521±0.019 1.499±0.071 1.273±0.107 1.365±0.054 1.272±0.107 1.259±0.008
2.2 保加利亚乳杆菌L2紫外诱变时间的选择
由于不同菌种对紫外线敏感程度不同,本试验根据保加利亚乳杆菌L2的致死率和正突变率来确定最佳紫外照射时间,结果如图1所示。
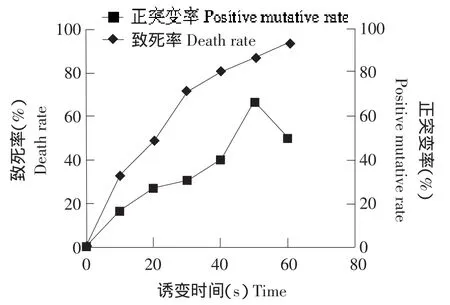
图1 紫外线照射时间对保加利亚乳杆菌L2致死率与正突变率的影响Fig.1 Effect of UV irradiation time on death rate and positive mutative rate of Lactobacillus bulgaricus L2
夏江、马燕等研究认为,进行菌株诱变时,一般先选取菌株致死率在70%~95%之间所对应的诱变时间,然后观察其正突变率,正突变率最大值对应的诱变时间即为紫外线最佳照射时间[11-12]。由图1可以看出,保加利亚乳杆菌L2的致死率随着紫外照射时间的增加而逐渐增加,致死率在70%~95%之间所对应的诱变时间为30~60 s。照射时间在50 s时,保加利亚乳杆菌L2的致死率为87%,其正突变率达到最大值,为66.67%,因此,确定紫外最佳照射时间为50 s。
2.3 保加利亚乳杆菌L2紫外诱变的抗性初筛、复筛、二次复筛及遗传稳定性
将保加利亚乳杆菌L2用紫外线处理50 s后,稀释涂布于含GABA的改良MRS平板上,培养48 h,进行抗性初筛。挑取长势较好的30个单菌落接入含有1%L-谷氨酸的改良MRS培养基中发酵进行复筛,获得正突变菌株20株,正突变率为66.67%,正突变菌株的GABA产量见表2。
由表2可知,有三株突变菌株的GABA产量相对较高,取名为L2-4、L2-7和L2-22,在含有1%L-谷氨酸的改良MRS培养基中GABA产量分别为4.235、3.921和4.108 g·L-1,比原菌种分别提高了25.63%、16.32%、21.86%。
将L2-4、L2-7和L2-22三株高产GABA正突变菌株接入豆浆中发酵,每隔1 h测定GABA含量,结果见表3。
表2 紫外诱变后得到的正突变菌株(¯±S)Table 2 Strains of positive mutation by UV mutation

表2 紫外诱变后得到的正突变菌株(¯±S)Table 2 Strains of positive mutation by UV mutation
原菌株和正突变菌株Strain and positive mutative strain L2 L2-2 L2-4 L2-5 L2-7 L2-8 L2-9 L2-11 L2-12 L2-14 L2-15 L2-16 L2-17 L2-18 L2-20 L2-22 L2-24 L2-25 L2-26 L2-27 L2-30 GABA产量(g·L-1)Yield 3.371±0.019 3.526±0.110 4.235±0.043 3.802±0.008 3.921±0.029 3.677±0.205 3.522±0.074 3.618±0.021 3.467±0.253 3.545±0.189 3.555±0.005 3.765±0.052 3.492±0.011 3.564±0.072 3.518±0.015 4.108±0.004 3.665±0.012 3.478±0.085 3.713±0.124 3.648±0.077 3.752±0.067
表3 正突变菌株在发酵豆浆过程中GABA积累量随时间变化情况(¯±S)Table 3 GABA accumulation along with the change of fermentation time by strains of positive mutation during soya bean milk fermented (g·L-1)
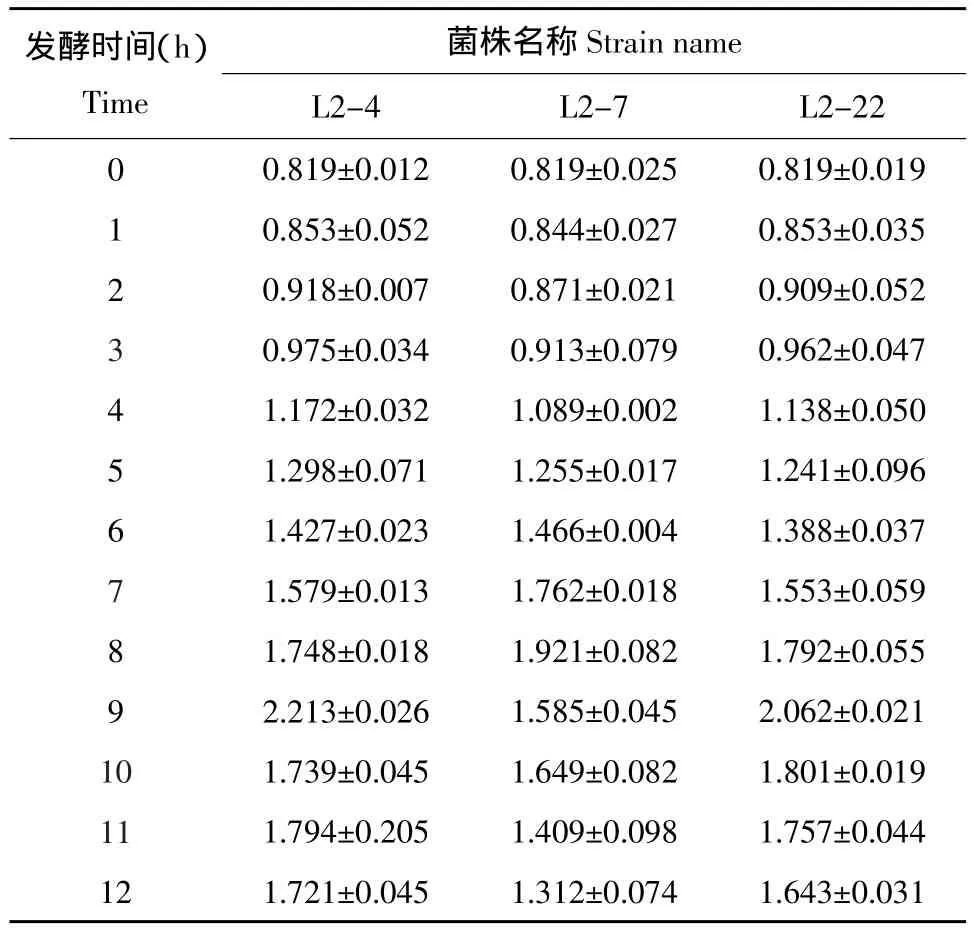
表3 正突变菌株在发酵豆浆过程中GABA积累量随时间变化情况(¯±S)Table 3 GABA accumulation along with the change of fermentation time by strains of positive mutation during soya bean milk fermented (g·L-1)
发酵时间(h)Time菌株名称Strain name 0 1 2 3 4 5 6 7 8 9 1 0 11 12 L2-4 0.819±0.012 0.853±0.052 0.918±0.007 0.975±0.034 1.172±0.032 1.298±0.071 1.427±0.023 1.579±0.013 1.748±0.018 2.213±0.026 1.739±0.045 1.794±0.205 1.721±0.045 L2-7 0.819±0.025 0.844±0.027 0.871±0.021 0.913±0.079 1.089±0.002 1.255±0.017 1.466±0.004 1.762±0.018 1.921±0.082 1.585±0.045 1.649±0.082 1.409±0.098 1.312±0.074 L2-22 0.819±0.019 0.853±0.035 0.909±0.052 0.962±0.047 1.138±0.050 1.241±0.096 1.388±0.037 1.553±0.059 1.792±0.055 2.062±0.021 1.801±0.019 1.757±0.044 1.643±0.031
通过表3可以发现,L2-7发酵到8 h时,产量达到最大值,为1.102 g·L-1;而L2-4和L2-22发酵到9 h时,产量达到最大值,分别为1.394和1.243 g·L-1。3株突变菌株比原菌株的GABA产量分别提高了3.4%、30.77%和16.6%。因此,选取L2-4和L2-22两株突变菌株进行遗传稳定性试验,图2为L2-4和L2-22在传代12次后,每三代的GABA产量变化情况。
由图2所示,突变菌株L2-4在连续传代12次后,GABA产量比较稳定,而突变菌株L2-22的GABA产量明显下降,说明L2-4比L2-22有更稳定的产GABA能力。
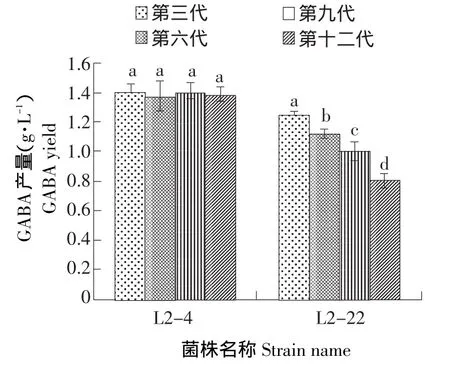
图2 紫外诱变筛选的突变菌株产GABA遗传稳定性Fig.2 Genetic stability of mutant strains producing GABA by UV mutation
综上所述,通过紫外诱变获得了稳定的高产GABA突变菌株L2-4,其在1%L-谷氨酸的改良MRS培养基和豆浆中GABA产量分别为4.235和1.394 g·L-1,比原菌株的GABA 产量分别提高了25.63%和30.77%。在相同的试验条件下,对高产GABA突变菌株L2-4的GABA产量进行验证试验,试验结果与该结果相同。
3 结论
a.以豆浆为发酵基质,通过比色法测定豆浆中GABA含量,对6株乳酸菌进行筛选结果表明:保加利亚乳杆菌L2为高产GABA乳酸菌菌株,GABA产量为1.066 g·L-1。
b.对保加利亚乳杆菌L2进行紫外诱变处理,结果表明,最佳紫外线照射时间为50 s。
c.在最佳紫外照射时间下,筛选出一株稳定的高产GABA突变乳酸菌菌株L2-4,其在含有1%L-谷氨酸的改良MRS培养基中的GABA产量为4.235 g·L-1,比原菌株的GABA产量提高了25.63%;同时,L2-4在豆浆中的GABA产量为1.394 g·L-1,比原菌株的产量提高了30.77%。
[1]陈恒文,林健.桑叶中γ-氨基丁酸的研究概述[J].食品工业科技,2008(8):298-304.
[2]Carcia M C,Adler-Graschinsky E,Celuch S M.Role of CGRP and GABA in the hypotensive effect of intrathecally administered anandamide to anesthetized rats[J].European Journal of Pharmacology,2006(532):88-98
[3]于霞,史正刚,姬可平.GABA受体在儿童失神性癫痫发病机制中的作用[J].中国优生与遗传杂志,2004,12(5):10-11.
[4]李瑞芝,郭建友,李昌煜,等.焦虑症γ-氨基丁酸受体机制与药物干预研究进展[J].中国药理学通报,2010,26(9):
[5]叶惟怜.γ-氨基丁酸的发现史[J].生理科学进展,1986,17(2):187-189.
[6]Yokoyama S,Hiramatsu J I,Hayakawa K.Production of γ-aminobutyric acid from alcohol distillery lees by Lactobacillus brevis IFO-12005[J].Journal of Bioscience and Bioengineering,2002,93(1):95-97.
[7]Su Y C,Wang J J,Lin T T.Production of the secondary metabolites γ-aminobutyric acid and monacolin K by Monascus[J].Ind Microbiol Biotechnol,2003(1):41-46.
[8]蒋冬花,李杰,后家衡.水果表面高产γ-氨基丁酸酵母菌菌株的筛选、鉴定和发酵条件优化[J].浙江农业学报,2008,20(6):396-401.
[9]Kitaoka S,Nakano Y.Colorimetric determination of ω-amino acids[J].The Journal of Biochemistry,1969,66(1):87-94.
[10]刘宁宁.产γ-氨基丁酸乳酸菌的筛选及作为酸奶发酵剂条件的研究[D].哈尔滨:东北农业大学,2010:4-12.
[11]夏江,梅乐和,黄俊,等.产γ-氨基丁酸的乳酸菌株筛选及诱变[J].核农学报,2006,20(5):379-382.
[12]马燕,黄春萍,黄敏.用亮氨酸抗性法选育L2甲硫氨酸高产突变株[J].四川师范大学学报,2004,27(3):303-306.
