胃神经鞘瘤的CT表现与病理对照研究
2012-02-10李建胜汪丹凤张雪林
李建胜,汪丹凤,刘 恺,张雪林
(南方医科大学南方医院影像中心,广东 广州 510515)
胃神经鞘瘤是一种少见的胃部肿瘤,最早文献是1988年由Daimaru等[1]报道,该肿瘤起源于胃部肌间神经丛神经鞘的雪旺氏细胞,发生率低,约占整个神经鞘瘤的0.2%[2],此肿瘤多为良性病变,恶性少见,本病因其缺乏临床特异性,术前大多不易诊断,主要以胃部不适、疼痛或腹部肿块为主诉就诊,临床诊断难以明确。为提高对此肿瘤的认识,我们报道10例胃神经鞘瘤,结合相关文献就其CT表现、其他影像学检查、病理及鉴别诊断作一探讨。
1 资料与方法
1.1 一般资料
本组病例为10例经手术、病理证实的胃神经鞘瘤患者。其中男7例,女3例。年龄29~67岁,平均48岁。临床症状有胃部不适(7例)、呕吐(3例)、黑便(3例)、腹部肿块(3例)。
1.2 检查方法
检查前禁食、禁水8h,检查前半小时口服2%泛影葡胺200mL或200 mL水。采用GE公司Light-Speed 16排螺旋CT机,层厚5mm,层间距5mm,病灶层面行1.25mm薄层重建,120kV,220mAs。采用高压注射器经肘静脉团注对比剂,剂量为80~120mL或1.5 mL/kg体质量,注射速率为2.0~3.0 mL/s。行平扫及双期增强扫描,双期增强扫描时间为注射对比剂后25~30s行动脉期扫描、1min后行静脉期扫描,其中4例行延迟扫描,延迟时间为3min。图像由两名5年以上具有CT诊断经验的医师分析病变的CT表现,包括病变的位置、大小、生长方式、密度、边缘及增强特征。
2 结果
2.1 CT征象
2.1.1 位置
均为单发病灶,病灶位于胃体部6例(其中胃大弯处5例,胃小弯处1例),位于胃窦部2例,位于胃底部2例(图1~3)。
2.1.2 大小、边缘、密度
病灶体积最大为88 mm×77 mm(图4~6),最小为10 mm×9 mm。全部病灶与胃壁分界清楚,6例突向胃腔内,形成充盈缺损影;3例突向胃腔及胃壁外,其中2例胃腔面见溃疡形成(图7~9),可见龛影,龛影内见造影剂填充,肿块胃壁外边界清楚;1例胃壁外生长(图4,5),呈浅分叶状,边境清楚。9例密度均匀,呈等或稍低密度影,1例密度略不均匀,但未见明显出血、坏死及钙化灶。
2.1.3 增强扫描
5例病灶动脉期未强化,静脉期中度强化;4例病灶动脉期轻度强化,静脉期中度强化,强化均匀;1例病灶动脉期轻度不均匀强化,静脉期中度略不均匀强化。其中4例行延迟期扫描,强化程度未见明显改变。
2.2 病理

图1 ~3 胃底部神经鞘瘤。胃底腔内结节样病变,边界清楚,密度均匀,呈等密度,增强扫描该病灶中度均匀强化。图3为冠状位MPR重建,可见肿块以腔内生长为主,略突向胃腔外。Figure 1~3. Gastric schwanomas in the fundus of the stomach.The fundus of the stomach cavity has a nodular lesion, with well-demarcated border and homogeneous density.Moderate enhancement is seen after contrast administration.Figure 3: Coronary MPR reconstruction shows the mass located within the cavity protruded outward.

图4 ~6 胃大弯处神经鞘瘤。胃大弯胃壁处巨大胃腔内外生长肿块,胃腔内面溃疡形成,可见龛影,胃腔外肿块边界清楚,肿块呈均匀稍低密度,增强扫描静脉期中度强化,未见明显坏死灶。图6为冠状位MPR重建,可见肿块定位于胃大弯处,溃疡龛影显示清楚。Figure 4~6. Gastric schwanomas in the greater curvature of stomach.The greater curvature of stomach has a huge mass growing to both inside and outside of the stomach,with ulcerated surface.It is well-defined with mild low density.Enhanced scanning shows moderate enhancement without necrotic zone.Figure 6:Coronary MPR reconstruction shows the mass in the greater curvature of stomach,with clear ulcer niche.
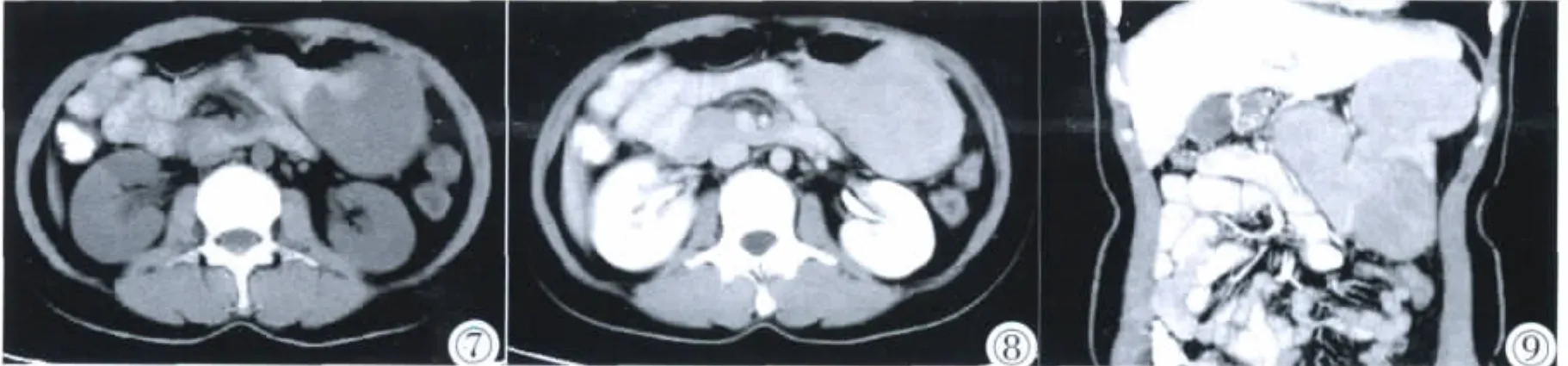
图7 ~9 胃大弯处神经鞘瘤。肿块呈腔内外生长,腔内面可见溃疡面形成,肿块稍低均匀密度,增强扫描静脉期中度均匀强化,图9为冠状面MPR重建,可清楚显示肿块位置、生长方式及溃疡面。Figure 7~9. Gastric schwanomas in the greater curvature of stomach.The mass grows to both inside and outside,with an inner ulcer.It is of low density with moderate enhancement in venous phase.Figure 9:Coronary MPR reconstruction indicates the mass position,growth mode and the ulcerative surface.

图10 ~12 胃底部外生型神经鞘瘤。可见胃底部与胃壁相连的肿块影,周围边界清楚,光整,肿块密度均匀,增强扫描动脉期轻度强化。图12:病理图片可见瘤细胞呈编织状、栅栏状纵横交错排列,细胞呈长梭性,胞浆红染,局部细胞排列较疏松,异型不明显。Figure 10~12. Exophytic gastric schwanomas in the fundus of the stomach.The mass linked with the fundus of the stomach wall was well defined and homogeneous in density,with mild enhancement in arterial phase.Figure 12:Pathology showed tumor cells were woven palisade shape,and crisscrossly arranged.The cells were long spindle-like.Cytoplasm red.Local cells arranged loosely.Atypia was not apparent.
大体病理与CT所见大小相似,大体切面呈灰白色,质地韧。电镜下瘤细胞呈编织状、栅栏状纵横交错排列,大部分区域细胞排列较紧密,细胞长梭形,胞浆红染,核梭形,大小形态较一致,局部细胞排列较疏松,细胞胞浆较透亮或呈空泡样,核较小,圆形或小梭形,细胞异型不明显,部分区域有淋巴细胞浸润。免疫组化:瘤细胞CD117(-)、CD34(-)、Actin(-)、Desmin(-)、Vim(+)、S-100(+)、Ki-67(+,3%)。
3 讨论
神经鞘瘤极少发生于胃肠道,而胃部是胃肠道神经鞘瘤最好发的部位,神经鞘瘤在外周部位的影像学特征主要表现为边界清楚的肿块,常伴有中心低密度囊变、坏死区,增强扫描常呈不均匀明显强化。但是发生于胃肠道时,其影像学表现与其他部位的神经鞘瘤不同,表现为均匀密度影,呈等、低密度,很少有出血、坏死及囊变,CT表现以胃部黏膜下肿块为主,部分呈胃腔内外生长,常与胃部间质瘤影像表现重叠。国内对该肿瘤影像学表现描述较少,临床医生对其认识不足,因此回顾性分析我院近年来的胃神经鞘瘤的影像学资料,总结其影像学特征。
3.1 胃神经鞘瘤的临床及病理特点
神经鞘瘤是发生于神经鞘膜细胞的良性肿瘤,是最常见的外周神经良性肿瘤之一,其主要起源于神经鞘的雪旺氏细胞,并包绕外周神经生长,主要发生于头颅、颈部和周围神经处,但亦可发生于全身的各个部位,神经鞘瘤发生于腹部比较少见,腹膜后神经鞘瘤的发生率约为0.5%~1.2%[3],而其发生于胃肠道则更少见,约占胃肠道间叶肿瘤的3.3%~12.8%。在以前,胃神经鞘瘤包括在胃间质瘤中,但是,目前对于胃肠道间质瘤的组织起源,主要认为是起源于多能干细胞或Cajal间质细胞,而不包括雪旺氏细胞分化的胃肠道肿瘤[4]。胃间质瘤可能具有恶性或恶性倾向,而神经鞘瘤具有良性的生物学行为,其很少恶变或转移。胃间叶肿瘤可分为胃间质瘤、平滑肌瘤、平滑肌肉瘤和神经鞘瘤[5]。胃神经鞘瘤多为良性,男性较女性多发,40岁以上多发,良恶性在发病年龄上无明显差异,本组病例与文献报道一致。胃神经鞘瘤生长缓慢,一般病史较长,常表现为上腹部不适,偶尔伴返酸、嗳气,肿瘤表面黏膜糜烂、溃疡可以引起消化道出血,黑便者并不少见,症状、体征特异性不明显,本组有3例出现黑便。单从病史症状体征很难与胃平滑肌瘤、胃间质瘤、胃癌相鉴别。本组病例胃神经鞘瘤的临床特点:①发病年龄平均48岁,病程长;②多有上腹部不适、疼痛、反酸、呕吐等,3例有黑便。
病理上胃神经鞘瘤在显微镜下主要见梭形或类梭形细胞,有文献报道,区别梭形细胞的方法主要是免疫组织化学染色,肌线蛋白和肌动蛋白阳性可提示平滑肌瘤和平滑肌肉瘤,CD34和CD117阳性可提示胃间质瘤,S-100阳性可提示神经鞘瘤,而本组病例肿瘤的梭形细胞均显示出S-100染色阳性,因此提示其神经鞘瘤的诊断。
3.2 影像学检查
3.2.1 胃部气钡双重造影表现
胃神经鞘瘤在消化道钡餐检查中,与其他突向胃腔内肿块相似,均表现为黏膜下肿瘤的特点,呈充盈缺损状,但胃腔黏膜面很少见破坏,当肿瘤表面黏膜坏死、破溃时可形成溃疡面,表现为钡斑或龛影。部分突向浆膜外的肿瘤则较难鉴别,可呈胃部的受压表现,胃部钡餐造影检查难以显示肿瘤的全貌,胃部钡餐造影对胃神经鞘瘤的诊断价值不高。因此可通过CT检查,来观察显示肿瘤的位置、大小、生长方式、形态和内部结构特征,还能对肿瘤血供及其良恶性做出初步的判断。
3.2.2 CT表现及其诊断价值
胃神经鞘瘤在CT上可见与胃壁关系密切,向腔内、腔外或跨腔内外肿块,一般呈圆形、类圆形或分叶状肿块,与周围组织境界多较清楚,肿块大小不一,但常呈较小肿块影,多<3cm,本组病例中7例为肿瘤均<3cm,3例体积较大,最大者约88mm×77mm。胃神经鞘瘤常呈较均匀的等或稍低密度,很少出现出血、囊变及坏死区,本组8例肿瘤病理下未见明显坏死区,2例可见灶状坏死灶,但对照CT未见明显坏死低密度区。本组10例中,9例呈等或稍低密度,1例呈稍不均匀等、稍低密度肿块,但未见明确出血、囊变及坏死区,与文献报道一致。增强扫描肿瘤动脉期可不强化,静脉期进一步呈中度强化或动脉期轻度强化,静脉期进一步强化,强化均匀。本组中仅1例强化略不均匀,余均均匀强化,强化程度中度,提示胃神经鞘瘤为富含血供的肿瘤。胃神经鞘瘤为良性肿瘤,很少发生邻近侵润及远处淋巴结的转移,本组10例均未有此恶性肿瘤征象。因此CT检查对胃神经鞘瘤具有以下重要的诊断价值:①CT检查可清楚显示肿瘤与胃壁的关系,显示肿瘤的生长方式;②CT检查可显示肿瘤大小、形态、范围、边缘情况及对周围器官挤压;③CT检查可显示肿瘤的内部密度情况、肿瘤的血供及强化特征;④判断肿瘤是否邻近侵犯或远处淋巴结的转移,有利于指导临床制定治疗方和对预后的评价。
3.2.3 PEI/CT表现
PET/CT因其能显示肿瘤组织的功能而广泛应用于临床肿瘤良恶性的诊断。恶性胃神经鞘瘤的发生率占胃神经鞘瘤的10%~15%,而出现转移但病理诊断为良性神经鞘瘤约为2.7%[6]。有文献[7]报道术前对良性神经鞘瘤的评估,22例组织学显示良性的神经鞘瘤的FDG-PET SUV值范围为0.33~3.7,其中36.4%的良性神经鞘瘤的SUV值被评价为恶性 (假阳性),Komatsu等[8]报道过1例良性胃神经鞘瘤的SUV值高达5.8,但是高的FDG-PET SUV值不能很好的区别良恶性的神经鞘瘤,因为神经鞘瘤常显示为不同FDG摄取水平,良性的常可显示出同恶性神经鞘瘤相同的高SUV值,因此运用FDG-PET/CT影像方法鉴别恶性潜能的神经鞘瘤还是很困难。
3.3 鉴别诊断
胃神经鞘瘤的鉴别诊断主要包括起源于胃壁的一些肿瘤病变:①胃间质瘤是最常见的起源于胃的间叶肿瘤,常较大,生长方式与胃神经鞘瘤相似,但其常出血、坏死和囊变,呈不均匀的密度,强化呈不均匀的强化,可兹鉴别,但8%~13%的胃间质瘤在CT上常显示出均匀密度和强化,因此胃神经鞘瘤与一些体积较小的胃间质瘤难以鉴别。②胃平滑肌瘤是胃部较常见的良性肿瘤,体积一般不大,<5 cm,密度常呈等密度,常均匀强化,与胃神经鞘瘤较难鉴别。③胃肿块型癌可形成肿块突向胃腔或突出胃壁外,但其常伴有不规则的溃疡表面,肿瘤范围较广,边缘常呈现出浸润的征象,钡餐造影常可见胃黏膜破坏,胃壁僵硬,CT可见邻近或远处淋巴结、肝脏转移等恶性肿瘤征象。
总的来说,胃神经鞘瘤常显示为胃黏膜下肿瘤,部分可呈腔内外生长,边界清楚,圆形或类圆形,密度均匀,坏死、囊变少见,强化呈轻-中度均匀强化。
[1]Daimaru Y,Kido H,Hashimoto H,et al.Benign schwannoma of the gastrointestinal tract:a clinicopathologic and immunohistochemical study[J].Hum Pathol,1988,19(2):57-64.
[2]Genova G,Maiorana AM,Agnella G,et al.Gastric schwannoma after Nissen fundoplication.A rare complication?[J].Am Surg, 1989,55(8):495.
[3]Maeshima S,Nakamura H,Nishikawa M,et al.Retroperitoneal schwannomas simulating adrenal tumors[J].Clin Imaging,1992, 16(12):1-4.
[4]Miettinen M,Lasota J.Gastrointestinal stromal tumors—definition, clinical,histological,immunohistochemical,and molecular genetic features and differential diagnosis[J].Virchows Arch,2001,43(8): 1-12.
[5]Lin CS,Hsu HS,Tsai CH,et al.Gastric schwannoma[J].J Chin Med Assoc,2004,67(5):83-86.
[6]Ohmine Y,Miyagi J,Nagayoshi S,et al.Two cases of malignant schwannoma of the stomach[J].J Jpn Surg Assoc,1996,57(2): 708-712.
[7]Ahmed AR,Watanabe H,Aoki J,et al.Schwannoma of the extremities:the role of PET in preoperative planning[J].Eur J Nucl Med,2001,28(15):41-51.
[8]Komatsu D,KoideN,HiragaR,etal.Gastricschwannoma exhibiting increased fluorodeoxy-glucose uptake[J].Gastric Cancer, 2009,12(22):5-8.
