硬脂酰-辅酶A脱氢酶基因在食品级乳酸菌中的表达
2012-02-09王腊梅李世丽苟克勉罗玉柱
王腊梅,李世丽,苟克勉,罗玉柱
1 甘肃农业大学动物科学技术学院,甘肃 兰州 730070
2 中国农业大学生物学院 农业生物技术国家重点实验室,北京 100193
硬脂酰-辅酶A脱氢酶 (Stearoyl-coenzyme A desaturase,SCD) 属于∆-9脱氢酶,位于内质网上,是一种膜结合蛋白。SCD是脂肪代谢过程中的关键酶,它催化饱和脂肪酰基辅酶A在Δ-9顺式位置上脱氢,生成单不饱和脂肪酸,是脂肪酸脱氢反应的限速酶之一[1]。最早分离纯化的SCD来自大鼠的肝[2]。此后,高山被孢霉M. alpine、酿酒酵母S. cervisiase、嗜热四膜虫Tetrahymena thermophila和荚膜组织胞浆菌 Histoplasma capsulatum 中也已分离得到了∆-9脱氢酶[3-5]。SCD的主要功能是催化硬脂酰 CoA和软脂酰CoA形成油酰CoA和棕榈油酰CoA,生成的油酰CoA和棕榈油酰CoA是细胞内合成甘油三酯、磷脂质和胆甾醇酯的主要来源。scd的表达还涉及对细胞增殖、细胞程序凋亡、衰老和脂质调解的细胞毒作用[6],同时,SCD也可影响膜流动性和SCD1的缺失导致身体脂肪的减少,增加胰岛素的敏感性和抑制由饮食引起的肥胖[7-9]。提高scd1在骨骼肌的表达可引起脂质的不正常代谢和肥胖的加速[10]。SCD1缺失的小鼠在饮食中提供鱼油可以防止动脉粥样硬化的加速[11]。目前,scd1基因在动物模型实验中,主要研究 scd1基因在脂质生成、肥胖和胰岛素耐受性中的作用。scd基因敲除小鼠不易肥胖并且对胰岛素有耐受性,以及脂质氧化的增加[6]。另外,在反刍动物瘤胃或乳腺组织中SCD可以通过其∆-9脱氢酶的作用,将反式十八碳一烯酸(t11-C18∶1)转化为c9,t11共轭亚油酸 (c9,t11-CLA)[12-13]。大鼠的scd1基因成功地在羊的乳腺细胞中得到表达[14];人的scd1基因转入人胚肾293细胞过量表达把油酸转化成c9t11-CLA[15]。
乳酸菌 (Lactic acid bacteria,LAB) 是一类在食品中应用最广泛的重要工业菌株。它包括乳酸球菌、乳酸杆菌、双歧杆菌等十几个属。这类菌种在防治食物腐败、提高免疫力以及改善风味等方面有重要作用。目前,乳酸菌食品级高效表达系统的构建及应用则是该领域研究的前沿和热点。食品级表达系统要求宿主菌、选择标记基因和诱导物均为食品级,这为异源基因表达产物的直接应用提供了基础[16]。在这些食品级的表达系统中乳链菌肽控制表达系统 (The nisin controlled expression,NICE) 是应用最广泛的。该系统是可控制蛋白质生产的最理想的系统,同时具有良好的安全性,故可用于目的蛋白在乳酸菌中的高效表达。控制目的代谢物的生产,其工程菌及表达产物可直接制成口服制剂,可直接应用于食品、医药和保健品等领域[17]。
本文主要研究把 scd1基因转入食品级的乳酸乳球菌表达系统,利用NICE控制scd1基因表达产生单不饱和脂肪,脂类中饱和脂肪酸与单不饱和脂肪酸的比例又往往影响着脂蛋白代谢、生物膜的流动性和信号传导等,同时还与糖尿病、动脉粥样硬化、癌症、肥胖症等多种疾病相关,因此,这些工程菌可直接用于食品工业,这对人类健康非常有益。
1 材料与方法
1.1 材料
Taq DNA聚合酶、dNTPs、Tris饱和酚、DNA限制性内切酶NcoⅠ和XbaⅠ及DNA标准分子量及预染蛋白标准分子量均购自宝生物工程(大连) 有限公司;普通琼脂糖凝胶DNA回收试剂盒购自天根生化科技有限公司;M17培养基购自青岛海博生物技术有限公司;引物合成和DNA测序分别由Invitrogen公司和北京六合华大基因科技股份有限公司完成;SDS、β-巯基乙醇、溶菌酶、考马斯亮蓝 G250、三氟化硼/甲醇(BF3/MeOH) 试剂和脂肪酸分析所用标准品Polyunsaturated Fatty Acid Mix No.2 购自Sigma/Aldrich公司。其余试剂均为国产分析纯。
1.2 质粒、菌种和生长条件
含有人scd1的cDNA质粒pCAGGS-scd1由本实验室保存。克隆和表达载体pNZ8149,基因克隆和表达宿主乳酸乳球菌NZ3900均购自北京拜尔迪生物技术有限公司,NZ3900是营养缺陷型菌株。食品级克隆和表达载体pNZ8149由Pnis启动子控制表达,载体携带recC和recA复制子和原核生物表达所需的SD序列,以及食品级选择标记基因lacF。
NZ3900培养在补加0.5%葡萄糖的M17培养基中,菌株在30 ℃、5% CO2的恒温培养箱静置培养。Elliker包含0.5%的乳糖、0.004%溴甲酚紫溶液用作乳糖利用表型 (lacF) 指示培养基[18],培养基中诱导表达剂 Nisin的浓度为50 mg/L。
1.3 PCR扩增目的基因
根据人 scd1基因的 cDNA序列 (GenBank Accession No. BC062303) 和表达载体pNZ8149的序列分析,用primer premier 5.0 设计SCD-F和SCD-R引物 (表1),向上游引物SCD-F引入NcoⅠ酶切位点,向下游引物SCD-R引入XbaⅠ酶切位点,分别用下划线标出;SCD-F1和SCD-R1引物是在目的基因 scd1内部设计;pNZ8149-F和pNZ8149-R为菌落PCR的引物;pNZ8149-F1和pNZ8149-R1为测序引物。
酚-氯仿常规方法[19]提取质粒pCAGGS-scd1,并以其为模板进行PCR 扩增。PCR条件为:94 ℃4 min;94 ℃ 1 min ,55 ℃ 1 min,72 ℃ 90 s,30个循环;72 ℃ 10 min。PCR产物用1%的琼脂糖凝胶电泳鉴定后进行回收和纯化。
1.4 乳酸乳球菌表达载体的电击转化
pNZ8149用电击转化NZ3900,电击条件:2.0 kV、25 μF、200 Ω,使用2 mm的电转杯,电击时间是4.4 ms。用选择培养基Elliker和菌落PCR选择阳性菌落。提取阳性转化子质粒,测序鉴定。
1.5 质粒DNA从乳酸乳球菌的分离
采用修改的碱变性法提取乳酸乳球菌的质粒pNZ8149。方法如下:5 mL培养菌液;12 000 r/min离心 2 min,收集菌液;菌液用250 μL THMS缓冲液 (30 mmol/L pH 8.0的Tris-HCl,3 mmol/L MgCl2,25%的蔗糖) 和2 g/L溶菌酶重悬,在37 ℃下孵育10 min;加500 μL0.2 mol/L NaOH 和 1%十二烷基硫酸钠 (SDS)在冰上孵育5 min;加375 μL冰预冷pH 5.5的3 mol/L的乙酸钾后冰上孵育5 min;离心5 min,吸取上层到新的离心管,离心管加满异丙醇,在室温孵育5~10 min;离心10 min,用70%乙醇洗DNA;离心2 min;弃上清,室温下干燥DNA,加50 μL的超纯水溶解DNA。
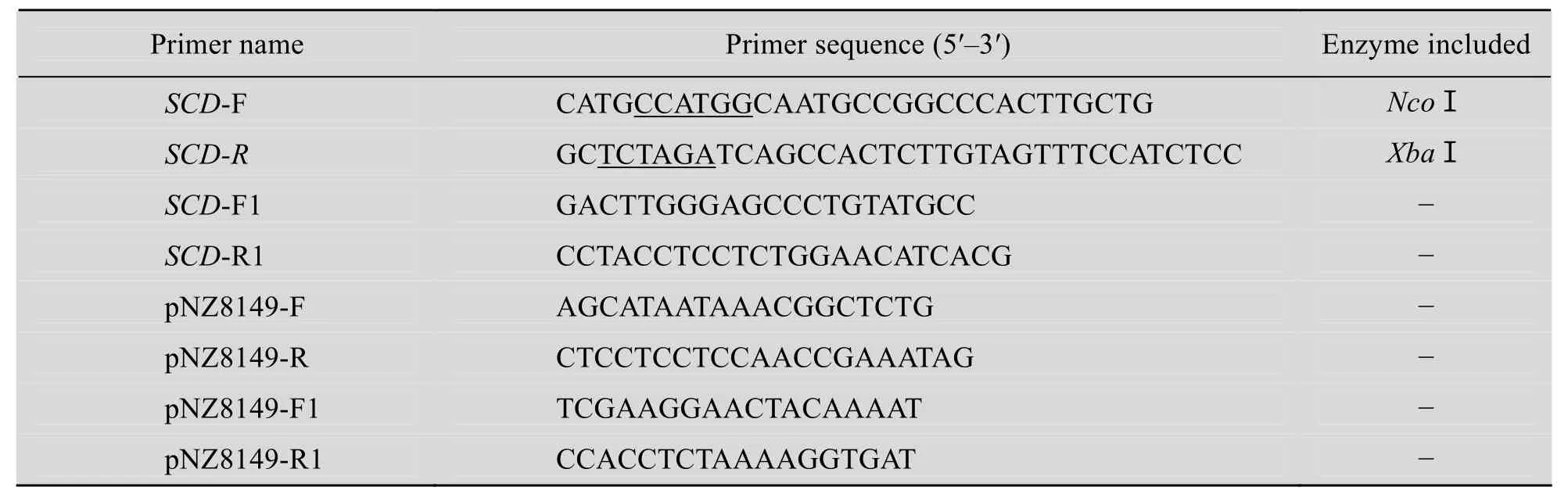
表1 本研究中使用的引物Table 1 Primers used in this study
1.6 乳酸乳球菌的转化
回收PCR产物,用NcoⅠ和XbaⅠ对回收的PCR产物和质粒pNZ8149 分别进行双酶切。凝胶电泳,用普通琼脂糖凝胶DNA回收试剂盒 (天根生化科技有限公司) 回收目的片段。酶切后的目的片段和乳酸乳球菌表达质粒 pNZ8149用快速连接试剂盒 (宝生物工程 (大连) 有限公司) 16 ℃连接1 h,构建重组质粒pNZ8149-scd1。
连接液先用乙醇沉淀纯化之后再做转化,纯化的连接液1 μL (浓度大约100 ng/μL) 电击转化乳酸乳球菌NZ3900感受态,电击用以下条件:2 000 V、25 μF、200 Ω和2 mm的电转杯,电击时间是4.4 ms。电击的转化液涂布在以溴甲酚紫为指示剂、0.5%的乳糖为唯一碳源的 Elliker培养基上,30 ℃静置厌氧培养。一般培养1~2 d。载体pNZ8149携带lacF,表达宿主NZ3900缺少lacF,互补筛选阳性菌落。选择培养基Elliker上出现黄色菌落为阳性菌。用相同的方法转化空载体作为对照。
1.7 阳性转化子的PCR鉴定
选择阳性转化子进行菌落 PCR鉴定。菌落PCR模板的制备,采用如下方法:取200 μL过夜培养的菌液,12 000 r/min离心2 min;弃上清,加50 μL盐酸胍,沸水浴15 min;离心弃上清,用100 μL超纯水洗2遍;加10 μL双蒸水溶解,取 2 μL菌液为菌落 PCR的模板。选用载体pNZ8149通用引物进行PCR扩增。
PCR条件是:95 ℃ 10 min ;95 ℃ 30 s,58 ℃30 s,72 ℃ 2 min ,35个循环;72 ℃ 10 min。菌落PCR鉴定后的阳性转化子,进一步用NcoⅠ和XbaⅠ双酶切鉴定构建的重组质粒。鉴定后的阳性质粒由北京六合华大基因科技股份有限公司测序。
1.8 重组质粒pNZ8149-scd1在乳酸乳球菌中的诱导表达
选取 PCR鉴定正确的乳酸乳球菌重组子单菌落接种到5 mL M17液体培养基中,添加0.5%的乳糖。30 ℃、5% CO2的恒温培养箱静置培养过夜,接种1 mL培养液到10 mL相同的培养液。当OD600=0.4~0.5;10 mL的培养液添加50 ng/mL的诱导剂Nisin,诱导重组体乳酸乳球菌的表达。同时,0.5 mg/mL的反式十八碳烯酸(t11-C18∶1,Sigma V1 131)、0.1 mg/mL的Fe2+和Fe3+分别添加到10 mL培养液中,孵化48 h。菌体离心收集在20 mL的甲酯化玻璃管,抽提脂肪酸进行气相色谱分析。
1.9 SDS-PAGE检测硬脂酰Co-A脱氢酶的表达情况
取重组菌新鲜单克隆,分别接种于5 mL含0.5%乳糖的M17培养基,30 ℃静置培养过夜。同时做 pNZ8149载体对照,方法同重组菌;过夜培养物5 mL,12 000 r/min室温离心2 min,弃上清,沉淀用500 μL TES裂解液 (pH 8.0的1 mol/L Tris-HCl,1mL;pH 8.0的 0.5 mol/L EDTA,0.2 mL;蔗糖25 g;加超纯水至100 mL)洗涤2次,然后用100 μL含有1.0 mg/mL溶菌酶的TES重悬菌体,加1 μL 0.2 mol/L 苯甲基磺酰氟 (PMSF),37 ℃水浴2 h。再加2×SDS-PAGE上样缓冲液 (pH 6.8的1 mol/L Tris-HCl 1 mL;10%甘油 2 mL;10% SDS 4 mL;1%溴酚蓝0.05 mL;2-β巯基乙醇1 mL;加超纯水至10 mL) 100 μL,沸水浴5 min,离心后取15 μL上清进行SDS-PAGE。
1.10 脂肪酸分析确定目的片段的功能性表达
鉴定为阳性的乳酸乳球菌接种于5 mL M17的液体培养基,添加0.5%的乳糖。30 ℃、5% CO2的恒温培养箱静置过夜培养,接种1 mL培养液到10 mL的新鲜培养液。当OD600=0.4~0.5时,10 mL的培养液添加50 ng/mL的诱导剂Nisin,0.5 mg/mL的t11-C18∶1,0.1 mg/mL的Fe2+和Fe3+分别添加入10 mL培养液中,孵化48 h。菌液离心收集在20 mL的甲酯化玻璃管,脂肪酸抽提方法如下:孵化24 h的菌液离心,6 000 r/min离心5 min;弃上清,加200 μL的菌液重悬,移入20 mL甲酯化玻璃管;加1 mL的正己烷和1 mL的BF3到甲酯化玻璃管;甲酯化玻璃管吹1 min的N2;之后,涡旋振荡30 s;沸水浴1 h;加1 mL的双蒸水在沸水浴的甲酯化玻璃管;3 000 r/min离心1 min;取上清到1 mL的玻璃管,用N2吹干,加500 μL的正己烷。用全自动HP6 890气相色谱仪定量脂肪酸甲酯。测量的结果可用气相色谱的ChemStation软件 (Agilent Technologies)分析。
1.11 重组菌生长曲线的测定和pH值的变化
挑取空载pNZ8149菌株和3株阳性菌株平板上的单菌落,用2 mL补加0.5%乳糖的M17液体培养基,30 ℃、5% CO2的恒温培养箱静置培养12 h。之后,每株菌吸取1 mL菌液在20 mL M17培养液中,平均分配培养液到2个新的培养管,每株菌做2个重复,10 mL的培养液添加50 ng/mL的诱导剂Nisin。于培养后的第0、3、6、10、12、15 h,分别用无菌培养管从各管中吸取培养液2 mL,以1 cm比色皿比浊,以空载为参比,在 OD600下分别测定其吸光度 A值。同时,用Sartorius PB-10 pH湿度计测量发酵液pH值。
1.12 统计分析
实验重复了4次,测量的数据用统计分析软件SAS (1999)。平均数通过MEANS语句列出,分析结果± s表示。
2 结果
2.1 硬脂酰-辅酶 A 脱氢酶的克隆和载体pNZ8149-scd1的构建
从pCAGGS-scd1质粒PCR扩增得到1 100 bp的scd1基因片段,用NcoⅠ和XbaⅠ内切酶导入空载体 pNZ8149,构建成重组表达质粒pNZ8149-scd1,转化乳酸乳球菌NZ3900后的阳性重组质粒如图1所示,菌落PCR表明该重组质粒插入了1 100 bp的目标基因 (图2),NcoⅠ和XbaⅠ双酶切获得2 515 bp和1 095 bp的条带(图 3),测序证明目的基因读码正确。上述鉴定都表明重组质粒 pNZ8149-scd1成功地转入乳酸乳球菌NZ3900。

图1 质粒pNZ8149-scd1的琼脂糖凝胶电泳检测Fig. 1 Agarose gel electrophoresis of the pNZ8149-scd1 gene. 1: plasmid pNZ8149-scd1; 2: plasmid pNZ8149; M: DNA marker DL5 000.
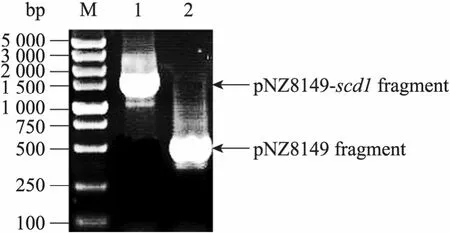
图2 菌落PCR法鉴定重组表达质粒结果Fig. 2 Direct PCR of bacterial colonies for identification of recombinant expression plasmids. 1: PCR product of pNZ8149-scd1; 2: PCR product of pNZ8149; M: DNA marker DL5 000.
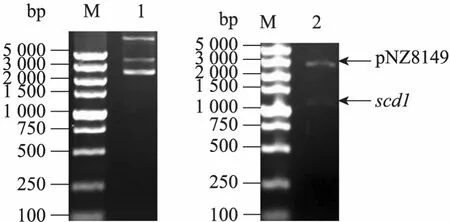
图3 质粒pNZ8149-scd1酶切的琼脂糖凝胶电泳Fig. 3 Agarose gel electrophoresis of the pNZ8149-scd1 digested with restriction enzymes. M: DNA marker DL5 000; 1: plasmid pNZ8149-scd1; 2: pNZ8149-scd1 digested with Nco I and Xba I.
2.2 SDS-PAGE分析硬脂酰CoA脱氢酶的表达
重组菌经Nisin诱导,则可高效表达SCD1,该重组菌全蛋白提取物经 10% SDS-PAGE,考马斯亮蓝染色后观察到外源蛋白的表达,其表观分子量约为37 kDa,与报道的SCD1表观分子量结果一致。重组菌 pNZ8149-scd1和空载体pNZ8149的SDS-PAGE结果如图4所示,空载体在 37 kDa位置未见明显条带,而重组菌pNZ8149-scd1在37 kDa有明显的条带,说明硬脂酰CoA脱氢酶在重组菌中表达成功。
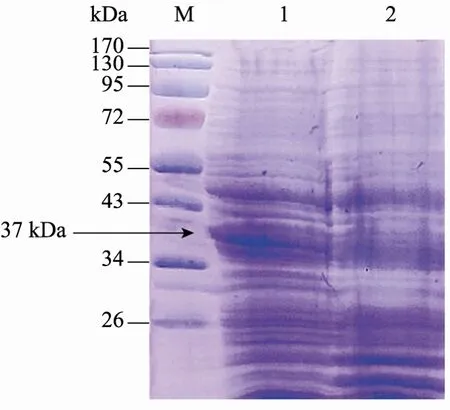
图4 硬脂酰CoA脱氢酶的SDS-PAGE分析Fig. 4 SDS-PAGE analysis of stearoyl-CoA desaturase-1. M: protein marker; 1: pNZ8149-scd1/NZ3900; 2: pNZ8149/NZ3900.
2.3 硬脂酰-辅酶A脱氢酶的诱导表达和脂肪酸分析
将重组质粒 pNZ8149-scd1转化至乳酸菌NZ3900,经50 mg/L Nisin诱导表达,同时添加0.5 g/L的t11-C18∶1、0.1 g/L的Fe2+和Fe3+分别添加到10 mL培养液中,孵化48 h。获得的乳酸菌抽提脂肪酸,分析乳酸菌的脂肪酸组分。随机选择了A~C三株scd1转化菌,检验scd1基因表达是否可以提高单不饱和脂肪酸的含量。转化株产生的脂肪酸用气相色谱分析 (图4)。
结果表明 scd1转化株的棕榈油酸(C16∶1n-7) 和十八碳烯酸 (C18∶1n-7) 的含量提高了92%~169%和53%~127%,显著地高于对照组 (P<0.05,表1),而c9,t11-CLA并没有变化。以上结果表明scd1在乳酸菌中成功表达。
2.4 重组菌的生长曲线和pH值测量
以培养时间为横坐标、600 nm处测定的OD值为纵坐标,绘制不同时间菌株浓度的生长曲线(图 5)。统计结果分析表明:随着时间的推移,对照组和重组菌培养15 h的生长速度和产酸能力相比无显著变化 (表2~3),这有利于重组菌应用于食品工业。培养15 h后,乳酸菌生长将要达到平台期,继续检测OD值和pH值差异无统计学意义。
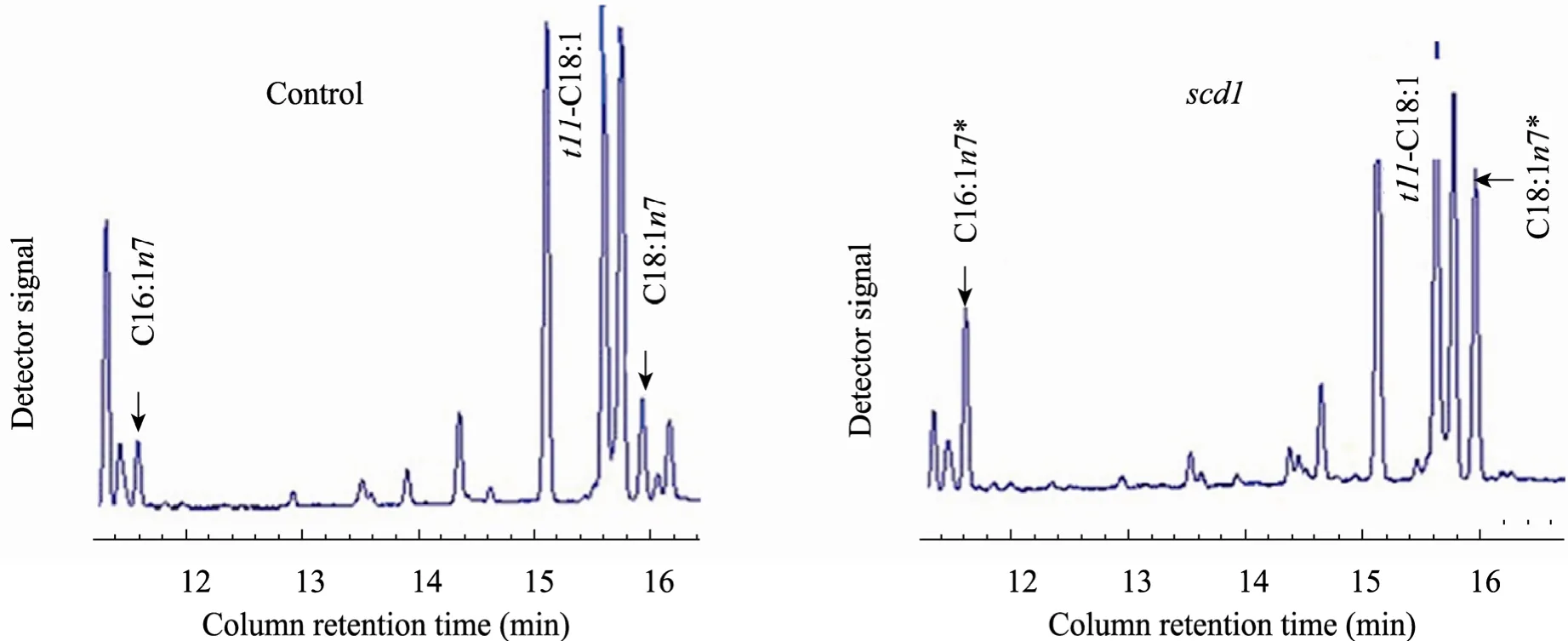
图5 对照组和scd1转化株抽提的总脂肪酸的部分气相色谱图 (*P<0.05)Fig. 5 Partial gas chromatogram traces showing fatty acid profiles of total lipids extracted from scd1-transformed and control. Both the control and scd1 line A are fed with 0.5 g/L t11-C18:1 for 48 h prior to fatty acid analysis. The lipid profiles show that the levels of palmitoleic acid (C16:1n-7), and cis-vaccenic acid (C18:1n-7) are markedly increased. (*P<0.05).

表1 对照组pNZ8149和转化株pNZ8149-scd1在乳酸乳球菌NZ3900表达的n-7脂肪酸Table 1 n-7 fatty acid composition in Lactococcus lactis NZ3900 transfected with pNZ8149 control and pNZ8149-scd1

图6 对照组和scd1转化株生长曲线图Fig. 6 Growth curve from scd1-transformed and control. NZ3900: the original strain; pNZ8149: load vector; 45, 55, 56: scd1-transformed.
3 讨论
脂肪酸的生物活性越来越引起人们的兴趣。高含量的单不饱和脂肪酸和癌细胞的转化是呈正相关的,与对照组相比棕榈油酸使 SCD缺失细胞对细胞凋亡更敏感[20]。SCD1的表达可以调控β-细胞、脂肪细胞、巨噬细胞、内皮细胞和肌细胞中炎症和应激反应。SCD1完全缺失可以导致肝脏功能的紊乱和炎症疾病[21]。但是,SCD1缺失的瘦素不足肥胖小鼠可以促进心脏的功能,人类胃癌的异种移植模型中 SCD抑制可以延迟肿瘤的生长[22-23],临床研究发现,n-3脂肪酸可以显著地影响scd1的mRNA在肝脏的表达和活性[24]。然而,SCD在食品级乳酸菌的表达尚未见报道。

表2 对照组pNZ8149和转化株pNZ8149-scd1的OD值分析Table 2 OD value analysis in pNZ8149 control and pNZ8149-scd1

表3 对照组pNZ8149和转化株pNZ8149-scd1的pH值分析Table 3 pH value analysis in pNZ8149 control and pNZ8149-scd1
本研究把 scd1基因转入食品级乳酸乳球菌得到阳性表达系,实验数据显示添加的底物t11-C18∶1并没有显著地转化为c9,t11-CLA。scd1的表达只引起了 n-7脂肪酸家族 (C16∶1n-7,C18∶1n-7) 的含量升高,C16∶1n-7和 C18∶1n-7脂肪酸的含量分别提高了92%~169%和53%~127%。这为调控scd1的合成和单不饱和脂肪酸在食品工业的利用提供了研究基础。
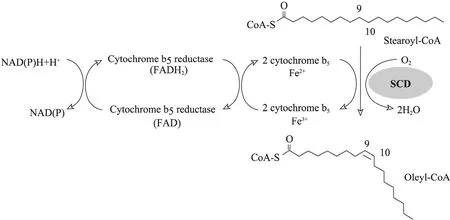
图7 SCD对脂肪酸去饱和的电子传递途径[6]Fig. 7 The pathway of electron transfer in the desaturation of fatty acids by stearoyl-CoA desaturase (SCD)[6].
SCD与所有的膜结合脂肪酸脱氢酶一样,是一种氧依赖型含铁的跨膜蛋白,结合乙酰辅酶A或甘油脂作为底物。该跨膜蛋白含有4次跨膜结构,并且有3个保守的组氨酸富集区,这3个组氨酸保守区与二价铁离子结合参与形成酶的活性中心。在哺乳动物体中,SCD反应是一个需氧过程,需要分子氧和铁离子的辅助作用,可以在长链脂肪酸△9,10位置引入一个双键。因此,单不饱和脂肪酸的合成是由饱和脂肪酸前体经过一个有氧反应,3个复合物组成的酶系统催化形成[25]。这个复合物酶系统包括依靠黄素蛋白-NADH的细胞色素 b5还原酶、细胞色素 b5和SCD (图6)。本实验在乳酸乳球菌的菌液中加了0.1 g/L的铁离子,而乳酸乳球菌NZ3900是革兰氏阳性菌,它的生长坏境是厌氧,这对酶的活性有一定的影响。另外,乳酸菌不生产酶反应所需的细胞色素b5,这些都可能导致酶的活性降低,影响t11-C18∶1转化为c9,t11-CLA。
本研究通过对 scd1进行原核表达,对重组体的脂肪酸组分进行了分析,表明 scd1基因在乳酸菌中成功表达。通过转基因技术,Reh等把大鼠的 scd基因整合到奶山羊基因组中并在乳腺中进行表达,产生的转基因山羊与对照组山羊乳脂肪酸组成相比,饱和脂肪酸含量降低,不饱和脂肪酸含量增加,c9,t11-CLA的含量在第7天时有显著差异,但这种作用在泌乳第30天开始削弱[14]。Wu等把人的scd1基因转到人肾胚 293细胞,得到稳定表达的细胞系,CLA含量显著提升,底物 t11-C18∶1的转化率达到16.49%~20.06%[15]。另外,乳酸乳球菌转化株表达人的scd1基因,SCD作为内质网膜上的不饱和酶系统,它不会扰乱其他内源性多不饱和脂肪酸的正常代谢。与对照相比包括n-6和n-3系列与n-6/n-3的比值都不会改变。虽然scd1在人体的表达可能和家族的高血脂和人类的代谢病相关联[26-27],但是,目前研究 scd1在乳酸乳球菌中的表达并没有危害效应。
SCD1是脂肪生成的关键酶,它可以催化单不饱和脂肪酸的生成,主要是 C18∶1n-9和C16∶1n-7。因此,C18∶1n-9和C16∶1n-7增加2个碳原子分别延长n-9和n-7系列的长链脂肪酸。在最近的研究中,我们发现scd1的表达仅仅能够显著增加 n-7系列的脂肪酸,比如C16∶1n-7和 C18∶1n-7。相反的,在本实验中预期的n-9产物,比如C18∶1n-9没有增加。相应地,scd1菌株与对照组相比较n-7系列的产物显著地增加。这样的变化是SCD1的Δ-9脱氢酶功能所不能解释的。C18∶1n-7的含量增加极有可能是由于C16∶1n-7脂肪酸含量升高后,体内的延长酶通过在碳链末端加入二碳原子单位引起的。已经有许多研究证实t10,c12-CLA能够强烈抑制 SCD酶的活性[28-31],但具体的机制并不清楚。添加CLA的人肝癌细胞 (HepG2) 中棕榈酸的合成不受影响,但油酸的合成显著下降[32]。由此我们猜想在scd1菌株里可能是CLA抑制了C18∶1 n-9脂肪酸的合成。
乳酸乳球菌能在人小肠中短暂生活,对人体有益无害的食品级微生物。本实验应用pNZ8149/NZ3900表达系统以lacF基因为选择标记基因,利用以乳糖为唯一碳源的培养基进行筛选。受体菌、选择标记基因以及诱导物Nisin均为食品级,因此,乳酸乳球菌的食品级表达系统pNZ8149-scd1/NZ3900表达有活性的SCD1,提升不饱和脂肪酸的含量。油酸可以调节人体血浆中高、低密度脂蛋白胆固醇的浓度比例,防止心血管疾病的发生。而且,重组菌的生长速度和产酸能力与对照组相比没发生显著变化,未来我们进一步把重组菌用于动物实验,以期为功能性食品的研制和生产提供美好前景。
致谢:气相色谱分析由中国农科院饲料研究所范志影老师协助完成。
REFERENCES
[1] Sampath H, Ntambi JM. The role of stearoyl-CoA desaturase in obesity, insulin resistance, and inflammation. Ann NY Acad Sci, 2011, 1243(1): 47−53.
[2] Strittmatter P, Spatz L, Corcoran D, et al. Purification and properties of rat liver microsomal stearyl coenzyme A desaturase. Proc Natl Acad Sci USA, 1974, 71(11): 4565−4569.
[3] Tocher DR, Leaver MJ, Hodgson PA. Recent advances in the biochemistry and molecular biology of fatty acyl desaturases. Prog Lipid Res, 1998, 37(2/3): 73−117.
[4] Sakuradani E, Kobayashi M, Shimizu S. Δ9-fatty acid desaturase from arachidonic acid-producing fungus. Unique gene sequence and its heterologous expression in a fungus, Aspergillus. Eur J Biochem, 1999, 260(1): 208−216.
[5] Laoteng K, Anjard C, Rachadawong S, et al. Mucor rouxii Δ9-desaturase gene is transcriptionally regulated during cell growth and by low temperature. Mol Cell Biol Res Commun, 1999, 1(1): 36−43.
[6] Paton CM, Ntambi JM. Biochemical and physiological function of stearoyl-CoA desaturase. Am J Physiol Endocrinol Metab, 2009, 297(1): E28–E37.
[7] Cohen P, Miyazaki M, Socci ND, et al. Role for stearoyl-CoA desaturase-1 in leptin-mediated weight loss. Science, 2002, 297(5579): 240–243.
[8] Ntambi JM, Miyazaki M, Stoehr JP, et al. Loss of stearoyl-CoA desaturase-1 function protects mice against adiposity. Proc Natl Acad Sci USA, 2002, 99(17): 11482–11486.
[9] Dobrzyn P, Dobrzyn A, Miyazaki M, et al. Stearoyl-CoA desaturase 1 deficiency increases fatty acid oxidation by activating AMP-activated protein kinase in liver. Proc Natl Acad Sci USA, 2004, 101(17): 6409–6414.
[10] Hulver MW, Berggren JR, Carper MJ, et al. Elevated stearoyl-CoA desaturase-1 expression in skeletal muscle contributes to abnormal fatty acid partitioning in obese humans. Cell Metab, 2005, 2(4): 251−260.
[11] Brown JM, Chung S, Sawyer JK, et al. Combined therapy of dietary fish oil and Stearoyl-CoA desaturase 1inhibition prevents the metabolic syndrome and atherosclerosis. Arterioscler Thromb Vasc Biol, 2010, 30(1): 24−30.
[12] Palmquist DL, Lock AL, Shingfield KJ, et al. Biosynthesis of conjugated linoleic acid in ruminants and humans. Adv Food Nutr Res, 2005, 50: 179−217.
[13] Santora JE, Palmquist DL, Roehrig KL. Trans-vaccenic acid is desaturated to conjugated linoleic acid in mice. J Nutr, 2000, 130(2): 208−215.
[14] Reh WA, Maga EA, Collette NMB, et al. Hot topic: using a stearoyl-CoA desaturase transgene to alter milk fatty acid composition. J Dairy Sci, 2004, 87(10): 3510–3514.
[15] Wu ZF, Li DF, Gou KM. Overexpression of stearoyl-CoA desaturase-1 results in an increase of conjugated linoleic acid (CLA) and n-7 fatty acids in 293 cells. Biochem Biophys Res Commun, 2010, 398(3): 473−476.
[16] Wei WZ, Xiang H, Tan HR. Food-grade expression of human Cu/Zn-superoxide dismutase gene in Lactococcus lactis. Acta Microbiol Sin, 2003, 43(3): 347−353.卫文仲, 向华, 谭华荣. 人铜锌超氧化物歧化酶基因在乳酸乳球菌中的食品级表达. 微生物学报, 2003, 43(3): 347−353.
[17] Xu B, Cao YS, Chen Y, et al. Construction of NICE system food-grade vector prnb48 for Lactococcus lactis. Food Sci Technol, 2006(10): 22−26.徐波, 曹郁生, 陈燕, 等. 乳酸乳球菌NICE系统食品级载体 pRNB48的构建. 食品科技, 2006(10): 22−26.
[18] Molecular biotechnology GmbH. Vector-systems: NICE®Expression System for Lactococcus lactis [EB/OL]. [2012-02-20]. Molecular biotechnology website: http://www.mobitec.com/int/index.html.
[19] Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. 3rd ed. New York: Cold Spring Harbor Laboratory Press, 1989: 27−30.
[20] Scaglia N, Ariel Igal R. Stearoyl-CoA Desaturase is involved in the control of proliferation, Anchorageindependent growth, and survival in human transformed cells. J Biol Chem, 2005, 280(27): 25339−25349.
[21] Liu XQ, Strable MS, Ntambi JM. Stearoyl CoA desaturase 1: role in cellular inflammation and stress. Adv Nutr, 2011, 2: 15−22.
[22] Dobrzyn P, Dobrzyn A, Miyazaki M, et al. Loss of Stearoyl-CoA desaturase 1 rescues cardiac function in obese leptin-deficient mice. J Lipid Res, 2010, 51(8): 2202−2210.
[23] Roongta UV, Pabalan JG, Wang XY, et al. Cancer cell dependence on unsaturated fatty acids implicates Stearoyl-CoA desaturase as a target for cancer therapy. Mol Cancer Res, 2011, 9(11): 1551−1561.
[24] Hofacer R, Magrisso IJ, Jandacek R, et al. Omega-3 fatty acid deficiency increases Stearoyl-CoA desaturase expression and activity indices in rat liver: positive association with non-fasting plasma triglyceride levels. Prostag Leukot Essent Fatty Acids, 2012, 86(1/2): 71−77.
[25] Heinemann FS, Ozols J. Stearoyl-CoA desaturase, a short-lived protein of endoplasmic reticulum with multiple control mechanisms. Prostag Leukot Essent Fatty Acids, 2003, 68(2): 123−133.
[26] Mar-Heyming R, Miyazaki M, Weissglas-Volkov D, et al. Association of stearoyl-CoA desaturase 1 activity with familial combined hyperlipidemia. Arterioscler Thromb Vasc Biol, 2008, 28(6): 1193–1199.
[27] Popeijus HE, Saris WHM, Mensink RP. Role of stearoyl-CoA desaturases in obesity and the metabolic syndrome. Int J Obes, 2008, 32(7): 1076−1082.
[28] Park Y, Storkson JM, Ntambi JM, et al. Inhibition of hepatic stearoyl-CoA desaturase activity by trans-10, cis-12 conjugated linoleic acid and its derivatives. Biochim Biophys Acta, 2000, 1486(2-3): 285−292.
[29] Gervais R, McFadden JW, Lengi AJ, et al. Effects of intravenous infusion of trans-10, cis-12 18:2 on mammary lipid metabolism in lactating dairy cows. J Dairy Sci, 2009, 92(10): 5167−5177.
[30] Lin XB, Loor JJ, Herbein JH. Trans10, cis12-18: 2 is a more potent inhibitor of de novo fatty acid synthesis and desaturation than cis9, trans11-18: 2 in the mammary gland of lactating mice. J Nutr, 2004, 134(6): 1362−1368.
[31] Smith SB, Kawachi H, Choi CB, et al. Cellular regulation of bovine intramuscular adipose tissue development and composition. J Anim Sci, 2009, 87(14): E72−E82.
[32] Yee JK, Mao CS, Hummel HS, et al. Compartmentalization of stearoyl-coenzyme A desaturase 1 activity in HepG2 cells. J Lipid Res, 2008, 49(10): 2124–2134.
