利用核糖体工程选育丙酮丁醇菌提高丁醇产量
2012-02-09陈丽杰商光来袁文杰吴又多白凤武
陈丽杰,商光来,袁文杰,吴又多,白凤武
大连理工大学生命科学与技术学院,辽宁 大连 116024
丁醇作为一种新型的生物燃料,具有其独特的性质:能量密度高、腐蚀性低、挥发性低[1],与汽油的性质相似,可直接用于现有的发动机系统,已受到世界各国的广泛关注。目前丁醇发酵中,丁醇的产量相对较低,这加大了后续分离成本,降低了其经济实用性,因此提高丁醇产量是提高丁醇产业经济性的手段之一[2]。微生物发酵产业中,微生物菌种起着至关重要的作用。性状优良的高产菌株可以减少发酵和产物分离成本,提高经济效益,具有良好的科学研究价值和市场潜力[3],因此获得一株高产丁醇菌株成为提高丁醇产量的前提。丁醇本身对发酵菌株C. acetobutylicum 具有很大的毒性。当丁醇浓度达到10~11 g/L时,菌体生长受到强烈抑制,并大量死亡[4],从而限制更高浓度丁醇的生成,因此菌体对丁醇的耐受性低也是制约丁醇产量提高的重要因素[5]。
核糖体是微生物进行蛋白质合成的重要细胞器,与胞内代谢活动、基本生理过程密切相关。核糖体发生突变将严重影响胞内物质的代谢[6]。核糖体工程技术是近几年发展起来的微生物育种方法。通过向微生物核糖体组分 (核糖体蛋白和 rRNA) 引入点突变,调控代谢系统,诱导或刺激代谢产物的表达,获得代谢产物合成能力提高的突变菌株[7-8]。通常使用链霉素、氯霉素、庆大霉素、卡那霉素等抗生素诱变微生物,使其核糖体发生突变。核糖体工程技术具有较好的诱变效果,目前主要用于提高微生物代谢物的产量及化学耐受程度等[6,9-10]。Kurosawa等[11]以枯草芽胞杆菌Bacillus subtilis 168为出发菌诱变获得链霉素突变株,其α-amylase和protease产量提高了 20%~30%。Hosokawa等[12]对恶臭假单胞菌Pseudomonas putida KH146-2进行链霉素、利福平和庆大霉素的抗性诱变,筛选得到的抗生素突变株对 4-羟基苯甲酸丁酯耐受程度由出发菌的0.8%提高到5%。
与其他的育种方法相比,核糖体工程简单易行,无需特殊设备,便于大批量的筛选。在所使用的抗生素中,链霉素诱变效果较好,正突变和增产率高,且其抗性突变在诱变育种中应用较多[10]。核糖体工程用于C. acetobutylicum的诱变筛选,以提高丁醇产量目前还没有报道。鉴于此,本文通过核糖体工程技术,使用链霉素诱变C. acetobutylicum L7,期望获得高产高耐丁醇菌株,解决丁醇产量低的实际问题,并为后续的研究工作奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种
本实验室驯化保存的丙酮丁醇梭菌Clostridium acetobutylicum L7。
1.1.2 培养基
活化培养基 (g/L):葡萄糖20,胰蛋白胨30,酵母粉10。
发酵培养基 (g/L):葡萄糖70,CH3COONH42.3,MgSO4·7H2O 0.2,K2HPO4·3H2O 0.5,KH2PO40.5,FeSO4·7H2O 0.01,MnSO4·H2O 0.01,酵母粉2,生物素0.01,对氨基苯甲酸0.01,pH 5.5。
平板培养基 (g/L):葡萄糖30,CH3COONH42.3,MgSO4·7H2O 0.2,K2HPO4·3H2O 0.5,FeSO4·7H2O 0.01,MnSO4·H2O 0.01,胰蛋白胨6,琼脂20,pH 6.2。
抗生素:配制浓度为20 g/L的链霉素母液,保存于−20 ℃。使用时按一定比例稀释。
所用培养基均在121 ℃高压蒸汽灭菌15 min。
1.2 方法
1.2.1 培养方法
菌种活化:将1 mL冷冻保藏的菌种接种于20 mL活化培养基中,37.5 ℃厌氧箱 (Forma 1029,Thermo Fisher Scientific) 中活化培养。
摇瓶培养:将活化好的菌种以10% (V/V)的接种量接种于110 mL发酵培养基中,37.5 ℃厌氧箱中静置培养。
发酵培养:1.2 L发酵培养基装入3 L发酵罐(1.5BG-4-3000,上海保兴生物公司) 中,通氮气30 min,保证罐内厌氧环境。将菌种以10% (V/V)的接种量接于发酵罐内,发酵温度37.5 ℃,转速150 r/min。
1.2.2 菌体浓度的测定
在620 nm测量菌体的吸光度作为菌体的浓度 (OD620),空白对照为离心后的发酵液。
1.2.3 链霉素最小抑菌浓度的确定
将处于对数生长期的菌液 (OD620≈1.0) 涂布于含有不同浓度 (0、2、4··10··50) mg/L的链霉素平板上,每个平板100 µL,相同链霉素浓度设置3个平行,37.5 ℃厌氧箱中培养2 d,观察菌落的生长情况,记录无菌落生长的最小链霉素浓度,即为链霉素对C. acetobutylicum L7的最小抑菌浓度[13]。
1.2.4 核糖体工程诱变筛选 C. acetobutylicum L7技术路线
使用链霉素对C. acetobutylicum L7进行核糖体工程诱变育种。将活化好的菌液涂布于含有4~5倍MIC的链霉素平板上,培养4~5 d。挑取直径较大或形态与原始菌有差异的菌落,96深孔板活化培养20 h,以10% (V/V)的接种量接于发酵培养基中培养72 h,气相色谱检测丁醇产量,比较得出产量提高较多的菌株 (以原始菌为对照)。再以其为出发菌,涂布获得单菌落,将其挑至链霉素平板上,此时浓度比前次筛选菌株时增加5 mg/L,挑取菌落进行发酵检测,重复以上步骤直到获得高产菌株。经过长时间大批量的诱变筛选,最终获得丁醇产量提高率在10%左右的菌株。以上操作均在37.5 ℃厌氧箱中进行。诱变筛选技术路线如图1所示。
1.2.5 氧化还原电位 (ORP) 和pH值的测定
分别采用氧化还原电极 (Pt4805-DPAS-SCK8S, Mettler Toledo) 和 pH电极 (405-60-T-S7/ 120/9848,Mettler Toledo) 测定。
1.2.6 糖浓度的测定
葡萄糖浓度使用SBA-40E生物传感分析仪(山东省科学院生物研究所) 测定。发酵液离心,取上清稀释至糖浓度小于1 g/L,取25 μL稀释液直接进样,读取数值,并计算发酵液的糖浓度。

图1 核糖体工程筛选丁醇高产菌路线图Fig. 1 Schematic diagram of screening for high butanol-yield strain by ribosome engineering.
1.2.7 溶剂及有机酸的测定
Agilent6890气相色谱测定发酵液中各溶剂的含量。检测条件:毛细管色谱柱 (30 m×0.25 mm× 0.50 µm),柱温120 ℃;进样口温度250 ℃;FID检测器温度300 ℃。H2流速40 mL/min;空气流速 400 mL/min;N2流速 30 mL/min,进样量0.2 µL。采用内标法测量,内标物为异丁醇。
Waters1525液相色谱测定有机酸浓度。检测条件:Aminex HPX-87H 有机酸分析柱(300 mm×7.8 mm),柱温 50 ℃,二极管阵列检测波长210 nm,示差折光检测器温度50 ℃。流动相及流速:0.005 mol/L H2SO4,0.5 mL/min,进样量:20 µL。
1.2.8 发酵液粘度测定方法
采用NDJ-1旋转式粘度计 (上海方瑞仪器有限公司) 测定。选择合适转子,将其浸没在待测发酵液中,室温下调整到合适的转速对发酵液粘度进行测定。
1.2.9 丁醇耐性实验
将活化好的菌种以 5% (V/V)的接种量接种于500 mL活化培养基中,37.5 ℃厌氧箱中培养。待菌体生长到OD620≈1.0时,充分混匀,分装于4个摇瓶中,每瓶100 mL,添加丁醇至浓度为0、 6、12、14 g/L。测定不同丁醇浓度下菌体的生长情况,以OD620表示。
2 结果与分析
2.1 链霉素对C. acetobutylicum L7的最小抑菌浓度
微生物具有一定的抗生素耐受浓度,高抗生素浓度下微生物全部被杀死,而低浓度下则发生突变的概率极低,不易获得突变菌株[14],因此确定抗生素筛选浓度非常重要。合适的抗生素浓度将有利于诱变工作的进行,提高诱变效率。最小抑菌浓度 MIC是反应抗菌活性和能力的一个指标,定义抗生素的 MIC为无菌落生长的最小抗生素浓度。
按照 1.2.3方法进行平板涂布,并记录不同链霉素浓度下C. acetobutylicum L7菌落生长情况,如图2所示。从图中可以看出,无链霉素的平板中,C. acetobutylicum L7生长好,培养至2 d时菌体铺满整个平板,无单菌落 (图A);在含有链霉素的平板上,菌体生长受到抑制。10 mg/L链霉素浓度下,C. acetobutylicum L7在2 d内无菌落生长 (图B),确定10 mg/L为MIC;在40~50 mg/L的链霉素平板中,大部分菌体被杀死,培养至4 d只有2~4个菌落存活,形态如图C和图D。生长出的菌落为链霉素抗性菌,有可能发生突变。
在确定链霉素的MIC后,按照1.2.4设计的技术路线,通过平板转接逐次提高链霉素浓度开始诱变筛选C. acetobutylicum L7,以获得丁醇高产菌株。
2.2 丁醇高产菌S3的获得及传代稳定性
得到丁醇高产的 C. acetobutylicum一直是人们关注的焦点。通过使用链霉素的核糖体工程育种技术大批量筛选,共获得 6株丁醇产量较高的菌株,其中7倍MIC链霉素抗性菌株S3丁醇产量最高,达到(12.00±0.10) g/L,如表 1所示。
通过分析表中筛选结果,得出链霉素用于诱变C. acetobutylicum提高丁醇产量,效果比较理想。抗性菌中,S13丁醇产量最低,为(11.72±0.11) g/L,提高了10.05%;其他5株菌丁醇产量提高率在10.14%~12.68%。
连续传代次数用于表达微生物菌株的使用寿命。传代稳定说明菌株性状优良,不易衰退[15]。通过核糖体工程技术筛选所获得的6株菌,对其进行传代发酵实验,发现S3的发酵性能最稳定,结果见表2。从表中可以看出,传代5次,S3的丁醇和总溶剂产量较稳定,分别维持在11.8 g/L和18.7 g/L左右,相比于原始菌一直稳定高产;丁醇在总溶剂中所占比例为0.62~0.63。说明S3遗传稳定性较好,有利于后续研究的进行。
2.3 S3与C. acetobutylicum L7的生长及发酵特性
为考察S3生长及发酵情况,将S3进行上罐发酵实验,并与原始菌进行了对比。两者的生长、耗糖、各溶剂、有机酸的生成及 ORP变化情况如图3~5所示。
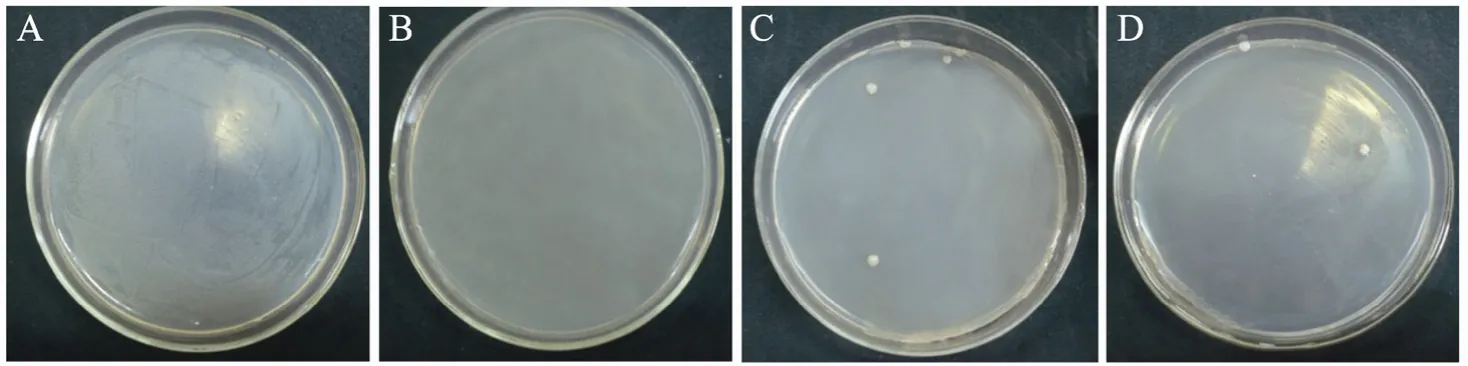
图2 链霉素平板中C. acetobutylicum L7的生长情况Fig. 2 The growth of C. acetobutylicum L7 on streptomycin plates with different concentrations. (A) 0 mg/L streptomycin. (B) 10 mg/L streptomycin. (C) 40 mg/L streptomycin. (D) 50 mg/L streptomycin.

表1 核糖体工程用于C. acetobutylicum L7的筛选结果Table 1 The high butanol-producing Clostridium strains by ribosome engineering

表2 S3传代稳定性Table 2 The genetic stability of S3
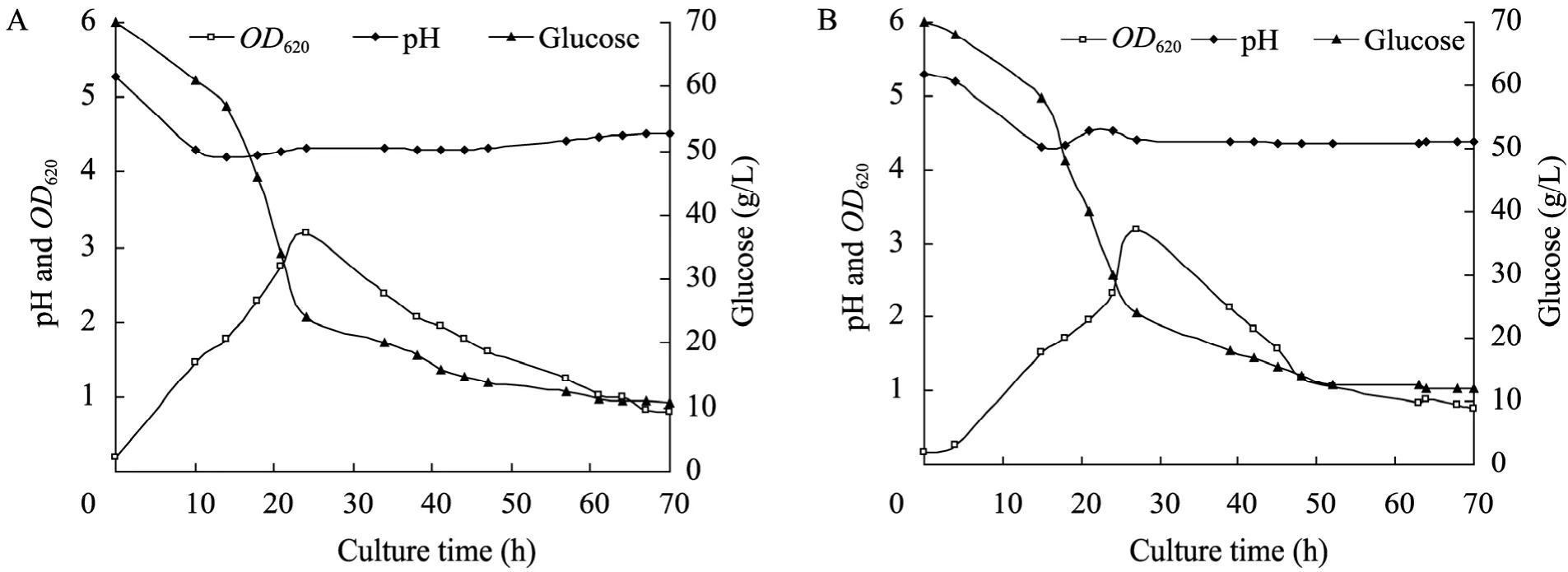
图3 原始菌 (A) 和S3 (B) 的OD620、pH及残糖曲线Fig. 3 Time course of OD620, pH and residual sugars by C. acetobutylicum L7 (A) and S3 strain (B).
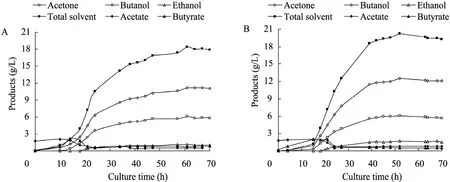
图4 原始菌 (A) 和S3 (B) 的发酵生产溶剂及有机酸曲线Fig. 4 Time course of solvents and acids production by C. acetobutylicum L7 (A) and S3 strain (B).
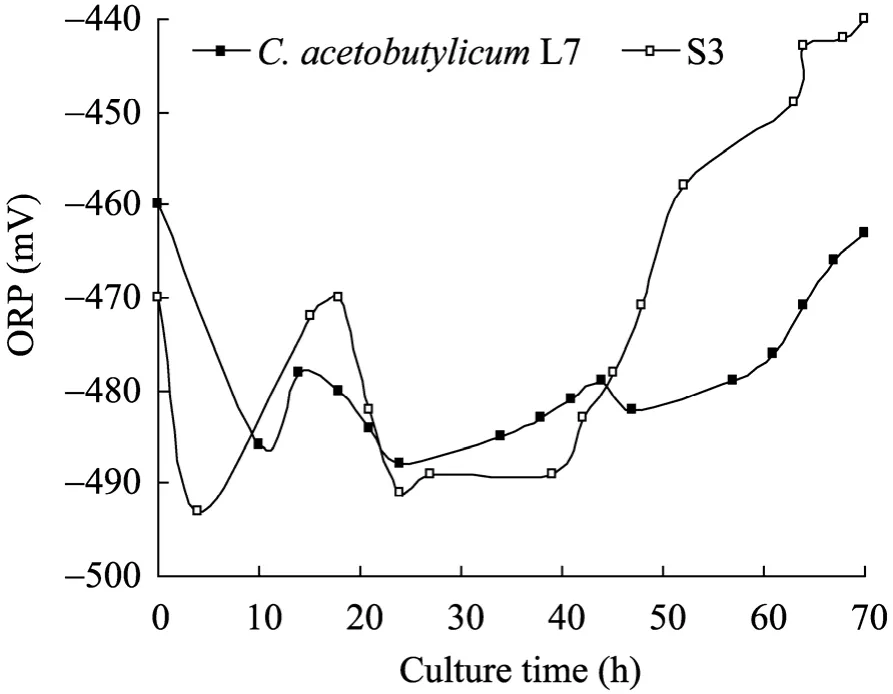
图5 原始菌和S3的ORP曲线Fig. 5 Time course of ORP by C. acetobutylicum L7 and S3 strain. ORP: oxidoreduction potential.
丁醇发酵分为两个时期:产酸期,菌体快速生长,产生有机酸 (乙酸和丁酸),pH降低;产溶剂期,菌体代谢相对缓慢,溶剂 (丙酮、丁醇和乙醇) 大量生成,并伴随乙酸和丁酸的重吸收,pH缓慢升高。发酵过程中,菌体为维持自身代谢,消耗大量的葡萄糖。如图3和图4所示,S3和原始菌在产酸期代谢旺盛,生物量 OD620快速增加;14 h左右,二者pH降到最低,即pH拐点,此时S3的pH值 (4.3) 和原始菌的 (4.2)相当,发酵液中积累乙酸的量分别为2.01 g/L、2.05 g/L;丁酸2.06 g/L、2.13 g/L,为发酵过程中酸积累的最大浓度。之后有机酸毒性显现,C. acetobutylicum开始酸的重吸收,酸浓度降低,溶剂快速生成,pH升高。随着发酵进行,S3和原始菌OD620达到最大,分别为3.18、3.19,此时51.4%的葡萄糖已被消耗。之后10 h, 溶剂继续生成,丁醇毒性开始发挥作用,菌体OD620下降;此阶段 S3和原始菌分别产生 3.78 g/L、2.26 g/L的丁醇,S3优势比较明显。随着丁醇浓度的增加,毒性进一步加大,加上营养匮乏,菌体代谢停止,发酵结束,各溶剂产量达到最大。
微生物代谢过程中会产生和消耗氧化还原力:NAD(P) 与 NAD(P)H,且胞内 NAD(P)/ NAD(P)H水平与菌体代谢和溶剂产生紧密相关[16-18]。氧化还原电位 (ORP) 是发酵体系氧化-还原性的外在反映[19]。分析原始菌和S3的发酵过程,发现 ORP变化与菌体生长、有机酸产生和重吸收、溶剂生成、pH变化密切偶联。如图3~5所示,菌体生长代谢产生大量有机酸,pH快速下降;同时产生大量能量和NAD(P)H,ORP随之降低。当有机酸积累到一定程度,毒性显现,其分子态形式可以透过细胞膜,自由进入菌体产生解偶联毒害作用[20-21]。于是开启酸的重吸收通路,溶剂大量生成,有机酸浓度下降,pH缓慢升高,ORP趋向稳定。随丁醇浓度的增加,细胞代谢受到抑制,菌体加速死亡,ORP升高至发酵结束。ORP在发酵全程伴随菌体生理代谢发生响应变化[16]。发酵前24 h,S3的ORP表观响应更为迅速,在−493 mV至−470 mV之间变化,浮动较大;随后的15 h内,其维持在−490 mV左右,相比原始菌,此阶段还原力依然较强,产生5.52 g/L丁醇,而原始菌只生成 3.15 g/L,说明在产溶剂期为主的生理代谢阶段,S3迅速积累溶剂丁醇,并具有更高的代谢通量,与 ORP的阶段性稳定 (−490 mV状态下) 存在一定的关联性。针对C. acetobutylicum进行ORP调控以提高菌体发酵性能的研究已有报道[22],全程控制ORP有利于菌体提前进入溶剂期,溶剂产量提高,发酵时间缩短,且 ORP的有效调控将改变细胞的代谢流及生理过程。本研究通过核糖体工程选育的菌株S3,其发酵过程ORP变化与丁醇代谢通量亦存在明显关联,暗示若ORP控制在−490 mV,菌体丁醇代谢通量极有可能进一步提高。
对S3与C. acetobutylicum L7发酵终点时,消耗糖浓、各溶剂产量及丁醇/糖等参数进行了比较 (表3)。
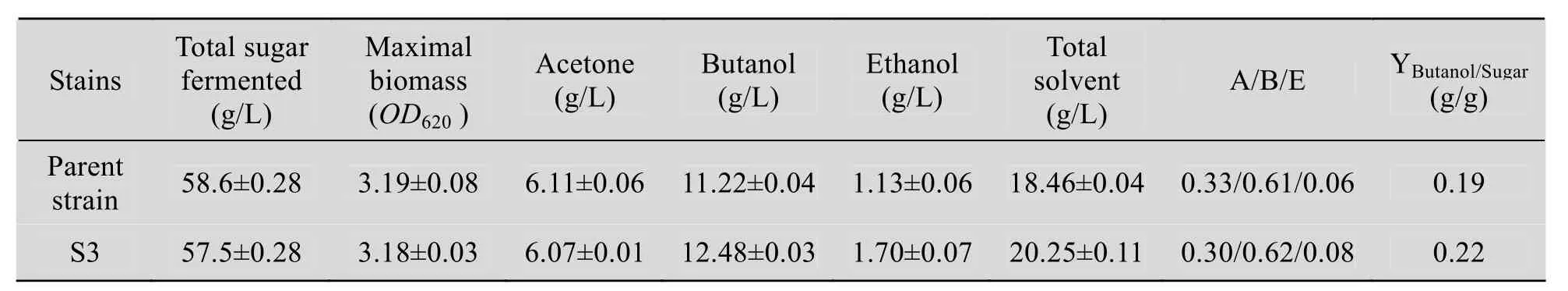
表3 S3与原始菌的比较Table 3 The comparison of S3 with C. acetobutylicum L7
C. acetobutylicum发酵产生3种溶剂:丙酮(A)、丁醇 (B) 和乙醇 (E)。发酵终点,A、B、E三者比例一般在3∶6∶1左右。表3数据显示,S3和原始菌的 A/B/E比例相差不大;生长过程中消耗的葡萄糖和最大生物量OD620基本相同,而最终S3生成的丁醇和乙醇比原始菌高,分别提高11.2% (1.26 g/L)、50% (0.57 g/L),丙酮相差很小,总溶剂相应提高9.7% (1.79 g/L);丁醇/糖转化率由原始菌的0.19提高到0.22。S3发酵结束用时52 h,相比原始菌少9 h,发酵周期缩短,而产生的丁醇较多,说明S3丁醇的生产效率较高,达到 0.24 g/(L·h),相比提高 30.5%;因此S3在发酵中将更有优势,可以产生较多的溶剂,其经济可行性得到提高。整个丁醇发酵过程中,有机酸的重吸收与溶剂产生相偶联。S3与原始菌有机酸的重吸收量分别为2.70 g/L、2.89 g/L,相差不大;二者丙酮产量基本相同,而S3的丁醇与乙醇总产量相比原始菌高1.83 g/L,可以推测S3的丁醇与乙醇代谢通量有可能发生了变化。生成丁醇与乙醇的途径中,丁醇脱氢酶和乙醇脱氢酶是两个关键酶,且相互关联;二者结构是否发生改变或活性增强,是否为核糖体工程作用的靶点,有待于下一步进行研究确定。
丁醇发酵后期,发酵液里存有大量菌体和一些其他物质,例如金属离子、无机盐、菌体自溶产生的蛋白、多糖、核酸等,致使发酵液具有一定的粘性,影响了整个发酵体系的传质传热,并增加搅拌的能量消耗[23]。若粘度较大,发酵效果和设备利用率将降低,不利于后续工作的进行,增加溶剂分离的难度。对S3发酵液的粘度进行考察,发现其粘度由原始菌的 10 mPa·s减小到4 mPa·s,降低了 60%;这将便于溶剂分离和发酵工作的展开,从而减少发酵成本。
2.4 S3与C. acetobutylicum L7的丁醇耐性
微生物发酵法生产生物燃料时例如乙醇、1-丙醇等,目标产物通常会对菌体产生很大的毒害作用,影响菌体生长。丁醇发酵中,丁醇因其疏水性 (离液序列高) 堆积在细胞膜表面,干扰膜功能,其通透性和流动性增加,使ATP、离子、磷脂、RNA、蛋白等流失,破坏适合菌体生长的pH,影响胞内新陈代谢和能量的运输及转换,加速了菌体的死亡[5,24-25]。丁醇的毒性作用限制了发酵液中丁醇的浓度,增加后期的分离成本。因此对S3的丁醇耐性进行了考察,如图6所示不同丁醇浓度下 (0、6、12、14 g/L),C. acetobutylicum L7与S3菌体的生长情况。

图6 不同丁醇浓度下原始菌与S3的生长情况Fig. 6 Growth profles of C. acetobutylicum L7 and S3 challenged with different concentration of butanol. (A) 0 g/L butanol. (B) 6 g/L butanol. (C) 12 g/L butanol. (D) 14 g/L butanol.
从图中可以看出,在添加丁醇的情况下,S3的生长均强于原始菌,同时间点OD620一直较原始菌大,表现出较强的丁醇耐受力。原始菌在12 g/L丁醇中,起初能够维持生长,最大OD620为1.39;之后因其丁醇耐受低,菌体大量死亡。在添加14 g/L丁醇浓度下,S3菌体OD620缓慢增加,最大为 1.41;而原始菌无法存活,OD620一直减小,得出S3的丁醇耐受浓度比原始菌高,分别为14 g/L和12 g/L。
丁醇对C. acetobutylicum的毒害作用相当严重。无丁醇的培养基中,原始菌和S3生长良好,最大OD620各为2.43、2.46;含有丁醇的情况下,原始菌与S3的生长受到明显抑制,菌体增殖缓慢,最大OD620都未能达到2.4;并且4种丁醇浓度下,出现正增殖的时间逐渐缩短,分别为:原始菌12 h,12 h,6 h,0;S3 15 h,15 h,9 h,6 h。在耐受丁醇极限浓度下 (原始菌 12 g/L,S3 14 g/L),OD620只能增殖到1.40,比无丁醇浓度下减小42.9%。可以得出,丁醇毒性严重影响了菌体的生长代谢。文献指出[26-27],丁醇作用下,菌体细胞膜的组成发生很大改变;菌体不能维持内部pH,ATPase活性降低。基于此,下一步可对S3进行丁醇耐性机理的探索,并提出提高丁醇耐受程度的策略,为进一步提高丁醇产量奠定基础。
3 结论
本研究首次使用链霉素诱变 C. acetobutylicum L7提高丁醇产量。筛选获得的菌株,丁醇产量提高率均超过10%;其中S3产量最高,达到12.48 g/L,丁醇耐受程度也有显著提高,表明核糖体工程技术在筛选丁醇高产菌株方面有效、可行。通过分析比较 S3与C. acetobutylicum L7发酵性能差异,推测S3的丁醇及乙醇代谢通量有可能发生变化,后续研究工作将对菌株S3的抗性突变、丁醇耐受机理及代谢通路作进一步的研究,为更大程度提高丁醇产能提供技术支持。
REFERENCES
[1] Lee SY, Park JH, Jang SH, et al. Fermentative butanol production by clostridia. Biotechnol Bioeng, 2008, 101(2): 209−228.
[2] Gheshlaghi R, Scharer JM, Young M, et al. Metabolic pathways of clostridia for producing butanol. Biotechnol Adv, 2009, 27(6): 764−781.
[3] Qureshi N, Blaschek HP. Recent advances in ABE fermentation: hyper-butanol producing Clostridium beijerinckii BA101. J Ind Microbiol Biotechnol, 2001, 27(5): 287−291.
[4] Hermann M, Fayolle F, Marchal R, et al. Isolation and characterization of butanol-resistant mutants of Clostridium acetobutylicum. Appl Environ Microbiol, 1985, 50(5): 1238−1243.
[5] Ezeji T, Milne M, Price ND, et al. Achievements and perspectives to overcome the poor solvent resistance in acetone and butanol-producing microorganisms. Appl Microbiol Biotechnol, 2010, 85(6): 1697−1712.
[6] Xie SJ, Xiao J, Xu J. Advance in microbial ribosome engineering. Acta Microbiol Sin, 2009, 49(8): 981−986.谢庶洁, 肖静, 徐俊. 微生物核糖体工程研究进展. 微生物学报, 2009, 49(8): 981−986.
[7] Ochi K. From microbial differentiation to ribosome engineering. Biosci Biotechnol Biochem, 2007, 71(6): 1373−1386.
[8] Hosaka T, Ohnishi-Kameyama M, Muramatsu H, et al. Antibacterial discovery in actinomycetes strains with mutations in RNA polymerase or ribosomal protein S12. Nat Biotechnol, 2009, 27(5): 462−464.
[9] Ochi K, Okamto S, Tozawa Y, et al. Ribosome engineering and secondary metabolite production. Adv Appl Microbiol, 2004, 56: 155−184.
[10] Sun YW, Cui CB. Antibiotic-resistance mutation technique in microorganism breeding. J Intern Pharm Res, 2008, 35(3): 213−217.孙玉雯, 崔承彬. 抗生素抗性筛选在微生物菌株选育中的作用. 国际药学研究杂志, 2008, 35(3):213−217.
[11] Kurosawa K, Hosaka T, Tamehiro N, et al. Improvement of α-amylase production by modulation of ribosomal component protein S12 in Bacillus subtilis 168. Appl Environ Microbiol, 2006, 72(1): 71−77.
[12] Hosokawa K, Park NH, Inaoka T, et al. Streptomycin-resistant (rpsL) or rifampicinresistant (rpoB) mutation in Pseudomonas putida KH146-2 confers enhanced tolerance to organic chemicals. Environ Microbiol, 2002, 4(11): 703−712.
[13] Hai L, Huang YQ, Liao G J, et al. Ribosome engineering of Streptomyces sp. FJ3 from Three Gorges reservoir area and metabolic product of the selected mutant strain. Acta Microbiol Sin, 2011, 51(7): 934−940.海乐, 黄宇琪, 廖国建, 等. 放线菌 Streptomyces sp. FJ3的核糖体工程改良与活性产物的分离. 微生物学报, 2011, 51(7): 934−940.
[14] Wang JY, Zhu SG, Xu CF. Biochemistry. 3rd ed. Beijing: Higher Education Press, 2002: 523−549.王镜岩, 朱圣庚, 徐长法. 生物化学. 3版. 北京:高等教育出版社, 2002: 523−549.
[15] Kashket ER, Cao ZY. Isolation of a degenerationresistant mutant of Clostridium acetobutylicum NCIMB 8052. Appl Environ Microbiol, 1993, 59(12): 4198−4202.
[16] Du CY, Yan H, Zhang Y P, et al. Use of oxidoreduction potential as an indicator to regulate 1,3-propanediol fermentation by Klebsiella pneumoniae. Appl Microbiol Biotechnol, 2006, 69(5): 554−563.
[17] Meyer CL, Papoutsakis ET. Increased levels of ATP and NADH are associated with increased solvent production in continuous cultures of Clostridium acetobutylicum. Appl Microbiol Biotechnol, 1989, 30: 450−459.
[18] Girbal L, Soucaille P. Regulation of Clostridium acetobutylicum metabolism as revealed by mixed-substrate steady-state continuous cultures: role of NADH/NAD ratio and ATP pool. J Bacteriol, 1994, 176(21): 6433−6438.
[19] Husson F, Tu VP, Santiago-Gomez M, et al. Effect of redox potential on the growth of Yarrowia lipolytica and the biosynthesis and activity of heterologous hydroperoxide lyase. J Mol Catal B: Enzym, 2006, 39(1/4): 179−183.
[20] Herrero AA, Gomez RF, Snedecor B, et al. Growth inhibition of Clostridium thermocellum by carboxylic acids: a mechanism based on uncoupling by weak acids. Appl Microbiol Biotechnol, 1985, 22(1): 53−62.
[21] Huesemann M, Papoutsakis ET. Effect of acetoacetate, butyrate, and uncoupling ionophores on growth and product formation of Clostridium acetobutylicum. Biotechnol Lett, 1986, 8(1): 37−42.
[22] Wang SH, Zhu Y, Zhang YP, et al. Controlling the oxidoreduction potential of the culture of Clostridium acetobutylicum leads to an earlier initiation of solventogenesis, thus increasing solvent productivity. Appl Microbiol Biotechnol, 2012, 93(3): 1021−1030.
[23] Kilonzo PM, Margaritis A. The effects of non-Newtonian fermentation broth viscosity and small bubble segregation on oxygen mass transfer in gas-lift bioreactors: a critical review. Biochem Eng J, 2004, 17(1): 27−40.
[24] Dunlop MJ. Engineering microbes for tolerance to next-generation biofuels. Biotechnol Biofuels, 2011, 4(1): 32.
[25] Liu SQ, Qureshi N. How microbes tolerate ethanol and butanol. New Biotechnol, 2009, 26(3/4): 117−121.
[26] Lepage C, Fayolle F, Hermann M. Changes in membrane lipid composition of Clostridium acetobutylicum during acetone-butanol fermentation: effects of solvents, growth temperature and pH. J Gen Microbiol, 1987, 133(1): 103−110.
[27] Bowles LK, Ellefson WL. Effects of butanol on Clostridium acetobutylicum. Appl Environ Microbiol, 1985, 50(5): 1165−1170.
